蛋白含量检测的抗干扰新方法
董源,汤灵玲,林林,卢山
南京师范大学生命科学学院 江苏省分子医学生物技术重点实验室,江苏 南京 210046
蛋白质定量检测是生命科学研究领域广泛涉及的重要生物化学分析内容。多年以来,尽管有先进的蛋白检测方法如质谱、荧光分析等[1-2]在不断发展,而福林酚试剂 (Folin-Ciocalteu’s reagent)、二辛可宁酸 (Bicinchoninic acid,BCA)和考马斯亮蓝 G-250 (Coomassie brilliant blue G-250,CBB,也被称作Bradford) 等仍然是最常规使用的比色测定方法[3]。这些方法是利用氧化还原反应产物或者染料-蛋白质络合物的颜色深浅与蛋白质浓度间存在的线性关系而绘制标准曲线来测定样品中可溶性蛋白浓度的,但在实际应用中,常常会因为多种化学物质干扰而影响检测结果,导致使用局限[4]。
例如,福林酚试剂法会受到表面活性剂、金属离子螯合剂、还原剂及含氮化合物[5-6]等的严重干扰;BCA方法虽然受表面活性剂影响小,但对金属离子螯合剂、还原剂等的存在很敏感[5];CBB法与福林酚试剂法类似,对表面活性剂的耐受性差[7],所以这些方法总会因为蛋白质测定液中非蛋白组分的存在而影响蛋白质含量的精确测定,具体使用时,通常需要针对不同的干扰物质选用不同的测定方法。如果蛋白液中存在表面活性剂,可以选用BCA方法检测蛋白质含量;而蛋白溶液中含有金属离子螯合剂,就需要替换为CBB法检测蛋白质含量。这样,不仅给蛋白质含量检测带来操作上的不便,也使得不同溶液中蛋白质含量的比较分析成为困难,还可能对后续实验的可靠性产生影响,因此,人们总希望能够找到好方法解除干扰。有研究针对某些特定的样品如骨骼肌[8],或某些特定操作如聚丙烯酰胺双向凝胶电泳[9],探讨适宜的检测方法;也有文献报道,通过检测850 nm吸收值对CBB法进行药液蛋白质含量分析中羧乙烯聚合物 (Carbopol) 产生的干扰进行校正[10];而含糖蛋白溶液则可以通过蛋白质沉淀又溶解的方法来去除糖分导致的干扰[11]等;但迄今为止,对于多种常见的干扰物质并没有很好的解决办法,所以开发简便的受多种干扰物质影响小的蛋白质定量检测方法十分必要。
本研究在广泛使用的福林酚试剂法[12]的基础上,重新设计制定实验试剂的组成与配比以及操作程序,建立蛋白质检测新方法的同时又探讨新方法发色产物的优选检测波长以及稳定性,还分析新方法对多种常见干扰物质的包容性,能够为蛋白质的快速准确定量提供方便。
1 材料与方法
1.1 材料
1.1.1 主要试剂
牛血清白蛋白 (Bovine serum albumin,BSA)、苯甲基磺酰氟 (Phenylmethanesulfonyl fluoride,PMSF) 从Sigma公司购入,蛋白酶抑制剂混合物 (Protease inhibitor cocktail,PIC) 购自Roche公司。聚乙二醇辛基苯基醚 (Triton X-100)、ß-巯基乙醇 (ß-Mercaptoethanol,ß-ME)和乙二胺四乙酸二钠盐(EDTA·Na2,EDTA) 购自Amresco公司。二硫苏糖醇 (Dithiothretol,DTT)、乙二醇二乙醚二胺四乙酸 (Ethylene glycol bis (2-aminoethyl) tetraacetic acid,EGTA)、硫酸铵(Ammonium sulfate,(NH4)2SO4) 和尿素 (Urea)购自Bio Basic公司。福林酚试剂由上海荔达生物科技公司出品。细胞培养用胎牛血清 (Fetal bovine serum,FBS)为PAA Laboratories公司生产,低限基本培养基 (Minima essential medium,MEM) 粉末购自GIBCO公司。十二烷基硫酸钠(Sodium dodecyl sulfate,SDS)、钒酸钠 (Na3VO4)等其他常用试剂购自国药集团。
1.1.2 主要仪器
CO2细胞培养箱 (Thermo Scientic公司),酶标仪(Bio-TEK公司),小型涡旋器。
1.2 方法
1.2.1 标准样品的制备
称取一定量 BSA溶解于蒸馏水中,调配终浓度为4 g/L,-20 ℃贮存备用。
1.2.2 动物细胞裂解液的制备及干扰物质的添加
细胞全蛋白待测样品是通过裂解液收集、破碎细胞而获取的上清液[13],因此细胞蛋白质含量测定中的非蛋白干扰物质主要来源于裂解液组分 (细胞体积可忽略不计),细胞裂解液里添加的干扰成分的含量即为待测样品干扰物质的浓度。首先制备 10倍基本裂解液 (200 mmol/L Tris-HCl (pH 7.5),1.5 mol/L NaCl,10 mmol/L EDTA和10% SDS),保存于-20 ℃。使用前冰上稀释,并根据实验要求分别添加不同含量的各种干扰组分如DTT或者β-ME等,以及1 mmol/L Na3VO4,1 mmol/L PMSF和1×PIC。当讨论表面活性剂对蛋白测定的干扰时,基本裂解液组成不包含SDS,而各表面活性剂浓度按照具体实验设计要求添加。
1.2.3 动物细胞培养及全蛋白提取
将 1.5×106人前列腺癌细胞 PC-3接种于10 mL含5% FBS-MEM培养基的100 mm细胞培养皿,在5% CO2,37 ℃细胞培养箱内培养,生长至50%饱和以上时,用4 ℃预冷的PBS(-)洗涤2次后,加入500 mL预冷的PBS (-),然后用刮棒冰上收集细胞,并平均分配细胞液于1.5 mL离心管,4 ℃、10 000×g离心10 min,去上清,再移入包含不同成分的细胞裂解液,涡旋振荡,放置冰上30 min,重复离心操作,收集上清液用于蛋白质含量测定,也可以放置-20 ℃保存备用。
1.2.4 蛋白定量新方法及标准曲线的建立
分别配制A贮存液 (含1.89 mol/L碳酸钠和1 mol/L 氢氧化钠),B贮存液 (含0.25% 酒石酸钠 (W/V)、0.125% 硫酸铜 (W/V) 和 2.5% SDS (W/V)) 及C发色液 (为2 mol/L福林酚原液的10倍稀释液,用HCl调整pH至1) 于室温下存放。
将 BSA标准蛋白溶液按照二倍稀释法用蒸馏水稀释至最低浓度为0.0625 g/L的7个梯度浓度,分别取5 mL BSA标准溶液各梯度样品放入96孔细胞培养板中;每个标准样品至少有3个重复样,空白对照为同体积的蒸馏水;然后加入25 mL工作液 (临用前混合50个体积A贮存液与1个体积B贮存液)。再加入200 mL发色液,混合均匀,室温下放置 30 min,利用酶标仪在570~630 nm范围任一波长下测定吸光值。获取数值后输入Excel软件,横坐标为标准样品浓度,纵坐标为对应吸光值,然后添加趋势线,获得线性回归方程及线性相关系数。另外,将标准样品连续放置0.3、1、2、4、8、24 h后在630 nm波长下检测吸光值,用于比较标准曲线的稳定性。
1.2.5 蛋白定量新方法对干扰物质的耐受性分析
进行标准曲线实验的同时,将与标准蛋白溶液同样体积的0.1~4 g/L浓度区间的细胞蛋白样品也加入96孔板中,每个待测样品至少有3个重复样;然后每个样品添加25 mL工作液,最后加入 200 mL发色液,混合均匀,室温下放置30 min,利用酶标仪在590 nm波长下测定吸光值。获得数值后绘制标准曲线,并获取线性回归方程,再将待测样品吸光值导入标准曲线回归方程计算样品中蛋白质含量。
1.2.6 统计方法
2 结果与分析
2.1 不同吸收波长下的BSA标准曲线和发色产物稳定性的比较
以 BSA为标准样品,分别在 570、595或630 nm波长下绘制的标准曲线如图1所示,其相应的线性相关系数平方 (R2) 值分别为 0.998、0.998或 0.997,均大于通常标准曲线要求的 R2值 (0.996)[14],说明用该标准品作标准曲线,所求的回归方程是有意义的,且在上述波长范围均可用作新方法的检测波长,其中595 nm处获得的标准曲线的吸光值最大,为优选波长。此外,630 nm波长下最高浓度标准样品的吸光值随时间变化的曲线如图2所示,可以看出4 h内几乎没有变化,8 h后下降约1.8%,24 h后下降14%,说明新方法获得的发色产物在数小时内颜色基本能够保持恒定。
2.2 表面活性剂对细胞蛋白质含量测定的影响
细胞裂解液中 SDS含量不断上升时,新方法对蛋白质浓度测量结果见图3A。SDS含量即使高达10%,细胞全蛋白浓度也几乎没有变化。
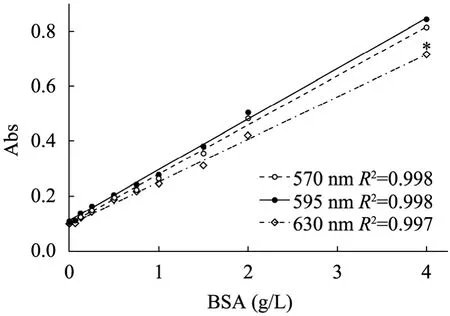
图1 蛋白质定量检测的BSA标准曲线Fig. 1 BSA standard curves for protein assay.

图2 发色产物最大吸光值24 h内的变化Fig. 2 Time course for maxi-Absorbances during 24 h.

图3 表面活性剂存在下细胞全蛋白含量的检测Fig. 3 Protein assay for cell lysates in the presence of 3 surfactants, respectively. (A) Lysis buffer containing SDS. (B) Lysis buffer containing NP-40 or TritonX-100.
如果采用其他的常用表面活性剂TritonX-100或 NP-40来处理细胞,则蛋白质浓度测量结果的变化见图3B,当TritonX-100含量小于或等于1%,NP-40含量小于或等于2%,对蛋白定量没有明显的影响。
2.3 金属离子螯合剂对细胞全蛋白定量的影响
不同浓度金属离子螯合剂EDTA或EGTA存在下,新方法对细胞蛋白质浓度的检测结果如图4所示,50 mol/L EDTA使蛋白质浓度显著降低,而2 mmol/L EGTA使蛋白质浓度下降了42%。但是EDTA与EGTA浓度分别为25 mmol/L或1 mmol/L及以下则对蛋白质检测没有明显干扰。
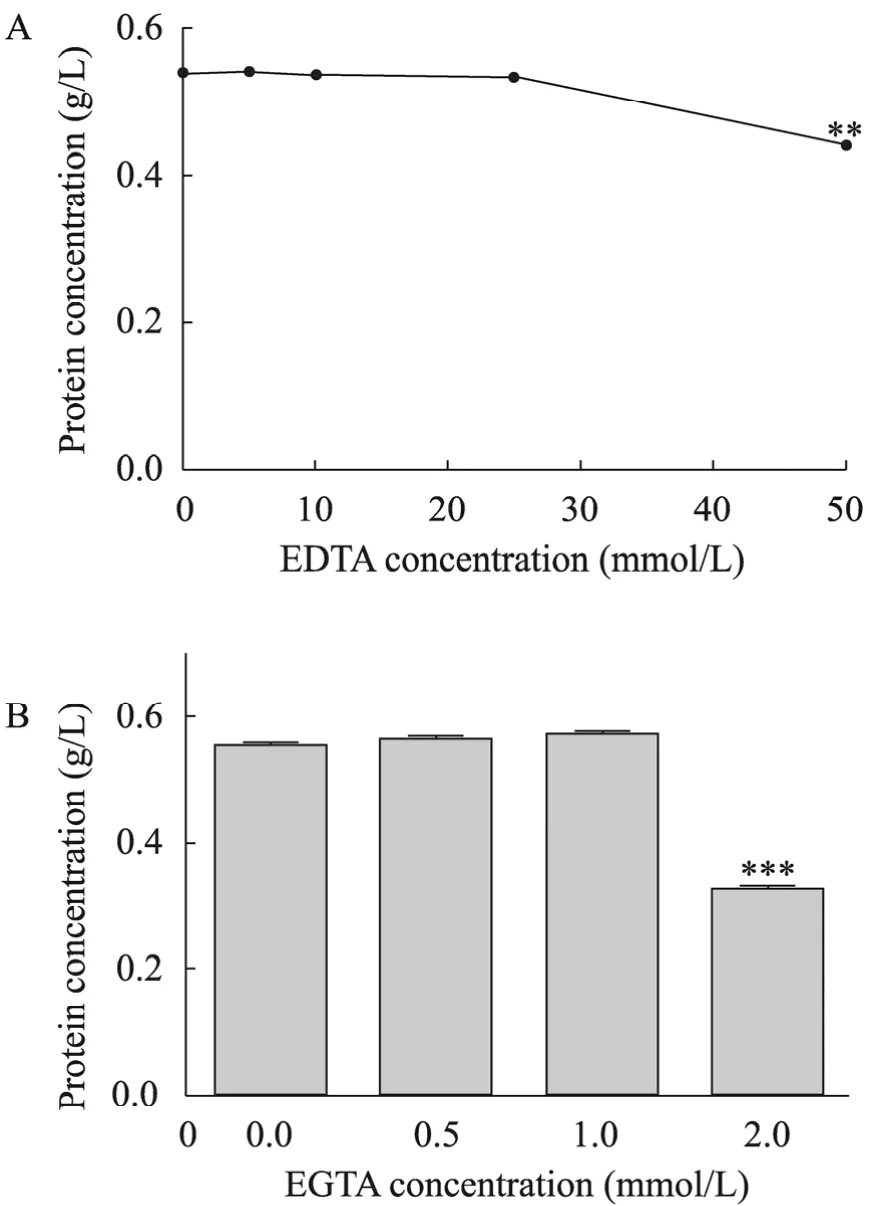
图4 金属离子螯合剂存在下全蛋白含量的检测Fig. 4 Protein assay for cell lysates in the presence of chelators, respectively. (A) EDTA. (B) EGTA.
2.4 还原剂对细胞全蛋白定量的影响
新方法对含有不同浓度DTT或β-ME的细胞蛋白裂解液进行的定量测定结果见图5,可以看出样品溶液中包含DTT或β-ME在1 mmol/L及以下对蛋白质浓度检测没有显著影响。
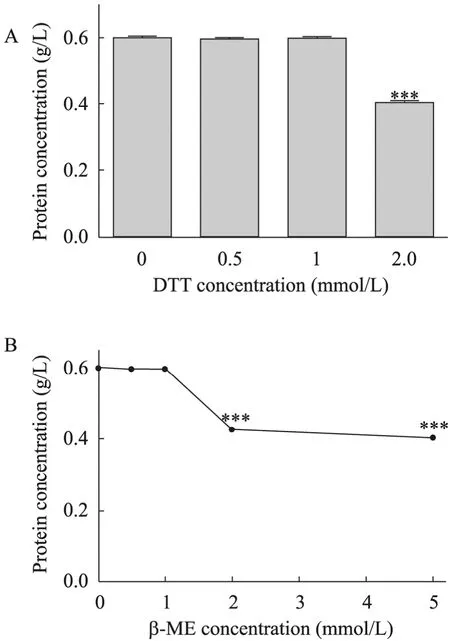
图5 还原剂存在下全蛋白含量的检测Fig. 5 Protein assay for cell lysates in the presence of reductants, respectively. (A) DTT. (B) β-ME.
2.5 含氮物质对细胞全蛋白定量的影响
常用的含氮物质硫酸铵和尿素存在时,细胞蛋白定量的结果如图 6所示,蛋白质溶液中硫酸铵含量小于或等于0.5 mol/L,或尿素含量小于或等于 4 mol/L 对蛋白质检测不会造成显著干扰。

图6 含氮化合物存在下全蛋白含量的检测Fig. 6 Protein assay for cell lysates in the presence of nitrogen-containing compunds, respectively. (A) (NH4)2SO4. (B) Urea.
3 讨论
福林酚试剂法是1951年Lowry等[15]在双缩脲反应基础上,引入福林酚试剂来扩大反应信号的蛋白质含量检测方法,因此又被称作 Lowry法。主要依据是利用碱性条件下Cu2+与肽骨架的-CO-NH-基团形成的蓝色络合物将鳞钨酸和鳞钼酸还原为钨和钼蓝而进一步呈色的结果[16]。常用的试剂组成如表1所示,首先使蛋白质样品置于碱性环境,然后与CuSO4试剂混合,室温放置约15 min,再加入福林酚试剂放置45 min,660 nm波长下测定吸光值。此方法的主要缺点是对许多干扰物质的包容性差,如表面活性剂TritonX-100或 SDS含量仅达1%,金属离子螯合剂EDTA浓度达到10 mmol/L,尿素含量达3 mol/L,或硫酸铵含量达3% (约0.227 mol/L),以及还原剂如硫醇等的存在就会严重干扰测试结果[5-6,17]。
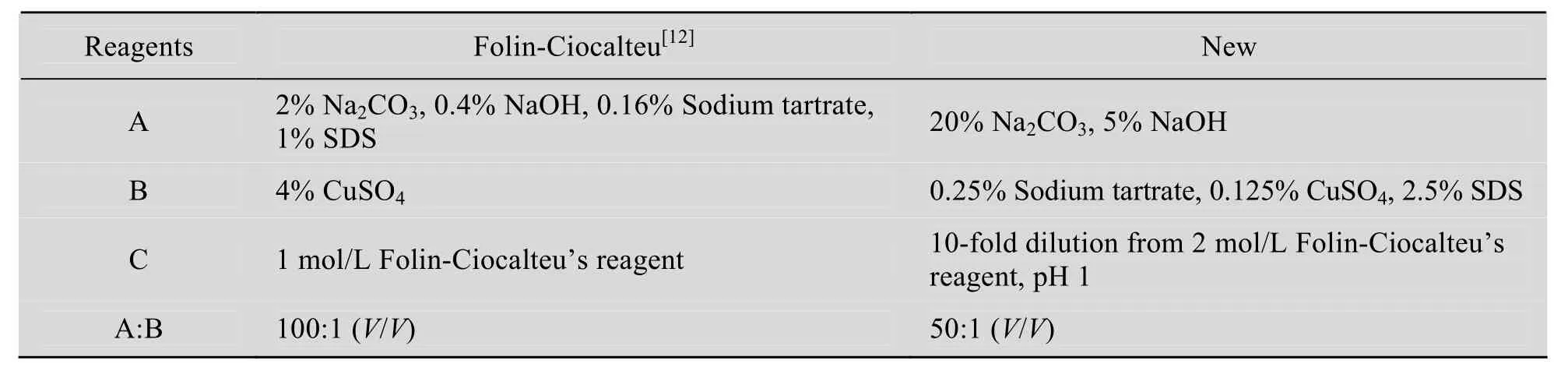
表1 比较新方法与目前常用的福林酚法试剂配比及组成Table 1 Comparison for reagent components between new and Folin-Ciocalteu’s reagent protein assay
长久以来,有相关文献报道对此方法在不同领域的应用进行改良[18-20],有的增加了操作的复杂性,但效果仍然有限。本研究探讨的新方法没有对原方法繁杂化,且将 SDS耐受性提高了约10倍。实验中SDS浓度没有进一步增加,是因为待测样品溶液的粘度随着 SDS浓度的上升而不断增加,几乎已达到操作的极限,这应该是SDS作为表面活性剂在溶液中的增稠作用所导致的。另外,少量TritonX-100和NP-40也不影响测定结果,可见新方法对表面活性剂的包容性明显增加,这可能与B贮存液中添加的少量SDS有关联[21]。
新方法对金属离子螯合剂 EDTA耐受浓度增加1倍以上,这可能是因为B贮存液的Cu2+浓度显著降低而减少了工作液中螯合剂能够结合的底物,因此提高了对螯合剂的包容性。
同时,新方法对还原剂DTT和β-ME均显示出一定的耐受性;对含氮化合物如硫酸铵的包容性增加2倍,对尿素的耐受性也有所提高,但相关机理不清楚。这可能是新方法显著增强蛋白质样品在未加入福林酚试剂前的碱性环境,使 Cu2+与肽骨架的-CO-NH-基团形成的蓝色络合物反应更完全的影响;而且我们实验使用的蛋白质含量检测范围明显高于常用福林酚试剂法的5~100 mg/L[12],因此新方法对干扰物质包容性的增强也可能与检测灵敏度的变化相联系,需要将来进一步分析验证。此外,本实验仅以细胞裂解液为测定样品,没有尝试其他蛋白样品的检测,也没有针对福林酚试剂法的其他干扰成分如糖类、氨基酸及多肽的影响进行探讨,因此新方法的适用范围等还有待深入研究。
综上所述,新方法操作简单、迅速,实验结果重复性好,稳定性高,检测范围0.1~4 g/L,对多种常见干扰成分具有较好的包容性,如表2所示,适用不同裂解液制备的细胞蛋白检测,在生命科学研究领域应具有广泛应用前景。
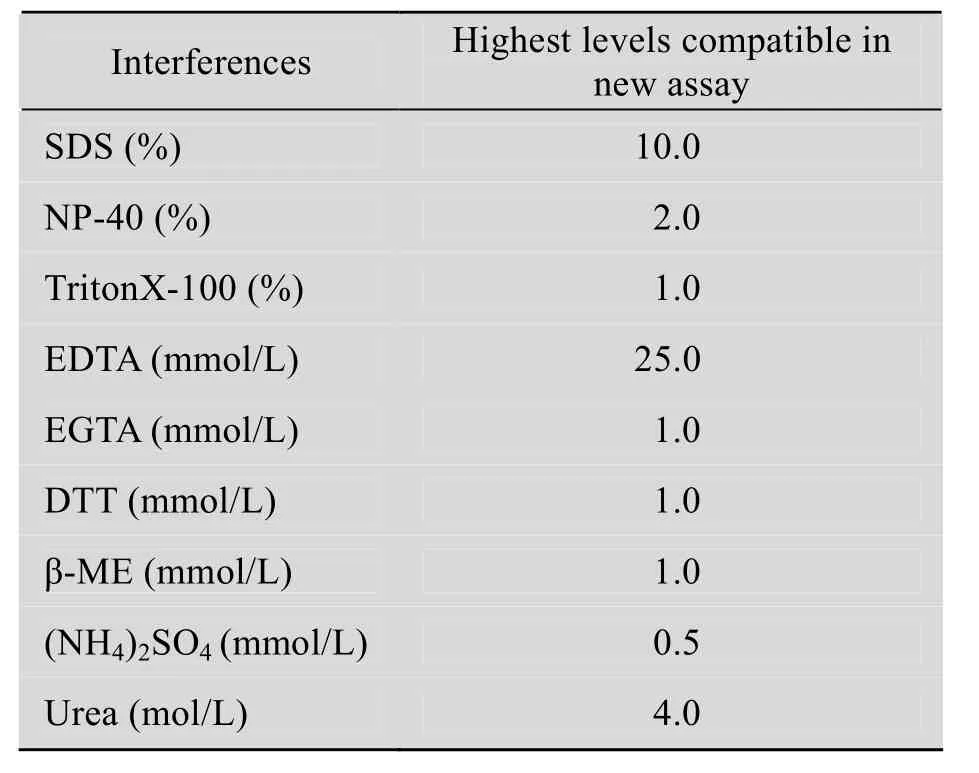
表2 新方法对常见干扰物质的最大耐受浓度Table 2 Highest levels for interferences used in new assay
REFERENCES
[1] Wang M, You J, Mass spectrometry for protein quantification in biomarker discovery. Methods Mol Biol, 2012, 815: 199−225.
[2] Hieb AR, D'Arcy S, Kramer, MA, et al. Fluorescence strategies for high-throughput quantification of protein interactions. Nucleic Acids Res, 2012, 40(5): e33.
[3] Melander C, Tømmeraas K. The influence of sodium hyaluronate molecular weight on protein content according to Lowry and Coomassie blue assays. Carbohydrate Polymers, 2008, 74(3): 745−748.
[4] Goldring JP. Protein quantification methods to determine protein concentration prior to electrophoresis. Methods Mol Biol, 2012, 869: 29−35.
[5] Lozzi I, Pucci A, Pantani OL, et al. Interferences of suspended clay fraction in protein quantitation by several determination methods. Anal Biochem, 2008, 376(1): 108−114.
[6] Walker JM. The Bicinchoninic Acid (BCA) assay for protein quantitation//The Protein Protocols Handbook. 3rd ed. Totowa, NJ: Humana Press Inc., 2009: 11−15.
[7] Kruger NJ. The bradford method for protein quantitation // The Protein Protocols Handbook, 3rd ed. Totowa: Humana Press Inc., 2009: 17−24.
[8] Seevaratnam R, Patel BP, Hamadeh MJ. Comparison of Total Protein Concentration in Skeletal Muscle as Measured by the Bradford and Lowry Assays. J Biochem, 2009, 145(6): 791−797.
[9] Kao SH, Wong HK, Chiang CY, et al. Evaluating the compatibility of three colorimetric protein assays for two-dimensional electrophoresis experiments. Proteomics, 2008, 8(11): 2178−2184.
[10] Carlsson N, Borde A, Wolfel S, et al. Quantification of protein concentration by the Bradford method in the presence of pharmaceutical polymers. Anal Biochem, 2011, 411(1): 116−121.
[11] Banik SP, Pal S, Ghorai S, et al. Interference of sugars in the Coomassie Blue G dye binding assay of proteins. Anal Biochem, 2009, 386(1): 113−115.
[12] Lindeboom N, Wanasundara PKJPD. Interference of phenolic compounds in Brassica napus, Brassica rapa and Sinapis alba seed extracts with the Lowry protein assay. Food Chem, 2007, 104(1): 30−38.
[13] Xu SS, Yan CL, Liu LM, et al. Effects of different cell lysis buffers on protein quantification. J Zhejiang Univ: Med Sci, 2008, 37(1): 45−50.徐珊珊, 阎春兰, 刘黎明, 等. 细胞裂解液对蛋白质定量方法的影响. 浙江大学学报: 医学版, 2008, 37(1): 45−50.
[14] National Pharmacopoeia Committee. Pharmacopoeia of the People's Republic of China, 2010 ed. Beijing: China Medico-Pharmaceutical Science & Technology, 2010.国家药典委员会. 中华人民共和国药典-2010年版. 北京: 中国医药科技出版社, 2010.
[15] Lowry OH, Rosebrough NJ, Farr AL, et al. Protein measurement with the Folin phenol reagent. J Biol Chem, 1951, 193(1): 265−275.
[16] Avella AC, Görner T, de Donato P. The pitfalls of protein quantification in wastewater treatment studies. Sci Total Environ, 2010, 408(20): 4906−4909.
[17] Noble JE, Bailey MJA. Quantification of protein// Burgess RR, Deutscher MP, eds. Guide to Protein Purification. 2nd ed. San Diego: Elsevier Academic Press, 2009: 73−95.
[18] Peterson GL. Review of the folin phenol protein quantitation method of Lowry, Rosebrough, Farr and Randall. Anal Biochem, 1979, 100(2): 201−220.
[19] Peterson GL. Determination of Total Protein, Methods in Enzymology. London: Academic Press, 1983, 91: 95−119.
[20] Frølund B, Griebe T, Nielsen PH. Enzymatic activity in the activated-sludge floc matrix. Appl Microbiol Biotechnol, 1995, 43(4): 755−761.
[21] Field A, Field J. Melamine and cyanuric acid do not interfere with Bradford and Ninhydrin assays for protein determination. Food Chem, 2010, 121(3): 912−917.

