乳糖诱导鸡β-防御素3在大肠杆菌中的融合表达
莫 索,贺元欣,刘 欢,王 彦,魏 刚,张 琦,王会岩 (吉林医药学院检验学院,吉林 吉林 132013)
细菌对传统抗生素的耐药性是当今全球性难题,因此,发展新的动物抗感染战略势在必行。防御素(defensin)作为一种新型的生物活性肽,具有独特的抗菌机理,不受传统抗生素耐药菌株影响,它可以替代抗生素而发挥更广谱的抗菌作用,同时它也可以作为免疫调节剂来调节机体免疫系统,在感染中发挥重要作用[1]。据报道,鸡体内的基因共编码了13种鸡β-防御素(chicken defensinβ,Gal),这些鸡防御素基因被命名为Gallinacin 1-13[2]。由于机体自身合成法操作复杂,不易提取分离纯化,而且获得量少,因此现在多采用基因工程合成法,此法易于大规模生产防御素,并且基因克隆与表达为其大规模生产提供了手段[3]。
虽然非代谢性乳糖类似物IPTG(isopropyl-β-D-thiogalactoside)是一种广泛使用的高效乳糖操纵子的诱导剂,它通过调节Lac启动子,使目的基因片段得以转录获得所需目的蛋白[4]。目前IPTG通常用于外源蛋白的发酵生产中,但价格昂贵且对人体存在潜在的毒性,世界上一些国家已明文规定在生产人用重组蛋白的生产工艺中不能使用IPTG进行诱导[5],因此寻求IPTG的替代物已成为国内外规模化生产基因工程重组药物的迫切需求。乳糖是乳糖操纵子的天然诱导物,与IPTG不同的是它必须借助乳糖通透酶作用进入细胞,并经β-半乳糖苷酶作用转化为异乳糖后方能起诱导作用[6-7]。同时乳糖本身作为一种碳源,不断被细菌代谢利用。因此乳糖作为诱导剂的诱导过程,其诱导剂浓度始终处于动态变化过程中,诱导过程更加复杂,需对其诱导条件进行更细致的研究和优化[8-10]。本研究在成功构建Gal-3工程菌的基础上,用乳糖作为诱导剂进行高效表达研究,为工业化生产奠定基础。
1 资料与方法
1.1 质粒和菌株
含pET20b-SUMO-Gal-3重组质粒的大肠杆菌BL21(DE3)由王会岩博士构建。
1.2 主要试剂及仪器
蛋白胨(Tryptone)和酵母粉(Yeast Extract)为英国OXOID公司产品;IPTG为德国Merck产品;氨苄青霉素(Amp)和Marker为Takaka产品;丙烯酰胺、甲叉丙烯酰胺、SDS为Sigma产品;乳糖及其他试剂为国产分析纯试剂;JY92-2D超声破碎仪为宁波新芝生物科技股份有限公司产品;电泳仪、凝胶成像系统为美国BIO-RAD公司产品。
1.3 乳糖诱导工艺优化
从超低温冰箱取出一支甘油菌,按1∶200的比例接种到LB培养基中,37℃、180 r/min培养过夜,按1∶100接种量将活化菌种接种到装有50 mL LB培养基(含100 mg/L Amp)的150 mL三角瓶中,37℃、180 r/min培养,并在不同条件下进行诱导。当菌体A600达到0.6~0.8时分别添加20%乳糖至终浓度为0.5、1.0、2.0、5.0、8.0 和 10.0 g/L,37 ℃ 诱导时间3 h,确定最佳诱导浓度;在菌体生长至A600为0.6~0.8时加入乳糖进行诱导,诱导0~6 h,确定最佳诱导时间;在菌体生长的不同时期A600为0.2、0.4、0.6、0.8、1.0和1.2时加入相同量的乳糖进行诱导,37℃诱导时间3 h,确定最佳诱导时机;选择不同的温度(25℃、30℃、33℃、37℃)进行诱导,确定最佳诱导温度;根据上述确定的条件,当菌体生长到最佳诱导时机时,一次加入乳糖至最佳浓度,同时分两次(间隔1.5 h)添加乳糖至终浓度作对照,确定乳糖添加方式对蛋白表达量的影响。
1.4 重组蛋白可溶性分析
收集菌液,8 000 r/min离心10 min。菌体按1∶8比例(kg/L)用Tris-HCl pH 9.2粗提工作液重悬,吹打均匀后,于冰浴下超声破碎,每次8 min,共计6次。破碎后以12 000 r/min离心15 min,取上清,进行SDS-PAGE凝胶电泳,测定目标蛋白在上清和沉淀中的含量。
2 结果
2.1 最适诱导浓度确定
摇瓶实验中,不同浓度的乳糖对外源蛋白的表达均有一定作用。随乳糖浓度的增加产物表达量随之增加,在2.0 g/L达到最大值,然后随乳糖浓度的增加表达量趋于减少,乳糖浓度过高则对菌体的生长有明显抑制作用,产物表达量也降低,并用IPTG诱导的最佳条件作对照。经凝胶成像分析得出:最佳乳糖诱导浓度为2.0 g/L。见图1。
2.2 最佳诱导时间的确定
菌液37℃培养至A600为0.6~0.8后加入最佳诱导浓度乳糖,进行最佳诱导时间的测定。每间隔1 h取1 mL菌液,并进行全菌SDS-PAGE电泳。诱导3 h后表达量及产物量最高。随着诱导时间延长产物的表达量会逐渐降低。见图2。
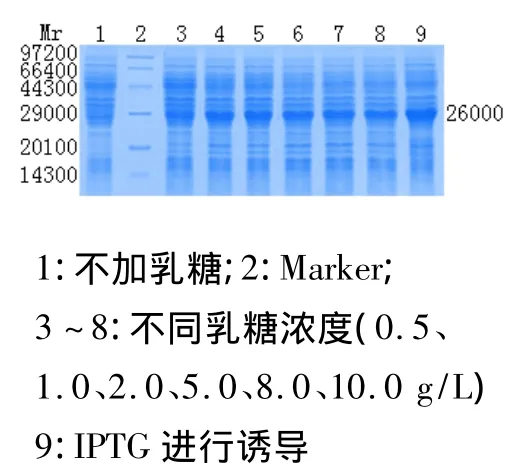
图1 最佳诱导浓度的确定
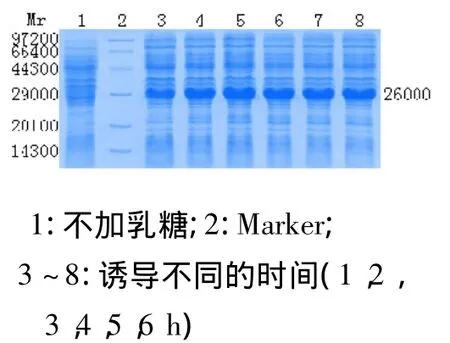
图2 最佳诱导时间的确定
2.3 最适诱导时机的确定
将活化的种子接种于LB培养基中,并在A600为0.2、0.4、0.6、0.8、1.0 和1.2 时加入2.0 g/L 乳糖诱导3 h。在菌体生长的各个阶段加入乳糖进行诱导均能表达出外源蛋白,且菌体密度变化不大,表明乳糖对菌体生长无抑制作用。经凝胶成像分析得出:在A600为0.8时诱导产物表达量达到最大值。见图3。
2.4 最佳诱导温度的确定
选择不同诱导温度(25℃、30℃、33℃和37℃)进行实验。诱导结束后取1 mL菌液,并进行全菌SDS-PAGE电泳。经凝胶成像分析得出:温度升高有利于蛋白的表达,随温度升高蛋白表达量增大,37℃蛋白表达量最高。见图4。
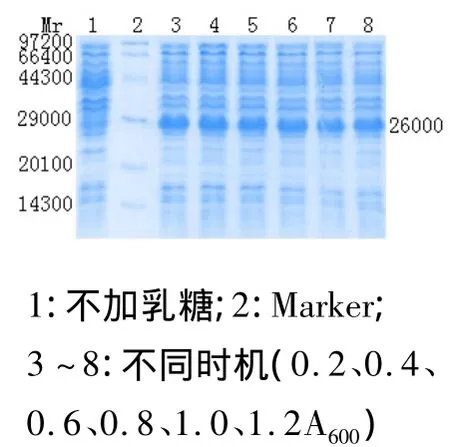
图3 最佳诱导时机的确定
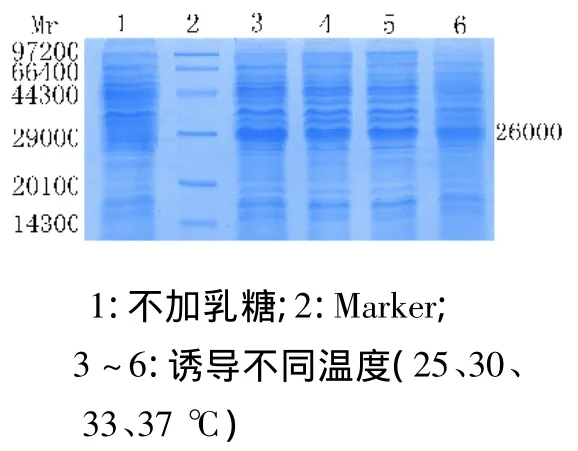
图4 最佳诱导温度的确定
2.5 分批添加乳糖对蛋白表达量的影响
菌体培养至A600为0.6~0.8时,加入乳糖。一次加入乳糖至最佳浓度,另一组分两次(间隔1.5h)加入乳糖至最佳浓度。进行全菌SDS-PAGE电泳。经凝胶成像分析得出:添加乳糖的表达量略高,乳糖本身可以作为碳源被菌体所利用,分批添加有利于蛋白的表达。见图5。
2.6 重组蛋白可溶性分析
收集菌液,8 000 r/min离心10 min。菌体按1∶8比例(kg/L)用Tris-HCl pH 9.2粗提工作液重悬,吹打均匀后,于冰浴下超声破碎,每次8 min,共计6次。破碎后以12 000 r/min离心15 min,取上清,进行SDS-PAGE凝胶电泳,测定目标蛋白在上清和沉淀中的含量,目标蛋白绝大多数分布于上清中,以可溶性表达为主。
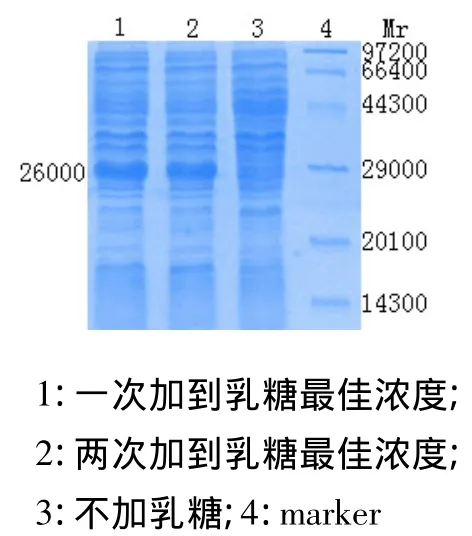
图5 乳糖添加方式的影响
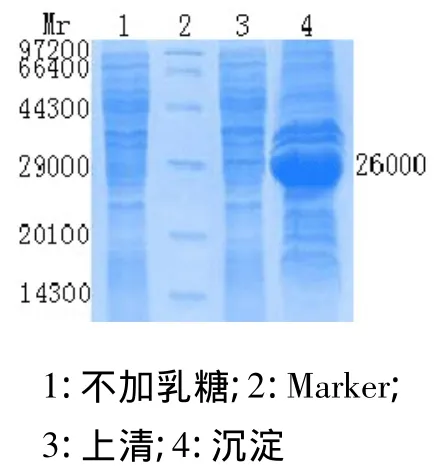
图6 乳糖诱导外源蛋白的可溶性分析
3 讨论
乳糖操纵子是目前研究得最为详尽的基因操纵子。乳糖是乳糖操纵子的天然诱导物,与IPTG诱导机理有明显差别:IPTG可以直接进入大肠杆菌细胞内部而发挥诱导作用,且它是一种非代谢性诱导物,不会被菌体利用。因此乳糖的诱导过程及其对菌体的影响比IPTG复杂得多,诱导效率也不如IPTG,但乳糖所具备的无毒和价廉的优点,使得其在重组蛋白的大规模发酵生产中仍具有优于IPTG的潜在价值和优势[11]。
本实验深入研究了以乳糖为诱导剂时,影响菌株生长和目的产物表达的诱导剂浓度、诱导时机、诱导时间和添加方式等因素,从中分析并寻找适合工程菌株生长和诱导的条件。本实验结果表明:在工程菌生长对数初期加入终浓度为2.0 g/L的乳糖37℃诱导3 h获得蛋白表达量最大,分批添加乳糖效果稍好一点,与IPTG相比较,两者表达量相当。从蛋白可溶性分析可知:由于IPTG是非常高效的诱导剂,加入后外源蛋白迅速表达易形成包涵体,为后期的纯化带来不便;而乳糖为温和的诱导物,其诱导作用相对缓慢,因此外源蛋白有充足时间进行正确折叠,尽可能形成正确构象,在表达动力学上有利于蛋白的可溶性表达,易以可溶性蛋白存在于细胞内[12],蛋白基本都存在于上清中。本研究结果证明了乳糖可以作为诱导剂诱导蛋白表达,初步证明其可行性。为以乳糖为诱导剂生产基因重组工程药物提供了一定的可行性实验数据,为工业化生产提供了有益的参考和借鉴。
[1]齐珂珂,康相涛,陈丽颖.鸡β-防御素的研究及其应用前景[J].饲料工业,2005,26(24):57-59.
[2]Xiao Yanjing,Hughes A L,Ando J,et al.A genome-wide screen identifies a single beta-defensin gene cluster in the chicken:implications for the origin and evolution of mammalian defensins[J].BMC Genomics,2004,5(1):56-57.
[3]王海荚,祁克宗,彭开松,等.鸡β-防御素-2基因的克隆及原核表达载体的构建[J].家禽科学,2008(3):6-9.
[4]莫 索,刘 欢,王 彦,等.IPTG诱导条件对鸡 β-防御素表达量影响的研究[J].吉林医药学院学报,2010,32(1):33-35.
[5]杨书慧,赵胜军,刘 军,等.乳糖诱导甜蛋白Monellin在大肠杆菌中的表达[J].中国生物工程杂志,2008,28(3):53-58.
[6]方 方,沈佳胤,傅 珒,等.乳糖诱导重组人TRAIL胞外片段在大肠杆菌中的表达[J].安徽农业大学学报,2008,35(2):266-270.
[7]王宏华,凌红丽,马向东,等.乳糖诱导重组鸡γ干扰素基因在大肠杆菌中的表达[J].中国动物检疫,2008,25(6):25-27.
[8]余永恒,李清雄,王革非,等.乳糖诱导重组人睫状神经营养因子在大肠杆菌中的可溶性表达[J].中国生物制品杂志,2007,20(1):43-46.
[9]Li Zhaopeng,Zhang Xu,Tan Tianwei.Lactose2 induced production of human Soluble B lymphocyte stimulator(hs-BLyS)in E.coli with different culture st rategies[J].Biotechnol Lett,2006,28(7):477-483.
[10]陈 亮,任随周,许玫英,等.乳糖替代IPTG诱导脱色酶Tpmd基因在大肠杆菌中的高效表达[J].微生物通报,2009,36(4):551-556.
[11]吴一凡,张双全,高秀玉,等.乳糖诱导pET载体表达重组蛋白的研究[J].南京师大学报:自然科学版,2002,25(1):89-93.
[12]田海山,唐 禄,王晓杰,等.乳糖诱导角质细胞生长因子-2在大肠杆菌中的表达[J].吉林大学学报:医学版,2010,36(2):262-266.

