纯化红茶多糖抑制白血病细胞增殖的实验研究
彭利剑,赵晓盼,王海杰,赵文秀 (.德惠市人民医院检验科,吉林 德惠 30300;.吉林医药学院008级药学本科,吉林吉林 303;3.吉林医药学院化学教研室,吉林吉林 303)
中国是茶文化的发源地,传统中医、现代医学都重视茶的药用研究[1]。糖多糖除具有降血脂、防治血栓和增强免疫等功效外,近年来还发现粗制多糖对多种肿瘤有抑制作用[2]。我国的产茶区分布广,茶叶品种多,但对茶的成分和功效影响最大的却是茶叶发酵的程度。绿茶为非发酵茶,红茶为充分发酵茶,而乌龙茶属于半发酵茶。茶的鲜叶经发酵后所含的多酚被氧化、叶绿素被分解,因此变为红色、褐色或黑色;此过程中糖的含量和结构也发生改变[3]。目前认为,红茶的糖类含量相对高,组成与结构稳定,从中提取多糖抗肿瘤的研究受到重视。本研究以中国福建的“正山小种”红茶为原料,采用水浸泡的方式提取茶多糖,用大孔树脂层析法制备纯化的红茶多糖(black tea polysaccharides,bTPS),并采用酪胺还原法标记异硫氰酸荧光素(fluorescinisothiocyate,FITC),以bTPS和FITC-bTPS为材料,研究纯化红茶多糖对白血病细胞增殖的抑制作用。
1 材料与方法
1.1 材料
人白血病细胞K562和U937冻存于液氮中;自制bTPS和FITC-bTPS避光保存于-20℃;1640培养液购自Hyclone公司;小牛血清购自浙江黄岩四季青公司;CCK-8细胞增殖检测试剂盒购自碧云天生物技术有限公司。
1.2 细胞培养
复苏K562细胞和U937细胞,在含10%血清的1640培养液、37℃和5%CO2条件下培养,每周传代3次,取对数生长期细胞用于实验。
1.3 细胞增殖检测
将细胞浓度调整为104/mL,按每孔100 μL接种96孔板,用1640培养稀释 bTPS,分别加入到96孔板,使终浓度分别为 0、25、50、75 和 100 μg/mL。继续培养48 h后,每孔加入10 μL CCK-8试剂,空白对照组加入10 μL的PBS。37℃孵育2 h后,用多功能酶标仪检测各孔在450 nm的吸光度值(A450)。按照下列公式计算细胞增殖抑制率(inhibition rate,IR)

1.4 辐射条件及测量工具
取对数生长期细胞,调密度为5×106/mL。取100 μL细胞悬液,加FITC-bTPS使其终浓度分别为0、25、50 和 100 μg/mL,室温下避光反应 1 h 后 PBS洗2次,将细胞悬于250 μL PBS,加入等体积的4%多聚甲醛,细胞被固定于2%的多聚甲醛。相同方法加入50 μg/mL的FITC-bTPS,与细胞共同孵育时间分别0、30、60和120 min,洗涤后固定细胞。细胞样品避光存放于4℃冰箱,24 h内完成流式细胞术分析。先以无FITC-bTPS处理的细胞为阴性对照组,收集细胞在FL1(525 nm)通道内的荧光信号;调节电压和增益,使细胞群位于阴性区域内,设置阴性门“N”和阳性门“P”。来检测各实验组细胞,以阳性细胞的百分率和阳性细胞群平均荧光强度(mean)来显示FITC-bTPS与细胞间的结合。
1.5 统计学分析
以3次独立实验的平均值代表最终结果,均数间的比较采用t检验,显著性标准α=0.05。
2 结果
2.1 bTPS抑制白血病细胞增殖
随浓度增加(0、25、50、75 和 100 μg/mL),U937和K562细胞的增殖受到显著抑制,相同浓度下bTPS对U937细胞抑制作用强于K562细胞 (P<0.05)(图1)。

图1 bTPS抑制U937和K562细胞增殖
2.2 FITC-bTPS与白血病细胞结合
50 μg/mL的 FITC-bTPS 反应1 h,U937 和 K562细胞中阳性百分率接近;但前者荧光强度值高(P<0.05)(图2)。通过分析发现,U937细胞阳性率随FITC-bTPS浓度增加而增加(表1);但反应时间对阳性率影响较小(表2)。

图2 FITC-bTPS与U937和K562细胞结合
表1 浓度对FITC-bTPS结合白血病细胞的影响(S)

表1 浓度对FITC-bTPS结合白血病细胞的影响(S)
*对照组比较,P<0.05
组 别g/mL 21.3±3.4 18.4±3.7 50 μg/mL 44.8 ±4.5* 43.2 ±5.1*100 μg/mL 67.5 ±6.3* 64.2 ±5.2 U937 K562 25 μ*
表2 孵育时间对FITC-bTPS结合白血病细胞的影响(S)
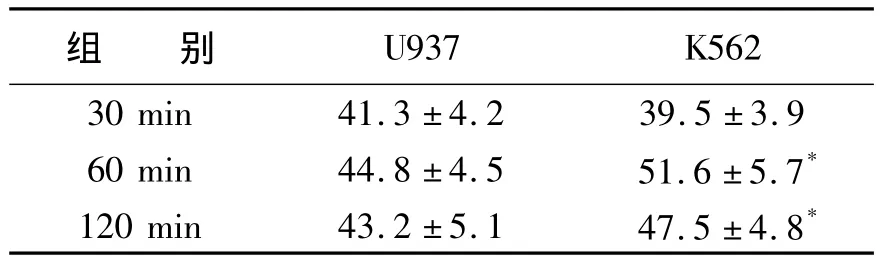
表2 孵育时间对FITC-bTPS结合白血病细胞的影响(S)
*对照组比较,P<0.05
组 别U937 K562 30 min 41.3±4.2 39.5±3.9 60 min 44.8±4.5 51.6±5.7*120 min 43.2±5.1 47.5±4.8*
3 讨论
多糖(polysaccharides)是由单糖之间脱水而形成糖苷键,并以糖苷键线性或分枝连接而成的聚合物。多糖广泛存在于动物细胞膜、植物和微生物细胞壁中,参与细胞的各种生命现象的调节[3]。人们对动物来源的壳聚糖,植物来源的灵芝多糖和细菌来源的脂多糖、甘露糖等多糖的研究较多,上述多糖均具有一定的免疫调节以及抗肿瘤活性。甘露聚糖与细胞膜上甘露糖受体结合,而壳聚糖和脂多糖与Toll样受体家族(Toll like receptors,TLRs)中的 TLR-2、TLR-4和TLR-7结合[4]。单核巨噬细胞TLR-4等结合配体后,细胞内的p-38 MAPK信号通路被激活,启动IL-2、IL-8、TNF-α 和 IFN-γ 等细胞因子基因转录,增强单核巨噬细胞吞噬、杀伤功能;而活化巨噬细胞可通过释放细胞因子等方式促进T细胞的活化。虽然大量实验表明多糖可通过调节免疫功能抗肿瘤,但近年来多糖分子抑制肿瘤细胞增殖或诱导其凋亡的证据也陆续被报道。例如,灵芝多糖直接诱导体外培养的白血病细胞THP-1和HL-60细胞发生凋亡;壳聚糖抑制乳腺癌细胞 MCF-7增殖并诱导其凋亡[5-6]。以往对茶叶抗肿瘤成分的研究主要集中于多酚化合物,因此茶多糖对肿瘤细胞的直接作用了解较少。本研究发现,纯化的bTPS可以浓度依赖的方式直接抑制两种白血病细胞的增殖。FITC-bTPS结合细胞后,流式细胞术分析其以浓度依赖的方式与细胞结合。相同浓度的FITC-bTPS处理后,U937细胞的平均荧光强度高于K562细胞,而bTPS对U937的抑制效应也强于K562细胞。这些结果表明,bTPS可直接结合肿瘤细胞而抑制其增殖。
利用纯化的bTPS和FITC-bTPS,不仅可以测定茶多糖对肿瘤细胞增殖、凋亡的影响,也可利用荧光素的示踪作用,深入探讨其抗肿瘤的机制。bTPS是否也与细胞表面的TLRs结合而发挥作用,将在今后的实验中继续探讨。
[1]谢明勇,聂少平.茶叶多糖的研究进展[J].食品与生物技术学报,2006,25(2):107-114.
[2]崔宏春,江和源,张建勇,等.茶多糖的结构研究进展[J].安徽农业科学,2009,37(1):200-203.
[3]沈 健,陈增良,沈香娣,等.茶多糖抗肿瘤及其增强免疫作用的研究[J].浙江预防医学,2007,19(8):10-12.
[4]毛 华,楚慧丽,刘月冉,等.免疫细胞多糖受体及其研究方法[J].食品与药品,2011,13(3):136-138.
[5]Jiang M,Ouyang H,Ruan P,et al.Chitosan derivatives inhibit cell proliferation and induce apoptosis in breast cancer cells[J].Anticancer Res,2011,31(4):1321-1328.
[6]Wang J H,Zhou Y J,Zhang M,et al.Active lipids of Ganoderma lucidum spores-induced apoptosis in human leukemia THP-1 cells via MAPK and PI3K pathways[J].J Ethnopharmacol,2012,139(2):582-589.

