小麦叶片色素的分离与理化性质研究
王 超,王文秀,2,张兵涛,3
(1.济宁学院生命科学与工程系,山东 曲阜 273155;2.青岛大学医学院,山东 青岛 266001;3.南京工业大学生物与制药工程学院,江苏 南京 211800)
色素分为天然色素(Natural Pigments)和合成色素,前者是指直接从生物中提取出来的色素,后者是指人工合成的色素[1]。目前研究较多的天然色素主要是叶绿素和类胡萝卜素。叶绿素包括叶绿素a,叶绿素b;类胡萝卜素分胡萝卜素(Carotenes)和叶黄素类(Xanthophylls),前者是不含氧的类胡萝卜素的总称,后者是含氧类胡萝卜素的总称,它又包括叶黄素(1utein)、玉米黄质、α-胡萝卜素、β-胡萝卜素、隐黄质、紫黄质、新黄质、花药黄质、正未黄素、番茄红素、辣椒红素等。
类胡萝卜素按其化学结构和溶解性又可分为胡萝卜素和叶黄素两类。类胡萝卜素系共轭烯烃,能有效防止自由基对脂质内侧生物膜的损害。在植物中类胡萝卜素担当叶绿体光合作用的辅助色素并保护叶绿素免受强光破坏,同时也是合成植物激素ABA的前体。叶黄素类系共轭多烯烃的含氧衍生物,是有效的氧自由基捕获剂[2]。其中玉米黄色素存在于很多植物中,作为单线态氧及自由基的清除剂,与氧以及由亚油酸氧化而产生的自由基快速反应,阻止脂质过氧化反应的链式传递,其抗氧化效果与二丁基羟基甲苯(BHT)相当,将成为新一代营养抗氧化剂。紫黄质(violaxanthin,V)、花药黄质(antheraxanthin,A)和玉米黄质(zeaxanthin,Z)参与叶黄素循环[3],其中A和Z在光破坏防御过程中起重要作用[4-5]。
天然色素的开发与应用已成为研究的热点[6],许多天然色素在植物体中是稳定的,但被分离后容易受各种因素(如光照、温度、氧化、pH值、介质极性、金属离子、添加剂等)的影响而发生褪色、变色等变化而影响其着色效果,严重制约了天然色素代替人工合成色素的进程[7-8]。在食品工业生产实践中,Vc和山梨酸钾是常用的食品添加剂,这些物质对于叶绿体中色素结构稳定性的影响还未见报道。以小麦叶片作为试验材料,分离叶绿体中常见的8种色素并研究其理化性质,其中重点研究了叶绿体色素分离后,不同浓度的Vc和山梨酸钾处理对于其稳定性的影响,旨在为天然色素的研究和其在食品生产中的应用提供参考。
1 材料与方法
1.1 供试材料
试验所用小麦品种为济麦22。小麦种子浸泡过夜,转入铺有4层纱布的培养皿中。在室温下培养至2叶一心期,选择旗叶为供试材料。
1.2 试验方法
1.2.1 叶绿体中色素的提取 称取小麦叶片0.5 g,剪碎,加少许石英砂和碳酸钙粉,先加少量100%丙酮,把材料研磨成匀浆,再加入丙酮提取色素,最终定容至5 mL,然后于3 500 g离心5 min,上清液即为叶绿体色素的提取液。
1.2.2 叶绿体色素的分离 采用硅胶板薄层层析法(TLC)。硅胶板(规格:100 mm×200 mm,厚度:0.20~0.25 mm,青岛海洋化工厂分厂)使用前在106℃烘干1 h。展层剂为石油醚(沸程 60~90℃)∶异丙醇∶水=100∶12∶0.25(V∶V),总体积为 100 mL。用微量进样器抽取色素提取液,在距离底边2 cm将样品点成一条直线,用冷风吹干后重复点样,点样控制在80~100 μL之间。点样后将硅胶板放入层析缸中于暗处展层,当展层剂到达顶部时取出硅胶板,记录各色素位置并依次将其刮下用乙醇溶解,提取液于3 500 g离心5 min,取上清液备用。
1.2.3 小麦叶片色素最大吸收波长的测定 将分离得到的8种色素溶液分别置于723PC分光光度计(上海菁华科技仪器有限公司)中进行波长扫描(400~800 nm),记录各色素的最大吸收波长。
1.2.4 光照对小麦叶片类胡萝卜素含量的影响
称取小麦叶片0.2 g,加95%的乙醇定容至50 mL,放于BIC-250人工气候箱(上海博讯实业有限公司医疗设备厂)中,25℃黑暗浸提24 h。然后用纱布过滤,除去叶片,置于15 000 lx光强下照射,在10 h内每隔1 h测定色素提取液的吸光度值,根据公式:Cc=(1 000 A470-2.05 Ca-114.8 Cb)/245 计算类胡萝卜素含量。
1.2.5 不同光照时间对小麦叶片各色素吸光度值的影响 取8种色素提取液分别放置于8个比色皿中,并在其最大吸收峰下测定其吸光度值,然后将比色皿依次放进BIC-250人工气候箱中(温度为25℃,湿度为43%,光照为15 000 lx),在7.5 h内每隔0.5 h测量其在最大吸收波长下的吸光度值。
1.2.6 不同温度对小麦叶片各色素吸光度值的影响 取8种色素溶液,置于离心管中各3 mL(离心管提前用黑色不透光的塑料膜包好,以避免光照对色素稳定性造成的影响),将色素溶液分别放于4℃、15℃、30℃、45℃、60℃的 DC-2006低温恒温槽中30 min,然后用723PC可见分光光度计分别测量其吸光度值。
1.2.7 抗坏血酸(Vc)和山梨酸钾对小麦叶片类胡萝卜素含量的影响 称取小麦叶片0.2 g,加95%的乙醇定容至50 mL,置于BIC-250人工气候箱中,25℃黑暗处浸提24 h,用纱布过滤。在浸提液中分别加入 0.01、0.02、0.03、0.04、0.05 g Vc 和山梨酸钾,然后依次放在15 000 lx光强下照射,每隔1 h测量吸光度值。
以上试验各重复3次,所得数据用Microsoft Excel 2003进行统计分析。
2 结果与分析
2.1 小麦叶片叶绿体色素的分离
图1所示,硅胶板薄层层析系统可将小麦叶片叶绿体色素分离出8个条带:从下至上依次为:1-新黄质(浅黄色)、2-花药黄质(浅黄色)、3-紫黄质(浅黄色)、4-玉米黄质(浅黄色)、5-叶黄质(黄色)、6-叶绿素 b(绿色)、7-叶绿素 a(黄绿色)、8-β-胡萝卜素(橙黄色),分离效果较好。

2.2 小麦叶片各色素最大吸收波长的测定
对以上8种色素在400~800 nm波长下进行扫描,结果如表1所示。新黄质,花药黄质,紫黄质各有3个最大吸收波长,其中新黄质在438 nm,花药黄质在447 nm,紫黄质在441 nm的最大吸收波长对应的吸光度值最大,而玉米黄质、叶黄质、叶绿素a、叶绿素b、β-胡萝卜素的最大吸收波长只有一个,分别为 451、446.5、649、665、451 nm 作为其各自的吸收峰值。
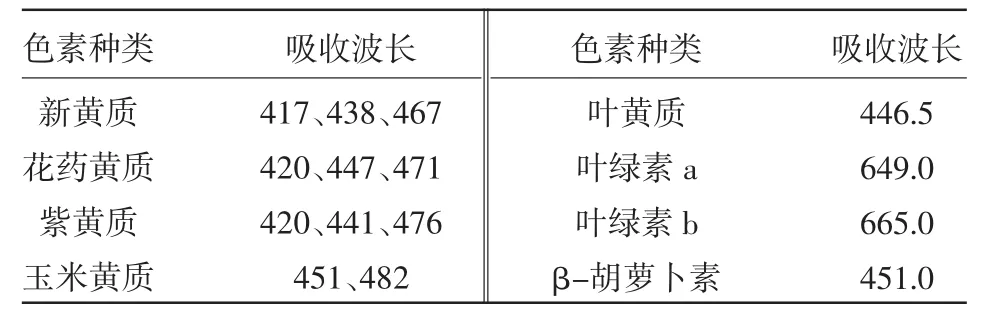
表1 小麦叶片8种色素在400~800 nm波长下的最大吸收波长
2.3 不同光照时间对小麦叶片各色素吸光度值的影响
2.3.1 不同光照时间对类胡萝卜素含量的影响图2所示,在25℃和15 000 lx光照强度下,小麦叶片叶绿体中类胡萝卜素的含量随光照时间的延长而降低,光照3.5 h前下降速率更大。这一结果说明,光照对小麦叶片叶绿体中类胡萝卜素稳定性的影响明显。

2.3.2 不同光照时间对各色素吸光度值的影响在15 000 lx光照强度下,每隔0.5 h测定光照对小麦叶片叶绿体中各色素的吸光度值的影响,结果发现吸光度值随时间延长普遍下降(图3),说明这8种色素的稳定性都受到光照的影响。其中下降速率最大是叶绿素a和β-胡萝卜素,说明这两种色素对于光照更加敏感。叶黄质、新黄质、花药黄质、玉米黄质、紫黄质的吸光度值下降速率较慢,可能与这些色素的浓度有关系。这8种色素在前2 h的吸光度值下降速率最快,说明小麦叶片叶绿体中各色素在光照条件下,前2 h的性质最活泼,因此在实际生产中要加强前2 h的避光处理。

2.4 不同温度对小麦叶片各色素吸光度值的影响
在0~60℃处理下,各色素吸光度值的变化结果(图4)表明,不同温度对于各色素的吸光度值影响较小,其中花药黄质与叶黄质的吸光度值变化曲线最小,玉米黄质,紫黄质和β-胡萝卜素的吸光度值在30℃附近有最大值。花药黄质的吸光度值变化趋势相对稳定。
2.5 不同浓度Vc对小麦叶片中类胡萝卜素含量的影响
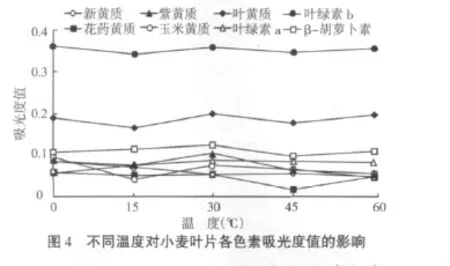
在光照条件下在色素提取液中加入Vc,类胡萝卜素的含量在不同浓度Vc处理下随光照时间延长呈下降趋势(图5),其中加入0.02%Vc时的类胡萝卜素含量一直比对照要高。结果说明,在光照条件下,添加0.02%Vc能够维持较高的类胡萝卜素含量,其他浓度的Vc维持效果不显著。

2.6 不同浓度的山梨酸钾对小麦叶片中类胡萝卜素含量的影响
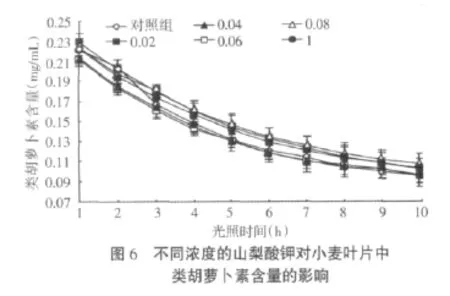
图6所示,小麦叶片中类胡萝卜素含量在不同浓度山梨酸钾处理下的变化趋势与图5相似。与对照相比,在光照条件下各个浓度的山梨酸钾对于类胡萝卜素含量维持效果不显著。
3 讨 论
3.1 薄层层析法分离小麦叶片中的色素
采用硅胶板的薄层层析方法分离小麦叶片色素,得到8个条带(图1),这与费美娟等[9]采用硅胶板分离提取菠菜中色素的结果是一致的。前人的研究确定最大上样量约300 μL,试验中发现最大上样量需要根据硅胶板的厚度和含水量来确定。利用试验中的层析系统分离胡萝卜和紫薯中的色素时,未出现明显的条带。同质量的胡萝卜或紫薯,与小麦叶片相比含水量大很多,因此可能会影响到展层剂对色素的推动作用。
3.2 不同光照时间和温度对小麦叶片色素吸光度值的影响
光照对小麦叶片叶绿体中的类胡萝卜素稳定性影响较为明显,并且影响强度随时间的延长逐渐减小,3.5 h以前下降速率更快(图2)。类胡萝卜素是反式的多烯结构,在光照条件下可能会发生顺反式的对调而成为顺式结构。构成类胡萝卜的色素种类很多,在光照条件下哪一种色素对光敏感还未见报道。该试验进一步研究了光照对于以上8种色素的影响,结果发现叶绿素a和β-胡萝卜素对光照最敏感,新黄质、紫黄质、花药黄质次之,玉米黄质不敏感(图3)。相对于光照,4~60℃处理对各色素吸光度值影响不大(图4),这与李平等[10]对玉米黄色素的温度影响结论是一致的。
3.3 不同食品添加剂对小麦叶片色素吸光度值的影响
在食品工业中,Vc和山梨酸钾是常用食品添加剂,它们在光照条件下是否对天然色素有所影响,少有报道[11]。该研究发现,在光照条件下0.02%Vc可以维持较高的类胡萝卜素含量,其他浓度的Vc和全部浓度的山梨酸钾效果不显著。Vc作为还原性物质在低浓度下可以缓解天然色素的光解,其机理还需要进一步研究。
综上所述,光照对于小麦叶片叶绿体中8种色素稳定性影响较大,而温度的影响较小,添加0.02%Vc可以维持较高的类胡萝卜素含量。这些结果为天然色素的研究,特别是天然色素食品的生产提供了参考。
[1]曾 桥,董文宾.功能性食用天然色素研究进展[J].中国调味品,2009,34(5):22-24.
[2]李浩明.万寿菊叶黄素及其生理功能研究概况[J].中国食品添加剂,2001,12(4):31-34.
[3]董高峰,陈贻竹.植物叶黄素循环与非辐射能量耗散[J].植物生理学通讯,1999,35(2):141-144.
[4]吴长艾,孟庆伟.叶黄素循环及其调控[J].植物生理学通讯,2001,37(1):1-5.
[5]Demming B,Winter K,Czyger F,et al.Photoinhibition and zeaxanthin formation in intact leaves[J].Plant Physiol.,1987,84:218-224.
[6]吕帮玉,杨新河,毛清黎.我国天然食用色素的开发现状与前景[J].江西农业学报,2007,19(10):108-110.
[7]白 杉.天然色素的提取及应用[J].杭州食品科技,2006,3(11):10-14.
[8]左 玉.天然色素研究与应用[J].粮食与油脂,2006,9(12):46-48.
[9]费美娟,赵世杰.叶黄素循环组分的分离鉴定及紫黄质的大量制备[J].西北植物学报,2004,2(42):210-214.
[10]李 平,张景会,张发亮.玉米皮中黄色素理化性质的研究[J].湖北农业科学,2007,46(1):127-129.
[11]郭凤华,王 慧.天然色素的提取和应用研究[J].发酵科技通讯,2007,36(4):36-38.

