氯沙坦对心力衰竭大鼠心肌细胞缝隙连接的作用机制研究
孙琪 戚国庆 石宇杰 张健 张艳苓
心力衰竭(心衰)是各种心脏病并发症之一,为老年人常见病,并常伴有各种心律失常。心衰时肾-血管紧张素系统(RAS)被激活,血管紧张素Ⅱ(AngⅡ)水平升高,加剧了水钠潴留和周围血管阻力,进一步导致心室扩张,最后引发心衰,因此阻断RAS系统,已成为心衰治疗的方向之一[1]。心室中心肌细胞连接通道主要由缝隙连接蛋白43(Cx43)构成,研究表明心衰发生时Cx43大量被降解并且会分布紊乱,导致Cx43蛋白重构,进而引起心律失常[2]。缝隙连接蛋白45(Cx45)主要表达在心房中,它能够调控Cx43通道发挥其在心衰中的作用[3]。氯沙坦为AngⅡ受体(AT1)抑制剂,本实验将观察氯沙坦对心衰大鼠心功能的影响,并进一步探讨其对心衰大鼠心肌细胞间连接的作用,为临床心衰的治疗提供依据。
1 材料与方法
1.1 实验动物 雄性SD大鼠60只,6~8周龄,体质量180~200 g,购于北京维通利华实验动物技术有限公司,合格证号:SCXK(京)2006-0009。随机分为假手术组、模型组及氯沙坦(默沙东制药有限公司)高、中、低组(16 mg/kg、8 mg/kg、4 mg/kg),每组12只。
1.2 造模方法 大鼠均采用灌胃给药,氯沙坦高、中、低组分别给予16 mg/kg、8 mg/kg、4 mg/kg的氯沙坦,连续 7 d。假手术组和模型组均给予等体积的蒸馏水,末次给药30 min后,复制心衰大鼠模型:大鼠乌拉坦麻醉,剪开左锁骨中线纵行切开皮肤约2 cm,在第3、4肋间钝性分离,打开胸腔,剪开心包,轻压右侧胸腔,挤出心脏,在肺动脉圆锥左缘、左心耳下缘1 mm处经浅层心肌以0-0线结扎左冠脉前降支,迅速将心脏放回胸腔,缝合。以检测的心功能指标异常为造模成功的标志。假手术组不结扎。
1.3 检测指标
1.3.1 检测心功能:大鼠造模后4 h,连接生理记录仪(成都泰盟BL-420F),经大鼠右侧颈总动脉插管,测定收缩压、舒张压、心率,将管进入左心室,测定左心室压峰值(LVP)、左心室舒张末期压(LVEDP)、左心室内压最大上升速率(+LVdp/dtmax)、左心室内压最大下降速率(-LVdp/dtmax)。
1.3.2 Cx43和Cx45蛋白的表达:Cx43和 Cx45蛋白采用Western Blot化学发光法检测。RIPA裂解法从大鼠心肌提取总蛋白,将蛋白样品进行12%的SDS-PAGE凝胶电泳,4℃恒压电转移至PVDF膜上,5%脱脂奶粉封闭1 h,后加入一抗(1∶200稀释的 Cx43、Cx45,1∶1 000 稀释的 GAPDH 内参),4℃ 孵育过夜,TBST洗膜,加入辣根过氧化物酶标记的二抗(稀释浓度1∶1 000),ECL暗室发光显色,凝胶成像系统照相扫描灰度值分析,以目的蛋白灰度值与GAPDH的灰度值比值用于统计分析。
1.4 统计学分析应用SPSS 11.5统计软件,计量资料以±s表示,多组间两两比较采用q检验,P<0.05为差异有统计学意义。
2 结果
2.1 大鼠存活 模型组、氯沙坦低、中、高组分别有3、2、1、1只大鼠死亡。余皆造模成功。
2.2 心功能变化 与假手术组比较,模型组大鼠心功能明显异常,LVP、+LVdp/dtmax明显下降,LVEDP明显上升(P<0.01);与模型组比较,氯沙坦组可显著改善心衰大鼠心功能,低、中、高剂组 LVP明显上升(P <0.01),LVEDP明显下降(P<0.05或<0.01),且高剂组+LVdp/dtmax也明显上升(P<0.01)。与低剂量组比较,高剂量组 LVP、LVEDP、+LVdp/dtmax差异有统计学意义(P<0.01);与中剂量组比较,高剂量组LVEDP、+LVdp/dtmax差异有统计学意义(P<0.05或<0.01)。5组-LVdp/dtmax变化差异无统计学意义(P>0.05)。5组血压、心率差异无统计学意义(P>0.05)。见表1。
表1 氯沙坦对心衰大鼠心功能的影响±s
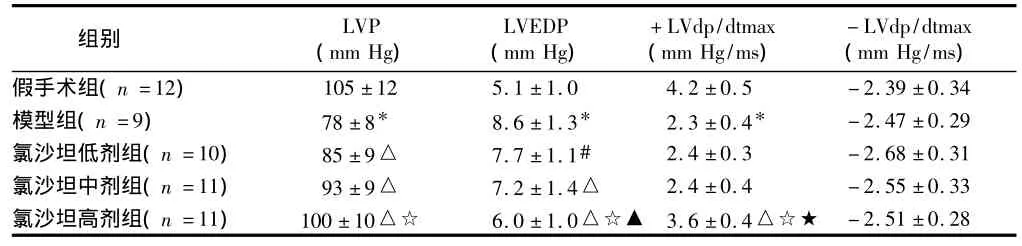
表1 氯沙坦对心衰大鼠心功能的影响±s
注:1 mm Hg=0.133 kPa;与假手术组比较,*P<0.01;与模型组比较,#P <0.05,△P <0.01;与氯沙坦低剂组比较,☆P<0.01;与氯沙坦中剂组比较,▲P<0.05,★P<0.01
组别 LVP(mm Hg)LVEDP(mm Hg)+LVdp/dtmax(mm Hg/ms)-LVdp/dtmax(mm Hg/ms)105±12 5.1±1.0 4.2±0.5 -2.39±0.34模型组(n=9) 78±8* 8.6±1.3* 2.3±0.4* -2.47±0.29氯沙坦低剂组(n=10) 85±9△ 7.7±1.1# 2.4±0.3 -2.68±0.31氯沙坦中剂组(n=11) 93±9△ 7.2±1.4△ 2.4±0.4 -2.55±0.33氯沙坦高剂组(n=11) 100±10△☆ 6.0±1.0△☆▲ 3.6±0.4△☆★假手术组(n=12)-2.51±0.28
2.3 缝隙连接蛋白43、45表达 与假手术组比较,模型组Cx43蛋白表达明显降低(P<0.01),Cx45蛋白表达明显升高(P<0.01);与模型组比较,氯沙坦能显著提高Cx43表达,降低Cx45表达,其中,中、高剂量组差异有统计学意义(P<0.05或<0.01)。与低剂量组比较,中、高剂量组Cx43、Cx45差异均有统计学意义(P<0.01),与中剂量组比较,高剂量组Cx45有统计学意义(P <0.01)。见表2,图1。
表2 氯沙坦对心衰大鼠心肌组织Cx43、Cx45表达的影响n=3,±s
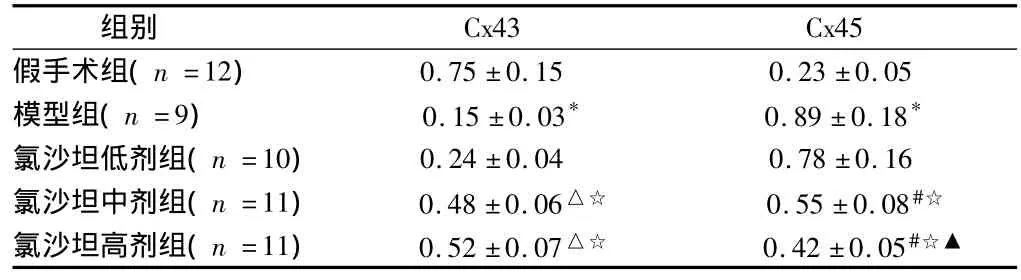
表2 氯沙坦对心衰大鼠心肌组织Cx43、Cx45表达的影响n=3,±s
注:与假手术组比较,*P <0.01;与模型组比较,#P <0.05,△P <0.01;与氯沙坦低剂组比较,☆P<0.01;与氯沙坦中剂组比较,▲P<0.01
Cx43 Cx45假手术组(n=12)组别0.75±0.15 0.23±0.05模型组(n=9) 0.15±0.03* 0.89±0.18*氯沙坦低剂组(n=10) 0.24±0.04 0.78±0.16氯沙坦中剂组(n=11) 0.48±0.06△☆ 0.55±0.08#☆氯沙坦高剂组(n=11) 0.52±0.07△☆ 0.42±0.05#☆▲
3 讨论
RAS由肾素、血管紧张素原、血管紧张素转化酶、血管紧张素及其受体组成,研究发现,心衰普遍存在有RAS系统的激活,引起的血管紧张素及其受体升高,能够增加心脏前后负荷,进一步发展为心室扩张,并且有文献报道血管紧张素受体升高的幅度与心衰损伤程度呈正相关,因此抑制血管紧张素受体表达能够保护心脏[4,5]。氯沙坦为血管紧张素Ⅱ受体阻断剂,它能特异性抑制血管AngⅡ和受体AT1R进行结合,进而抑制AngⅡ与AT1R结合所引起的外周血管收缩、交感神经兴奋和压力感受器敏感性增加等作用[6]。本结果表明氯沙坦能够明显升高LVP、+LVdp/dtmax,降低LVEDP,改善心功能,提示氯沙坦对心功能有明显的改善作用。
Cx43在哺乳类动物心室肌细胞中发挥作用,其表达水平下降和分布紊乱表明心肌细胞间连接被破坏而且功能紊乱,导致了心肌组织传导速度减慢,又因传导的方向发生了改变,形成传导阻滞和折返传导,最后发生了心律失常,因此Cx43的表达下降和分布紊乱是心衰后在分子水平上发生的心肌细胞最初重构,也是心肌细胞心律失常的基础[7,8]。本实验观察到心衰的大鼠,Cx43表达明显下降,与文献报道一致[9]。提示了Cx43在心衰大鼠中具有重要意义。Cx45主要存在于心房中,近来的研究发现Cx45可能在缺血性心脏病[10]、心衰中起着调控Cx43通道的作用。Betsuyaku等[11]报道了在人心衰发生时,Cx43表达水平降低,Cx45表达水平增加,本实验也得到了相似的结果,即心衰大鼠心肌组织中Cx43表达降低,Cx45表达增加。
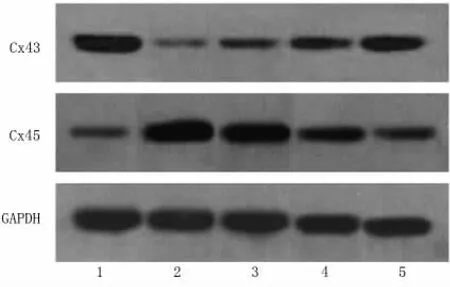
图1 氯沙坦对心衰大鼠心肌组织Cx43、Cx45蛋白表达的影响(western-blot)
实验结果表明,氯沙坦能够显著升高心衰后大鼠Cx43的表达,降低Cx45的表达,减轻心肌病理损伤,显著改善心功能,尤以氯沙坦中高剂量组作用显著。说明氯沙坦对心衰大鼠心功能的改善作用可能与增加Cx43的表达、降低Cx45的表达相关,同时,Cx43的表达增加也提示氯沙坦对心室的间隙连接通道有保护作用,可以提高心室传导速度,从而降低心律失常的发生。
1 Becari C,Oliveira EB,Salgado MC.Alternative pathways for angiotensin II generation in the cardiovascular system.Braz J Med Biol Res,2011,44:914-919.
2 Peters NS.New insights into myocardial arrhythmogenesis:distribution of gap-junctional coupling in normal,ischaemic and hypertrophied human hearts.Clin Sci(Lond),1996,90:447-452.
3 Yamada KA,Rogers JG,Sundset R,et al.Up-regulation of connexin45 in heart failure.J Cardiovasc Electrophysiol,2003,14:1205-1212.
4 Parlakpinar H,Ozer MK,Acet A.Effects of captopril and angiotensin II receptor blockers(AT1,AT2)on myocardial ischemia-reperfusion induced infarct size.Cytokine,2011,56:688-694.
5 Reinker KA,Stevenson DA,Tsung A.Orthopaedic conditions in Ras/MAPK related disorders.J Pediatr Orthop,2011,31:599-605.
6 陈爱兰,陈敏生,何兆初,等.氯沙坦和氢氯噻嗪逆转高血压患者左心室肥厚的机制及疗效观察.河北医药,2011,33:1765-1767.
7 Saffitz JE.Regulation of intercellular coupling in acute and chronic heart disease.Braz J Med Biol Res,2000,33:407-413.
8 Solan JL,Lampe PD.Connexin43 phosphorylation:structural changes and biological effects.Biochem J,2009,419:261-272.
9 杨军,全智华,谭小进.心力衰竭大鼠心脏缝隙连接蛋白43的变化及厄贝沙坦的干预作用.中国动脉硬化杂志,2007,15:683-686.
10 Dupont E,Matsushita T,Kaba RA,et al.Altered connexin expression in human congestive heart failure.J Mol Cell Cardiol,2001,33:359-371.
11 Betsuyaku T,Nnebe NS,Sundset R,et al.Overexpression of cardiac connexin 45 increases susceptibility to ventricular tachyarrhythmias in vivo.Am J Physiol Heart Circ Physiol,2006,290:H163-171.

