急性脑梗死患者颈动脉斑块及相关危险因素分析
冯文霞 宋福聪 吕洲 李霞 刘青蕊 尤素伟
脑梗死已成为中老年人致残或致死的主要疾病之一。动脉粥样硬化是脑梗死的重要病因。动脉斑块的破裂导致暴露脂质核心,激活凝血系统,血栓形成,栓子脱落导致动脉-动脉栓塞。hs-CRP是一种敏感的炎性标志物。本研究对ACI患者行颈动脉超声检查,同时测定血清hs-CRP及其他生化指标,探讨合并颈动脉斑块ACI患者血清hs-CRP水平及其与相关危险因素的关系。
1 资料与方法
1.1 一般资料 急性脑梗死患者76例,为邯郸市中心医院神经内科2010年1月至2011年6月住院患者,其中男52例,女24例;年龄36~70岁,平均年龄58.50岁;诊断标准符合1995年全国第四届脑血管病会议修订的脑梗死诊断标准[1],并经头颅CT或MRI检查证实。所有病例病程2 h~2 d,平均22 h。排除半年内患急性心肌梗塞及其他血管闭塞性疾病,半年内有感染、免疫、肿瘤、严重心肝肾疾患及生命体征不稳定者。根据超声检查结果将患者分为斑块组46例和无斑块组30例。选取同期在我院体检科健康体检者22例作为对照组,男14例,女8例;年龄48~65岁,平均年龄55.55岁,入选者无缺血性卒中史及上述病史,经颈动脉超声检查未发现有斑块。3组在年龄、性别比、体重指数(BMI)、高血压病史、糖尿病史、吸烟史、饮酒史比较无明显差异(P>0.05)。
1.2 方法
1.2.1 颈动脉超声检查:采用美国GEViVid7全数字彩色多普勒超声仪,探头频率为10 Hz。由超声科专业医师操作。受检者取平卧头仰位。采用标准横切面、纵切面及连续扫查方法,扫描部位包括颈总动脉(CCA)、颈动脉分叉处(BIF)、椎动脉(VA)及距颈内动脉(ICA)起始处。斑块诊断标准为局限性IMT≥1.5 mm。
1.2.2 实验室检查:ACI病例均于入院后次日清晨(发病72 h之内)抽取空腹肘静脉血送检。hs-CRP、FPG、TG、TC、HDL、LDL均采用日本奥林巴斯AU2700全自动生化分析仪及其配套试剂测定,hs-CRP采用免疫散射比浊法测定;GHb由日本TOSHO公司的HLC-723G7型全自动糖化血红蛋白分析仪测定,采用高压液相离子交换层析法,;Fbg由北京赛科希德SF-8000全自动凝血分析仪测定,采用凝血酶法。22例对照者采晨空腹肘静脉血检测hs-CRP。
1.3 统计学分析应用SPSS 13.0统计软件,计量资料以±s表示,多组比较采用方差分析,需要两两比较采用LSD检验,计数资料采用χ2检验,各指标间的相关性分析采用Pearson相关分析,P<0.05为差异有统计学意义。
2 结果
2.1 3组血清hs-CRP水平比较 斑块组患者血清hs-CRP水平升高,高于无斑块组和对照组(P<0.05),无斑块组与对照组比较差异无统计学意义(P>0.05)。见表1。
表1 3组血清中hs-CRP水平mg/L,±s

表1 3组血清中hs-CRP水平mg/L,±s
注:与斑块组比较,*P <0.05
hs-CRP斑块组(n=39)组别3.72 ±3.52无斑块组(n=23) 2.00 ±1.92*对照组(n=20) 1.19 ±0.86*
2.2 斑块组及无斑块组相关指标变化 斑块组与无斑块组比较 LDL、GHb、UA 比较均有明显差异(P <0.05),2组间 FPG、TG、CHO、HDL、Fbg比较无差异(P >0.05)。见表2。
表2 各项生化指标在组间的比较±s
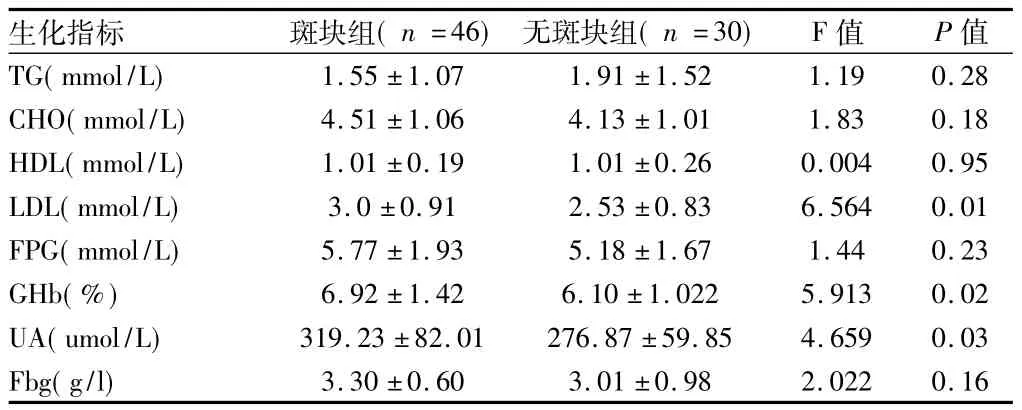
表2 各项生化指标在组间的比较±s
生化指标 斑块组(n=46) 无斑块组(n=30) F值 P值TG(mmol/L)1.55 ±1.07 1.91 ±1.52 1.19 0.28 CHO(mmol/L) 4.51 ±1.06 4.13 ±1.01 1.83 0.18 HDL(mmol/L) 1.01 ±0.19 1.01 ±0.26 0.004 0.95 LDL(mmol/L) 3.0 ±0.91 2.53 ±0.83 6.564 0.01 FPG(mmol/L) 5.77 ±1.93 5.18 ±1.67 1.44 0.23 GHb(%) 6.92 ±1.42 6.10 ±1.022 5.913 0.02 UA(umol/L) 319.23 ±82.01 276.87 ±59.85 4.659 0.03 Fbg(g/l)3.30 ±0.60 3.01 ±0.98 2.022 0.16
2.3 血清hs-CRP水平的Pearson相关危险因素分析 血清hs-CRP水平分别与 CHO、LDL、GHb、UA、Fbg呈正相关(P <0.05),与年龄、BMI、TG、HDL、FPG 无相关性(P >0.05)。见表3。
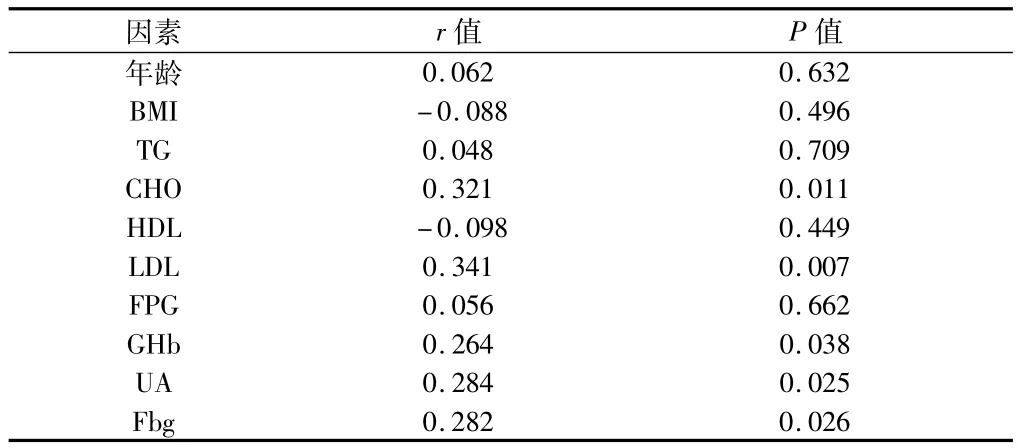
表3 ACI患者血清hs-CRP水平Pearson相关分析结果
3 讨论
动脉粥样硬化是缺血性卒中的主要病理基础,动脉内-中膜增厚是动脉粥样硬化的早期指征,斑块形成是其典型特征。颈动脉是全身动脉系统的一部分,其动脉粥样硬化程度可反应全身动脉病变情况。颈动脉斑块多发生在颈动脉起始部和颈内、外动脉分叉处。1999年Ross教授[2]提出“动脉粥样硬化是一种炎症性疾病”,内皮细胞的局限性损伤是形成动脉粥样硬化过程的开端。炎症参与动脉粥样硬化形成的每个时期,自发生到发展,以至最终动脉粥样硬化斑块破裂及血栓的形成。
CRP是一种典型的急性时相反应蛋白。正常健康人血清中含量极微,临床上将采用敏感的免疫学方法测得较低浓度的CRP称为hs-CRP。本研究发现,斑块组患者血清hs-CRP水平升高,高于无斑块组和对照组(P<0.05),无斑块组与对照组比较无差异(P>0.05),提示血清hs-CRP与颈动脉斑块形成具有相关性。与相关报道一致,hs-CRP是动脉粥样硬化血栓形成的介导和标志物,参与了动脉粥样硬化形成的病理生理学的全过程[3]。
动脉粥样硬化是多种因素共同作用的结果。危险因素包括高血压病、糖尿病、血脂异常、纤维蛋白原、尿酸、吸烟、饮酒、BMI、年龄、性别、种族等。本研究发现,斑块组LDL、GHb、UA较无斑块组升高,两组比较有明显差异(P<0.05),且hs-CRP与其呈正相关。LDL是血液循环中运载胆固醇的主要脂蛋白。LDL通过受损的血管内皮细胞间隙进入到内膜下,在氧自由基等作用下,经氧化修饰成氧化低密度脂蛋白后容易进入血管内膜形成粥样硬化斑块[4]。CRP可与脂蛋白结合,激活补体系统,产生大量炎症介质,释放氧自由基,造成血管内膜损伤[5]。GHb被认为是评价血糖控制情况的“金标准”,高血糖损伤血管内皮细胞,促进凝血、血小板聚集、炎性细胞侵润、血管平滑肌细胞增殖[6]。血尿酸水平升高可促进LDL的氧化和脂质的过氧化并伴有氧自由基生成增加,直接促进动脉粥样硬化形成及发展[7]。2组患者Fbg比较无明显差异(P >0.05),但 hs-CRP与其成正相关,Fbg作为一个重要的凝血因子和炎症因子,在动脉粥样硬化形成与发展的炎症机制中,起了非常重要的作用[8]。动脉粥样硬化的发生、发展是一种炎性过程。及早控制上述危险因素,能延缓动脉粥样硬化的进程。
颈动脉超声是可重复的无创性检查方法,是目前临床应用最方便、最多的血管检查手段。血清hs-CRP可作为颈动脉粥样硬化的重要预测指标之一。对临床上颈动脉超声检查发现斑块的患者,及早进行干预治疗,从而减少缺血性脑卒中的发生,具有积极的临床意义。
1 脑卒中患者临床神经功能缺损程度评分标准(1995).中华神经科杂志,1996,29:381-383.
2 Ross R.Atherosclerosis-An Inflammatory Disease.New England Journal of Medicine,1999,340:115.
3 王和德,赵建华,焦守风,等.老年急性脑梗死患者血C反应蛋白与颈动脉粥样硬化的关系.山东医药,2010,50:88-89.
4 唐海滨,贾豫黔,胡曼云,等.老年高血压患者颈动脉粥样硬化病变及相关因素.高血压杂志,2005,13:776-778.
5 王秀艳,袁建新,王轶瑾,等.血清超敏C反应蛋白与急性脑梗死的相关性研究.临床神经病学杂志,2006,19:210-212.
6 Pickup JC.Inflammation and activated innate immunity in the pathogenesis of type 2 diabetes.Diabetes Care,2004,27:813.
7 罗明,俞文萍,邓兵.老年女性高血压患者颈动脉硬化与血尿酸水平关系探讨.中华老年医学杂志,2005,24:106-108.
8 Sabeti S,Exner M,Mlekusch W,et al.Prognostic impact of fibrinogen in carotid atherosclerosis:nonspecific indicator of inflammation or independent predictor of disease progression.Stroke,2005,36:1400-1404.

