PCNA在胆管癌中的表达及意义
张桂东 宋春丽 周少英 武来兴 尹清臣
近些年来胆管癌的发病率逐渐升高,虽然医学影像学和临床其他检测方法的有所提高,但是由于胆道系统的解剖和生理学特点,早期诊断和早期治疗均较困难,导致许多患者就诊时已是晚期,失去了手术机会,且胆管癌的恶性程度较高、预后差,给普通外科医生提出了严峻的挑战。增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)是DNA聚合酶δ的辅助因子,在DNA复制、细胞增殖及细胞周期调控中发挥重要作用。但是有关PCNA在胆管癌中的研究甚少。本实验应用免疫组化法,RT-PCR方法来检测PCNA在胆管癌组织中的表达,探讨它们与胆管癌临床病理因素之间的关系。旨在为判断胆管癌的恶性程度和生物学行为提供客观指标。
1 资料与方法
1.1 一般资料 42例原发性胆管癌、17例相同个体癌旁胆管组织及20例正常胆管组织来自邯郸市中心医院2005年12月至2010年12月手术切除标本。所有胆管癌患者术前未经任何治疗。所有标本为术中立刻获取的新鲜胆管癌组织、相同个体癌旁(距瘤缘0.5 cm)胆管组织及正常胆管组织,保存于液氮中,用于RT-PCR实验。术后胆管癌标本立刻固定在10%中性甲醛溶液,包埋在石蜡里,用于免疫组化研究。为避免误差,由两位有经验病理医师进行病理组织学诊断。42例胆管癌患者中男23例,女19例;年龄40~76岁,平均年龄60岁;高和中分化胆管癌27例,低分化胆管癌15例;肝门部25例,中下段17例;其中有14例发生了淋巴转移。
1.2 主要试剂 鼠抗人PCNA单克隆抗体(北京中杉公司);FITC标记的山羊抗兔IgG(Jackson Immunoresearch Laboratiries Inclot58630);Trizol试剂(美国 Gibco BRL公司);RT试剂盒(美国Promega公司);PCR酶混合物(赛百盛生物工程公司);dNTP(赛百盛生物工程公司);GAPDH引物(上海生工生物工程公司);PCNA引物(上海生工生物工程公司);100 bp DNA marker(赛百盛生物工程公司)。
1.3 检测方法
1.3.1 采用免疫组化SP法,对标本中的PCNA蛋白进行检测,按试剂盒说明严格进行操作;结果判定免疫组化根据染色反应的深度及阳性细胞的数量分别记分为0~3分,其中染色深度以多数细胞的呈色反应为准。不着色为0分,浅黄色为1分,棕黄色为2分,棕褐色为3分。阳性细胞数<10%为0分,10% ~45%为1分,46% ~70%为2分,>70%为3分,并根据这两项指标的积分数分为阴性结果和阳性结果,即阴性(-)为0~1分,阳性(+)为2~9分。
1.3.2 采用RT-PCR法,对标本中的PCNA mRNA进行检测,亦按试剂盒说明严格进行操作。
1.4 统计学分析应用SAS 6.12统计软件,计量资料以±s表示,不同组别实验数据比较采用方差分析(ANOVA),进一步两两比较采用t检验(LSD法),计数资料采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 免疫组化检测结果 胆管癌组织、正常胆管组织中PCNA表达的阳性率分别为71.19%(30/42)和25.00%(5/20),差异有统计学意义(χ2=17.205,P=0.001)。胆管癌组织的阳性率亦明显高于正常组织;胆管癌组织中PCNA蛋白的表达与年龄、性别、肿瘤所处位置,组织学分化及其淋巴转移的比较见表1。
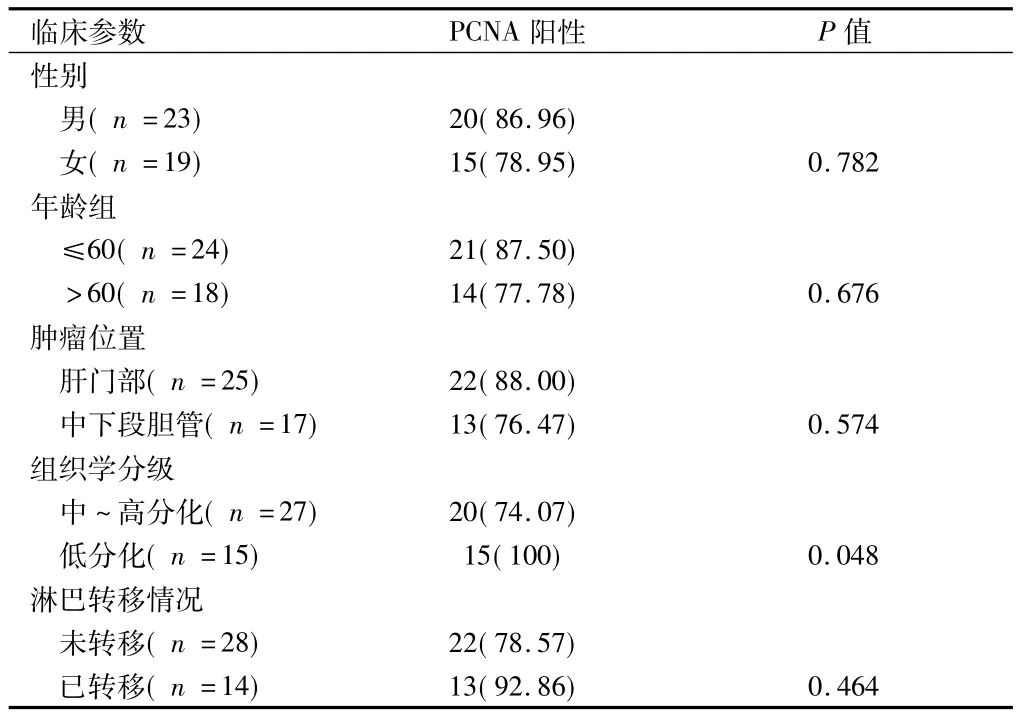
表1 PCNA蛋白在胆管癌组织中的表达与临床参数的关系(免疫组化) 例(%)
2.2 RT-PCR检测结果 胆管癌组织的PCNA mRNA表达高于正常组织有统计学意义(F=10.84,P=0.0001)。见表2。
表2 PCNA mRNA在胆管癌组织、癌旁组织及正常胆管组织中的表达(RT-PCR)±s

表2 PCNA mRNA在胆管癌组织、癌旁组织及正常胆管组织中的表达(RT-PCR)±s
注:与胆管癌组比较,*P <0.05
组别PCNA OD值正常胆管组(n=20) 0.5605 ±0.0331*胆管癌旁组(n=17) 0.5692 ±0.0408*胆管癌组(n=42)0.6303 ±0.0773
2.3 胆管癌组织中PCNA mRNA的表达与临床参数的关系见表3。
3 讨论
胆管癌系指发生在胆道系统的恶性肿瘤。胆管癌患者早期一般无明显临床表现,目前尚未发现胆道恶性肿瘤的特异性的标志物,因而胆道系统恶性肿瘤的诊断仍主要靠传统的影像学技术,如B型超声,内镜逆行性胆胰管造影(ERCP)、CT、磁共振胆胰管成像(MRCP)核素显影扫描和血管造影等。同时胆管癌的治疗仍以手术切除为主,放疗和化疗的疗效尚需进一步探索。而基因诊断和基因治疗可能成为今后的发展方向或成为攻克胆管癌的最终途径。
表3 PCNA mRNA在胆管癌组织中的表达与临床参数的关系(RT-PCR)±s
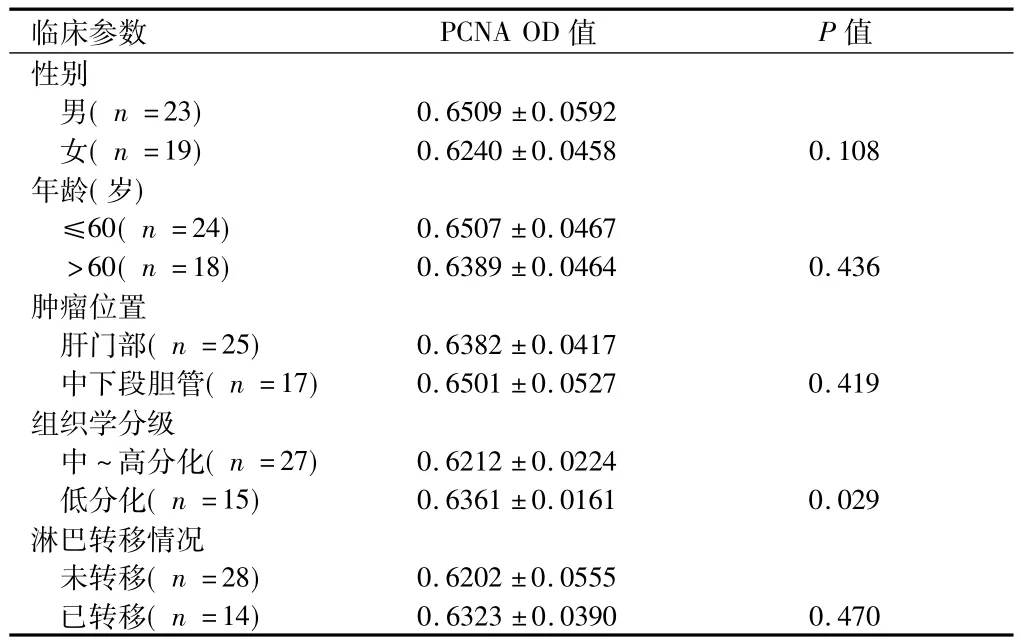
表3 PCNA mRNA在胆管癌组织中的表达与临床参数的关系(RT-PCR)±s
临床参数 PCNA OD值 P值性别男(n=23) 0.6509 ±0.0592女(n=19) 0.6240 ±0.0458 0.108年龄(岁)≤60(n=24) 0.6507 ±0.0467>60(n=18) 0.6389 ±0.0464 0.436肿瘤位置肝门部(n=25) 0.6382 ±0.0417中下段胆管(n=17) 0.6501 ±0.0527 0.419组织学分级中 ~高分化(n=27) 0.6212 ±0.0224低分化(n=15) 0.6361 ±0.0161 0.029淋巴转移情况未转移(n=28) 0.6202 ±0.0555已转移(n=14)0.6323 ±0.0390 0.470
胆管癌的病因和发病机理同其他器官的恶性肿瘤一样目前仍尚未完全明了。多数学者认为其可能与结石形成、胆汁淤积及胆道感染有关[1]。目前遗传学的研究已经发现,与其他恶性肿瘤一样,胆管癌的发生发展与染色体癌基因及抑癌基因的改变有关,认为k-ras、c-myc、c-met等的过度表达及其抑癌基因p53、p16、DPC4等的突变缺失与胆管癌的发生发展密切相关,但各种癌基因和抑癌基因在胆管癌的发生发展过程中的相互作用及其协调关系尚不清楚[2]。因此进一步从分子生物学的角度研究胆管癌的发病机制,可望为胆管癌的基因诊断和治疗提供理论依据。
PCNA基因位于20号染色体上,含6个外显子,5个内含子,长约710 kb,编码36 KD的PCNA蛋白。PCNA蛋白亦为一种细胞周期蛋白,是一种细胞增殖标志物,是DNA多聚酶δ的辅酶,它协调DNA前导链和随从链的合成,是DNA复制过程所必需[3],其在细胞内的含量具有周期性,在静止期细胞内含量很少,G1晚期开始增加,S期达高峰,G2期、M期明显下降[4],正常情况下,p21蛋白与 PCNA结合形成复合物,抑制PCNA的功能,在多种基因或细胞因子的调控下,PCNA含量超过p21蛋白的结合能力时,即可与相应的DNA复制位点结合,辅助DNA聚合酶δ进行DNA复制,从而使细胞进入S期[5]。PCNA是一种酸性、无组蛋白的细胞核多肽,其阳性细胞多分布于癌巢周边和浸润前缘,在癌巢中央尤其是明显角化的细胞中表达极低。近些年来,国际上对PCNA的的研究一直比较热[6,7],国内张元等[8]的研究结果,表明 PCNA 能较好地反映胰腺癌的恶性程度和增殖活性,提示它可作为反映胰腺癌预后的一个可靠参数,罗庆元等[9]的研究结果,亦表明PCNA能较好地反映食管癌的增殖活性,提示它也可作为反映食管癌预后的一个较好参数。
本实验从蛋白和基因两个水平上来研究PCNA在不同胆管病变中的表达,从而探讨PCNA表达异常与胆管癌发生和发展之间的关系。本实验中利用免疫组化方法和RT-PCR法检测了42例胆管癌组织和20例正常胆管组织中PCNA的表达情况。42例胆管癌患者中男23例,女19例;年龄40~76岁,平均年龄60岁;高和中分化胆管癌27例,低分化胆管癌15例;肝门及肝内胆管癌25例,中下段17例。其中有14例发生了淋巴转移。从试验结果可以得出,蛋白和基因两个水平上的PCNA在不同胆管病变中的表达具有一致性,即在胆管癌中的表达明显高于正常的胆管组织差异有统计学意义(P<0.05)。进一步研究表明,PCNA的表达随着肿瘤的恶性程度的升高(即肿瘤的病理学分化程度的降低)而升高,更进一步说明了PCNA是一个有价值的肿瘤标志。
1 黄洁夫主编.肝脏胆道肿瘤外科学.第1版.北京:人民卫生出版社,1999.710-711.
2 邹声泉,龚建平主编.外科学——前沿与争论.第1版.北京:人民卫生出版社,2003.604-605.
3 Waga S.The p21 inhibitor of cyclin-dependent kinases controls DNA replication by interaction with PCNA.Nature,1994,369:574-578.
4 Zhu SC,Li R.Impact of simultaneous assay.the PCNA,cyclinD1,and DNA content with specimens before and after preoperative radiotherapy on prognosis of esophageal cancer-possible incorporation into clinical TNM stag system.World JGastroenterol,2005,11:3823.
5 Moldovan GL,Pfander B,Jentsch S.PCNA,themaestro of the replication fork.Cell,2007,129:665-679.
6 Fan J,OtterleiM,Wong HK,etal.XRCC1 co-localizes and physically interacts with PCNA.Nucleic Acids Res,2004,32:2193-2201.
7 Bravo R,Frank R,Blundel P,et al.Cyclin/PCNA is the auxiliary protein of DNA polymerase-delta.Nature,1987,326:515-517.
8 张元,钱家勤.胰腺癌组织中增殖细胞核抗原的表达及临床意义.肝胆外科杂志,2000,8:434-436.
9 罗庆元,蒋莹.食管鳞癌组织中c-fos和PCNA的表达及临床病理意义.新疆医科大学学报,2010,33:30-35.

