黄芩解毒颗粒提取工艺研究
王洛临,施之琪,李智勇,陈玉兴
(广东省中医研究所广东 广州 510095)
黄芩解毒颗粒提取工艺研究
王洛临,施之琪,李智勇,陈玉兴
(广东省中医研究所广东 广州 510095)
目的优选黄芩解毒颗粒的提取工艺。方法以解热、抗炎药效为指标,对本处方的提取工艺路线进行初步筛选,根据药效筛选结果,采用正交试验设计,以挥发油得量为指标,对加水量、浸泡时间和蒸馏时间进行优选;以干浸膏得量和黄芩苷含有量的综合评分值为指标,对加水量、提取时间和提取次数进行优选。结果提取工艺路线采用双提法最好,挥发油提取最佳工艺为加12倍水,提取6 h;水提取最佳工艺为提取3次,每次加8倍水,提取1 h。结论选择的提取工艺路线有效,优选的提取工艺稳定可行。
黄芩解毒颗粒;抗炎;解热;提取工艺;挥发油;黄芩苷;正交试验
黄芩解毒颗粒由黄芩、鱼腥草、虎杖、辛夷等药材组成,具有清热解毒、清肺解表的功效,临床用于治疗由病毒感染等引起的疾病。为确定合理的提取工艺,保证制剂质量和疗效,以解热、抗炎药效为指标,对提取工艺路线进行初步筛选,根据筛选结果,确定提取工艺路线。提取工艺以鱼腥草、辛夷挥发油得量,君药黄芩中黄芩苷含有量和水提干浸膏得量为评价指标,采用正交试验设计法,确定本品的挥发油提取工艺和水提取的工艺条件。
1 实验仪器、动物与试药
1.1 仪器Agilent1100高效液相色谱仪、二极管阵列检测器、二元泵;Bp211D电子分析天平(德国);RE-52AA旋转蒸发器(上海);MYB型调温电热套(浙江);ZK-82A真空干燥箱(上海)。
1.2 动物SPF级NIH小鼠和SPF级SD大鼠(体质量为180~220 g)均由广东省实验动物中心购得。
1.3 试药黄芩苷对照品(批号:111595-200604)购于中国药品生物制品检定所;银翘解毒片(规格:0.52 g,佛山徳众药业有限公司,批号:11001);去痛片(规格:365 mg,湖北华中药业有限公司,批号:20101159);黄芩解毒颗粒所用药材均由广东养和医药有限公司购得,经笔者鉴定均符合2010年版《中国药典》一部各项下有关规定;所用化学试剂均为色谱纯。
2 方法与结果
2.1 提取工艺路线的确定据文献[1-7]报道,处方中药材含有挥发油、黄酮、皂苷、生物碱和多糖等成分,根据各类成分的理化性质,按下列拟定的提取工艺方案制备供试品样品,并分别进行抗炎、解热药效学比较,确定本品的提取工艺路线。
2.1.1 方案1按处方比例称取处方各药材,分别加入药材量10倍水提取1次,每次2 h,滤过,提取液合并,浓缩成1 g浸膏含1.02 g药材的浸膏,作为样品1,备用。
2.1.2 方案2按处方比例,取鱼腥草、辛夷药材,照《中国药典》2010年版一部附录XD挥发油提取法,加入药材量10倍水提取挥发油,挥发油与药液另存,药渣加入其余处方量药材,分别加入药材量10倍量60%乙醇提取回流2次,每次2 h,滤过,提取液合并,加入提取挥发油后的药液,浓缩成1 g浸膏含0.97 g药材的浸膏,加入挥发油,作为样品2,备用。
2.1.3 方案3按处方比例,取鱼腥草、辛夷药材,照方案2挥发油提取方法提取挥发油,挥发油与药液另存,药渣加入其余药材,分别加10倍水提取2次,每次2 h,提取液合并,加入提取挥发油后的药液,浓缩成1 g浸膏含1.07 g药材的浸膏,加入挥发油,作为样品3,备用。
2.1.4 方案4按处方比例,取处方药材照方案3方法提取、浓缩成1 g浸膏约相当于1 g药材的浸膏,加入95%乙醇至药液含乙醇量为60%,静置24 h,滤过,上清液回收乙醇并浓缩成1 g浸膏含1.21 g药材的浸膏,加入挥发油,作为样品4,备用。
2.1.5 对二甲苯所致小鼠耳肿胀的影响[8]取SPF级NIH小鼠100只,随机分为对照组、银翘解毒片和各提取工艺样品高、中剂量组,每组10只,各给药组按剂量灌胃给药,对照组给予等体积蒸馏水,每天1次,共7 d,末次给药后1 h,每鼠右耳前后两面涂二甲苯0.04 mL,2 h后处死动物,剪取对称左右耳片,用8 mm打孔器沿左右耳郭相同部位打孔,分别迅速称质量,以两耳质量差为肿胀度指标,并以各组肿胀度的均值计算肿胀抑制率。结果见表1。

结果显示,各工艺样品对小鼠耳廓肿胀抑制率比较,以样品3最好。
2.1.6 对内毒素所致大鼠高热的影响[8]取SPF级SD大鼠若干,于室温(20±2)℃的实验室内饲养3 d后,每日测肛温2次,选一日内体温变化不超过0.4℃的大鼠120只,雌雄各半,随机分为正常对照组、模型对照组、银翘解毒片组、去痛片组和各提取工艺样品高、中剂量组,每组10只。各给药组按剂量灌胃给药,给药体积为10 mL/Kg,每天1次,连续5 d,对照组、模型对照组同法给予等体积的蒸馏水。末次给药前各组动物禁食不禁水24 h,末次给药30 min后,对照组腹腔注射生理盐水5 mL/Kg,其余各组大鼠均腹腔注射内毒素150 μg/Kg,注射容积5 mL/Kg,于致热攻击后1、2、4 h各测体温1次。结果见表2。
表1 不同工艺样品对抑制小鼠耳肿胀度的作用(±s,n=10)
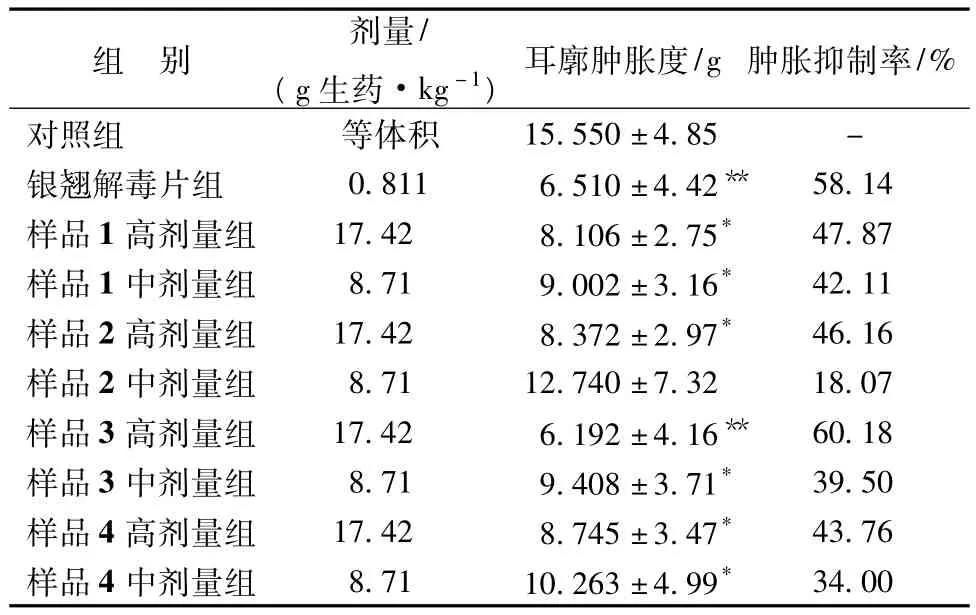
表1 不同工艺样品对抑制小鼠耳肿胀度的作用(±s,n=10)
注:与对照组比较,*P<0.05,**P<0.01。
组别剂量/(g生药·kg-1)耳廓肿胀度/g肿胀抑制率/%对照组等体积15.550±4.85-银翘解毒片组0.8116.510±4.42**58.14样品1高剂量组17.428.106±2.75*47.87样品1中剂量组8.719.002±3.16*42.11样品2高剂量组17.428.372±2.97*46.16样品2中剂量组8.7112.740±7.3218.07样品3高剂量组17.426.192±4.16**60.18样品3中剂量组8.719.408±3.71*39.50样品4高剂量组17.428.745±3.47*43.76样品4中剂量组8.7110.263±4.99*34.00
表2 不同工艺样品对内毒素所致大鼠高热的影响(±s,n=10)
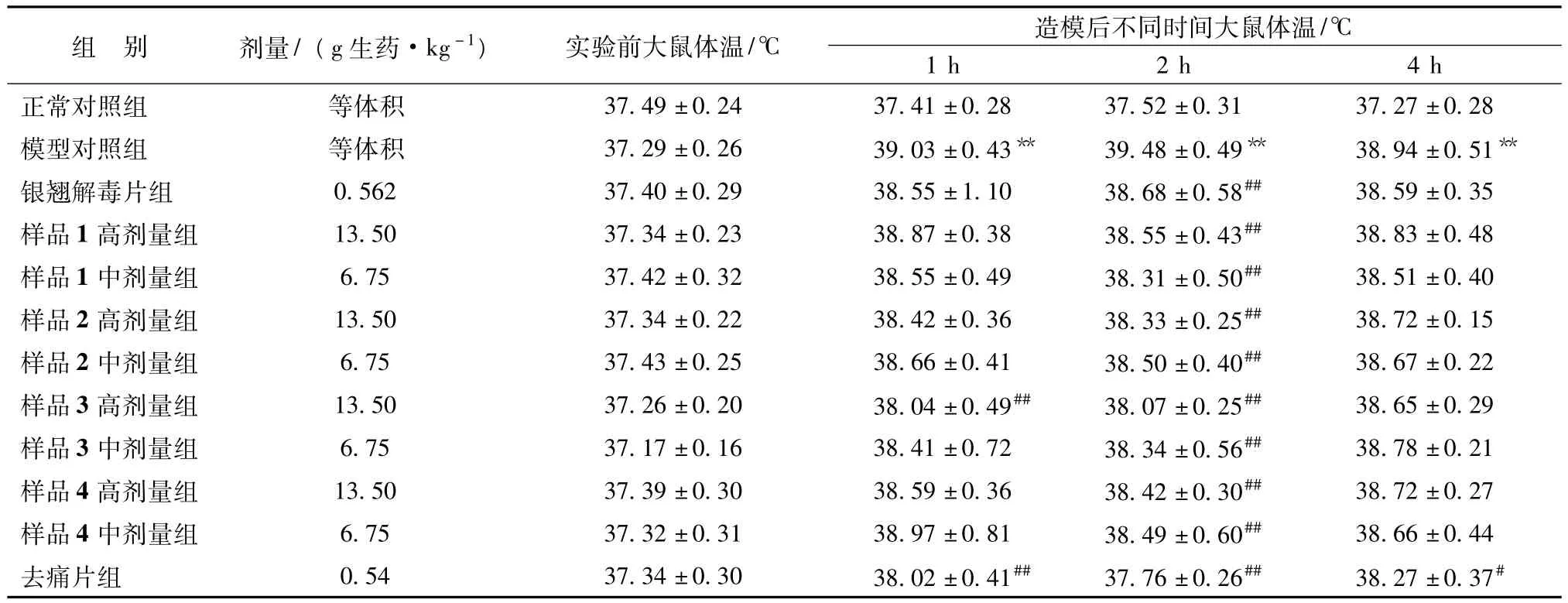
表2 不同工艺样品对内毒素所致大鼠高热的影响(±s,n=10)
注:与正常对照组比较,*P<0.05,**P<0.01;与模型对照组比较,#P<0.05,##P<0.01。
组别剂量/(g生药·kg-1)实验前大鼠体温/℃造模后不同时间大鼠体温/℃1 h2 h4 h正常对照组等体积37.49±0.2437.41±0.2837.52±0.3137.27±0.28模型对照组等体积37.29±0.2639.03±0.43**39.48±0.49**38.94±0.51**银翘解毒片组0.56237.40±0.2938.55±1.1038.68±0.58##38.59±0.35样品1高剂量组13.5037.34±0.2338.87±0.3838.55±0.43##38.83±0.48样品1中剂量组6.7537.42±0.3238.55±0.4938.31±0.50##38.51±0.40样品2高剂量组13.5037.34±0.2238.42±0.3638.33±0.25##38.72±0.15样品2中剂量组6.7537.43±0.2538.66±0.4138.50±0.40##38.67±0.22样品3高剂量组13.5037.26±0.2038.04±0.49##38.07±0.25##38.65±0.29样品3中剂量组6.7537.17±0.1638.41±0.7238.34±0.56##38.78±0.21样品4高剂量组13.5037.39±0.3038.59±0.3638.42±0.30##38.72±0.27样品4中剂量组6.7537.32±0.3138.97±0.8138.49±0.60##38.66±0.44去痛片组0.5437.34±0.3038.02±0.41##37.76±0.26##38.27±0.37#
结果显示,与模型对照组比,各样品高、中剂量组2h和样品3提取物高剂量组1h均有明显的解热作用,其作用以样品3最好。
2.2 黄芩苷的测定方法[9]
2.2.1 色谱条件AgilentExteng XDB-C18色谱柱(4.6 mm×250 mm,5 μm)PN990967-902;流动相为甲醇-水-磷酸(47∶53∶0.2);柱温30℃;体积流量1.0 mL/min;检测波长280 nm。
2.2.2 对照品溶液的制备精密称取在60℃减压干燥4 h的黄芩苷对照品2.845 mg,至50 mL量瓶中,加甲醇至刻度,即每1 mL含56.9 μg的溶液,即得。
2.2.3 标准曲线的绘制分别量取对照品溶液1、3、5、8、10、12 μL按上述条件进样,测得峰面积。以进样量为横坐标,峰面积为纵坐标作图,得标准曲线的回归方程为Y=2.815 324 8X+2.102 921,相关系数r=0.999 99。表明黄芩苷的量在56.9~682.8 ng之间范围内线性关系良好。
2.2.4 供试品溶液的制备精密移取水提取液4 mL,置50 mL量瓶中,加入76%乙醇定容,摇匀,静置24 h,精密量取上清液1 mL,置10 mL量瓶中,加甲醇至刻度,用0.45 μm微孔滤膜滤过,取续滤液,即得。
2.2.5 测定方法分别精密吸取对照品溶液2 μL、10 μL和供试品溶液各5 μL注入液相色谱仪,测定,计算提取液中黄芩苷的含有量。
2.2.6 精密度试验精密吸取供试品溶液5 μL,按上述色谱条件重复进样6次,测得峰面积积分值RSD为0.48%。
2.2.7 稳定性试验分别精密吸取同一份供试品溶液5μL,分别于0、2、4、6、8、12 h按上述色谱条件进样,测得峰面积积分值RSD为0.46%。表明供试品溶液在12 h内稳定。
2.2.8 重复性试验取同一浓缩液样品,分别按上述供试品溶液制备方法制备供试品溶液5份,按上述色谱条件进样5 μL,测得峰面积,计算含有量RSD为0.92%。
2.2.9 回收率试验取已知含有量浓缩液样品9份,分别精密加入一定量的黄芩苷对照品,按上述供试品制备与测定方法进行测定,计算黄芩苷检出量,测得黄芩苷平均回收率为98.06%,RSD为1.14%。
2.2.10 阴性对照试验按处方比例,称取除黄芩药材外的各味药材,分别加10倍水,煎煮两次,每次2 h,减压浓缩至500 mL,按上述供试品溶液的制备方法制备阴性供试品溶液。按上述方法测定,结果表明,阴性对照溶液在黄芩苷相应位置无吸收,处方中其它药味对本测定无干扰。
2.3 干浸膏量的测定精密吸取浓缩液50 mL,置已恒质量的蒸发皿中,水浴蒸干,照干燥失重测定法(《中国药典》2010年版一部附录IX G)测定,计算干浸膏质量。
2.4 挥发油提取工艺优选照《中国药典》2010年版一部附录ⅩD挥发油测定法甲法提取挥发油,以挥发油总质量为考察指标,对影响提取较大的浸泡时间、加水量和蒸馏时间进行考察研究,各因素水平见表3。
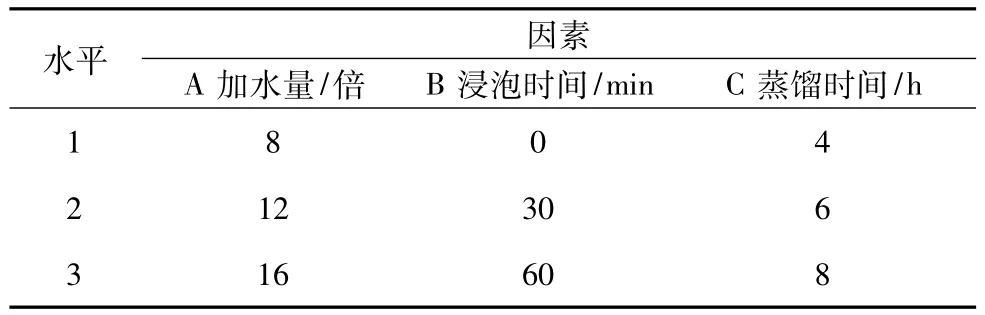
表3 挥发油提取因素水平
2.4.1 正交试验按处方比例,称取鱼腥草和辛夷药材9份,每份330 g,照L9(34)正交设计试验表安排试验,分取挥发油,加0.5 g无水硫酸钠脱水,过滤,用约5 mL乙醚洗涤容器及硫酸钠,挥发油转移至已恒质量的称量瓶中,40℃挥干乙醚,称质量,结果见表4、表5。
结果表明:因素A和因素C对实验结果影响显著,各因素的主次顺序为C>A>B,C因素2、3水平间无显著差别,最优提取工艺确定为药材加12倍水,回流提取6 h;即A2B1C2。
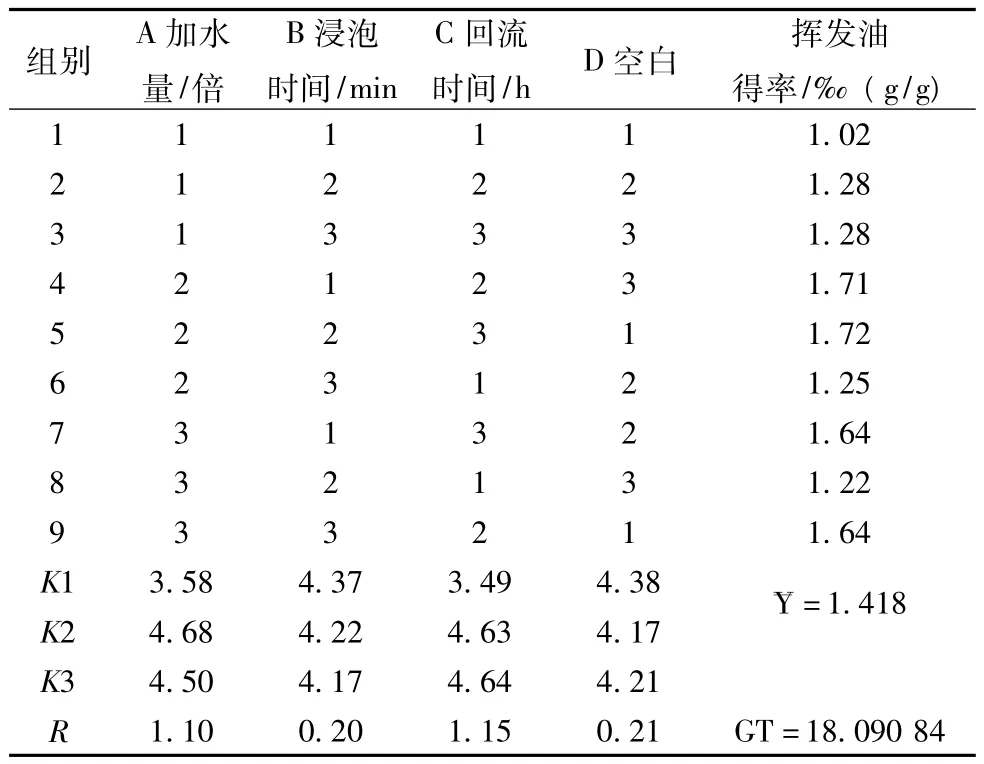
表4 挥发油提取工艺正交实验结果
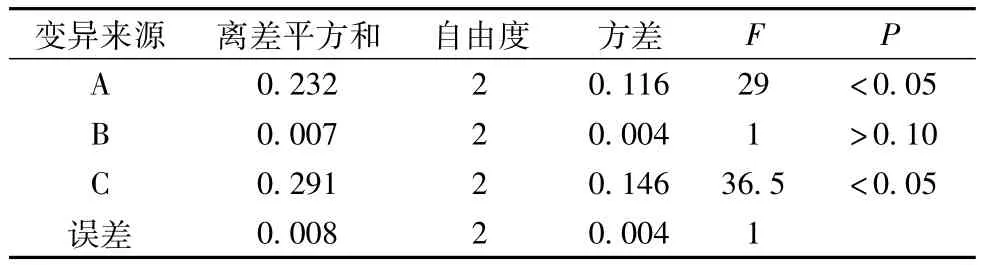
表5 方差分析
2.4.2 验证试验按处方比例取鱼腥草、辛夷药材,共3份,按优选的工艺条件提取挥发油。3次试验挥发油得率分别为0.179%、0.176%、0.176%,平均0.177%,表明该工艺稳定可行,重复性好。
2.5 水提取工艺优选以黄芩苷含有量和干浸膏得量的综合评分值为指标,对影响药材水提取的加水量、煎煮时间和煎煮次数进行考察研究,因素水平见表6。
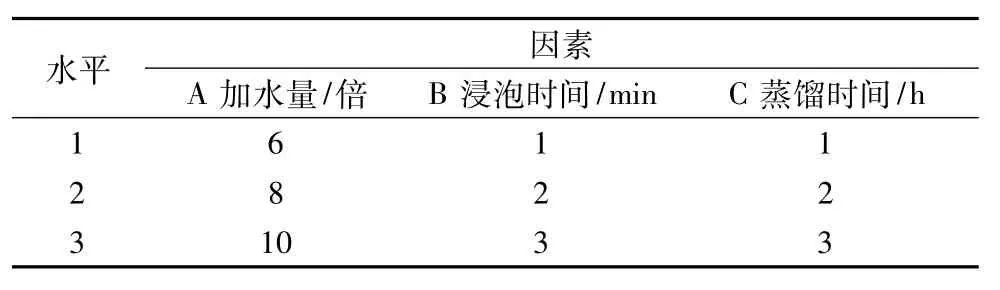
表6 因素水平
2.5.1 正交试验按处方比例,称取黄芩等药材9份,每份204 g,按正交实验表L9(34)安排试验。滤过,提取液合并,浓缩并定容至500 mL,既得。测定干浸膏得量(X1)和黄芩苷含有量(X2)。按公式Y=[(X1i/X1max)×0.4+(X2i/X2max)×0.6)]×100计算综合评分值,以综合评分值计算正交试验结果,并进行方差分析,结果见表7、表8。
结果表明,因素主次为提取次数(C)>加水量(A)>提取时间(B)。因素C和因素A对试验结果有影响。最佳工艺为:分别加药材量8倍水提取3次,每次1 h,即A2B1C3。
2.5.2 验证试验按最佳水提取工艺条件重复试验3次,结果表明,平均干浸膏得率为26.58%,RSD为1.10%。黄芩苷平均质量浓度为7.518 mg/mL,RSD为1.89%。计算黄芩苷的平均提取率为87.65%(处方中黄芩药材含黄芩苷总量为4 285.8mg),平均综合评分值为98.33,与正交试验综合评分最大值之间接近,表明该工艺合理、稳定、可靠。
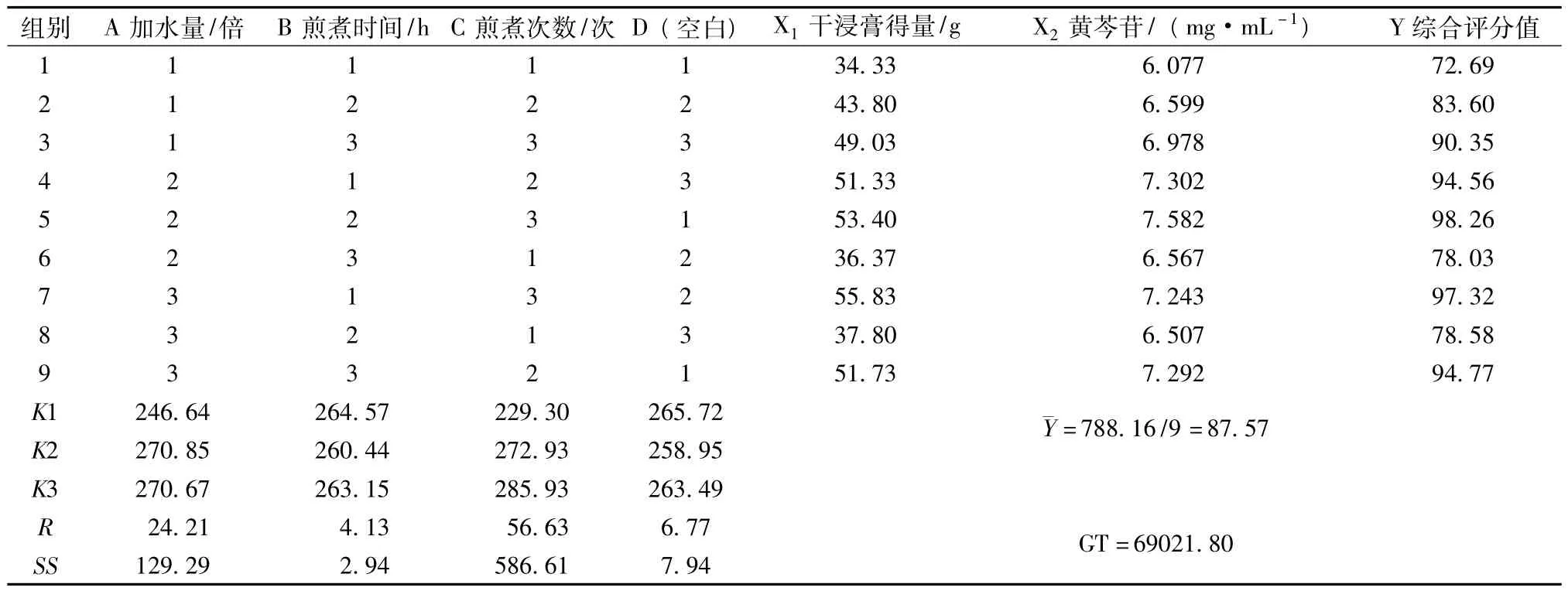
表7 正交设计试验结果
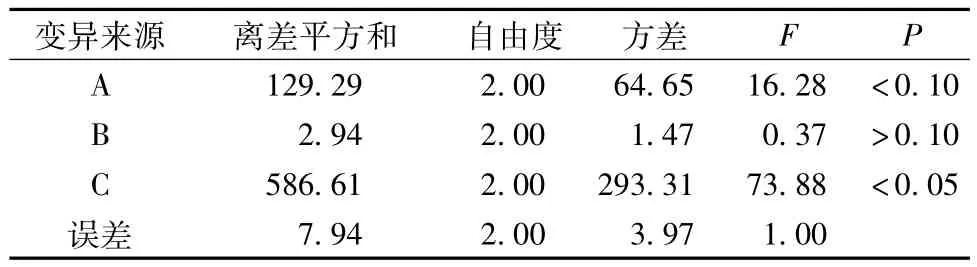
表8 方差分析
3 讨论
3.1 中药复方成分复杂,其效应物质基础是复方所含的全成分[10],同一处方不同提取工艺所产生效应物质之间的比例不同,产生药效作用的强弱也不相同。药效试验结果表明,本方提取工艺路线以挥发油提取优于不提取工艺,水提取优于醇提取或水提醇沉工艺,提示,处方中挥发油为有效成分之一,多糖类等醇中溶解度低的物质可能也是有效成分之一。
3.2 黄芩为方中君药,选用黄芩苷作为提取评价指标之一,分析方法成熟,分析结果可靠。经挥发油提取和水提取工艺验证表明,优化的工艺参数稳定、可靠、有效,为本制剂的下一步研究奠定了良好的基础。
[1]孔晓华,周玲芝.中药虎杖的研究进展[J].医药导报,2009,15(5):107-110.
[2]胡汝晓,肖冰梅,谭周进,等,鱼腥草的化学成分及其药理作用[J].中国药业,2008,17(8):23-25.
[3]高守红,杨少麟,范国荣.虎杖苷的研究进展[J].药学实践杂志,2005,23(3):145-147.
[4]李艳荣,潘海峰,魏红,等中药材黄芩的研究近况[J].承德医学院学报,2009,26(4):418~420.
[5]吴佩颖,徐莲英,陶建生.鱼腥草的研究进展[J].上海中医药杂志,2006,40(3):62-64.
[6]朱雄伟,杨晋凯,胡道伟.辛夷成分及其药理应用研究综述[J].海峡药学,2002,14(5):5-7.
[7]郑虎占,董泽宏,余靖.中药现代研究与应用[M].北京:学苑出版社,1997.
[8]陈奇.中药药理研究方法学[M].北京:人民卫生出版社,1993:271-272.
[9]陈强,周浓,张海珠.HPLC测定利咽解毒颗粒中黄芩苷的含量[J].安徽农业科学,2010,38(35):20029-20030.
[10]郝福,蒋晔,李艳荣,等.复方中药化学成分的研究进展[J].中成药,2007,29(2):258-262.
[11]国家药典委员会.中华人民共和国药典:2010年版一部[S].北京:中国医药科技出版社,2010.
R284.2
B
1001-1528(2012)10-2028-04
2012-04-21
王洛临(1958—),男,主任中药师,从事中药新药研发与工艺研究。Tel:(020)83501292,E-mail:luolin_w@163.com

