HPLC法同时测定冷冻保鲜冬虫夏草中尿苷和腺苷
郑永彪, 汪晓娟, 韩晓萍
(1.青海省食品药品检验所,青海西宁810016;2.青海省制药厂,青海西宁810003)
冬虫夏草是我国著名的珍贵中药,为麦角菌科真菌冬虫夏草菌Cordyceps sinensis(BerK.)Sacc.寄生在蝙蝠娥科昆虫幼虫上的子座及幼虫尸体的复合体[1];主要含多种氨基酸、核苷类 (腺苷、尿苷、鸟苷)、冬虫夏草甾醇、糖醇类 (β-谷甾醇、麦角甾醇、D-甘露醇)、脂肪酸、酯、烷烃等成分[2]。
冬虫夏草干燥品收载于《中国药典》2010年版一部,标准中有性状和高效液相色谱法测定腺苷,规定腺苷质量分数不得低于0.010%[3];冷冻保鲜冬虫夏草系新采挖的冬虫夏草除去似纤维状的附着物及泥土等杂质,快速进行冲洗、清洁和甩干,然后冷冻、密封贮藏,为青海南英雪线王冬虫夏草生物科技有限开发的新型加工品。前期预实验表明,在同一色谱条件下能同时对尿苷和腺苷进行定量测定,且在冷冻保鲜冬虫夏草中,尿苷的含有量远高于腺苷,10批样品的分析结果显示尿苷含有量约为腺苷的5倍以上,故为有效全面地控制药材质量,体现中药整体用药的物质基础的优越型,本研究建立了冷冻保鲜冬虫夏草中腺苷和尿苷同时测定的HPLC方法,该法简便可行,精确可控,可用于冷冻保鲜冬虫夏草的质量控制。
1 仪器与材料
1.1 仪器 Waters2695高效液相色谱仪,Waters2998二极管阵列检测器,Empower 2工作站;Agilent 1100高效液相色谱仪,Agilent 1100 LC/MSD trap质谱仪;METTLER AB204电子天平;水浴锅;超声波震荡器;密理博超纯水器。
1.2 试药 冬虫夏草药材10批 (批号分别为1~10,青海南英雪线王冬虫夏草生物科技有限公司提供),腺苷对照品 (879-200001,中国药品生物制品检定所),尿苷对照品 (887-200001,中国药品生物制品检定所),乙腈和甲醇为色谱纯,水为超纯水,其余试剂均为分析纯。
2 方法与结果
2.1 色谱条件[4-5]色谱柱为 Waters sunfire(250 mm×4.6 mm,5 μm);以水为流动相A,以乙腈为流动相B,按表1进行梯度洗脱;检测波长为260 nm;柱温35℃;理论塔板数按尿苷峰计算应不得低于3000。

表1 梯度洗脱顺序
2.2 对照品溶液的制备 分别精密称取尿苷对照品20 mg和腺苷对照品2 mg,置于100 mL量瓶中,加水溶解并定容至刻度,摇匀,制得每1 mL约含尿苷20 μg、腺苷2 μg的混合对照品溶液。
2.3 供试品溶液的制备 取本品 (自然晾干,并同步测定水分)粉末0.2 g,精密称定,置具塞锥形瓶中,精密加入甲醇50 mL,称质量,超声提取45 min(250 W,40 KHz),取出,放冷至室温,再称定质量,用甲醇补足减失的质量,摇匀,过滤,弃取初滤液,精密量取续滤液25 mL置于蒸发皿中,蒸干,残渣用水溶解并转移至10 mL量瓶中,加水至刻度,摇匀,用0.45 μm微孔滤膜过滤,即得[6]。
2.4 系统适应性和专属性考察 分别精密吸取上述两种溶液各10 μL,注入液相色谱仪,测定即可。色谱图见图1,表明在该色谱条件下,尿苷和腺苷分离良好,说明样品的处理方法能很好的去除杂质对目标色谱峰测定的干扰。
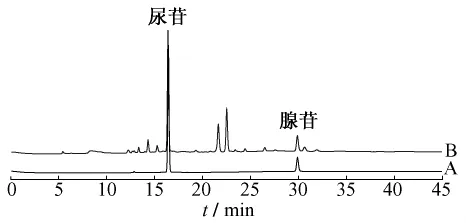
图1 供试品和对照品的色谱图
同时用LC-MS方法对上述两种溶液中的目标峰进行了一致性指认。液相参数同上述2.1项,质谱参数为[7-8]:ESI源,雾化气 (N2)体积流量为4.5 L/min,干燥气体为12 L/min,干燥温度380℃,扫描范围为100~400 m/z,正离子扫描模式,在此色谱条件下的峰指认结果见表2,供试品溶液和对照品溶液中目标物质具有一致性,实验结果表明在相应的色谱峰位置无杂质干扰。

表2 峰质谱指认结果
2.5 线性关系考察 精密称取尿苷对照品5.31 mg,腺苷对照品6.18 mg,分别置于50 mL量瓶中,加水溶解并定容至刻度,摇匀,即得 (每1 mL含尿苷 106.2 μg,腺苷123.6 μg),分别精密量取尿苷16.0 mL和腺苷2.0 mL,置50 mL量瓶中,加水溶解并定容至刻度,摇匀,即得混合对照品溶液 (每1 mL含尿苷33.98 μg,腺苷4.944 μg)。分别精密吸取此混合对照品溶液 1.0、2.0、5.0、8.0、10.0 mL加水稀释并定容到10 mL,得一系列对照品溶液;按2.1项色谱条件进行分析,进样量10 μL,记录相应的进样量和峰面积,以进样量为横坐标、峰面积为纵坐标进行线性回归,计算回归方程,结果见表3。

表3 尿苷和腺苷的线性实验结果
结果表明,在所测的进样范围内,尿苷和腺苷的进样量与峰面积之间呈现良好的线性关系。
2.6 精密度考察 分别精密吸取2.2项下的混合对照品溶液,按2.1项色谱条件进行重复进样5次,进样量10 μL,记录峰面积值,结果尿苷和腺苷的RSD值分别为0.41%、0.63%,结果表明,本方法精密度良好。
2.7 稳定性试验 取冷冻保鲜冬虫夏草药材样品 (样7),按2.3项制备供试品溶液,在2.1项色谱条件下,分别于0、6、12、18、24、30、36、48 h进样分析,进样量 10 μL,记录峰面积,结果尿苷和腺苷的 RSD值分别为0.87%、1.5%。结果表明,制备的供试品溶液在48 h内稳定,且稳定性良好。
2.8 重复性试验 取冷冻保鲜冬虫夏草药材样品 (样7)5份,精密称定,按2.3项供试品溶液制备法提取,在2.1项色谱条件下进行分析测定,分别计算尿苷和腺苷的质量分数,结果表明,尿苷和腺苷的质量分数分别为0.161%(RSD为0.54%)、0.0166%(RSD为1.0%),证明本方法重复性良好。
2.9 加样回收率试验 取冷冻保鲜冬虫夏草药材样品 (样7)6份,每份取0.1 g,精密称定,按2.3项供试品溶液制备法提取,在2.1项色谱条件下进行分析测定,计算加样回收率,结果见表4。结果表明,尿苷和腺苷的平均回收率分别为98.70%(RSD为0.48%)、97.39%(RSD为1.6%),证明本方法精确度良好。
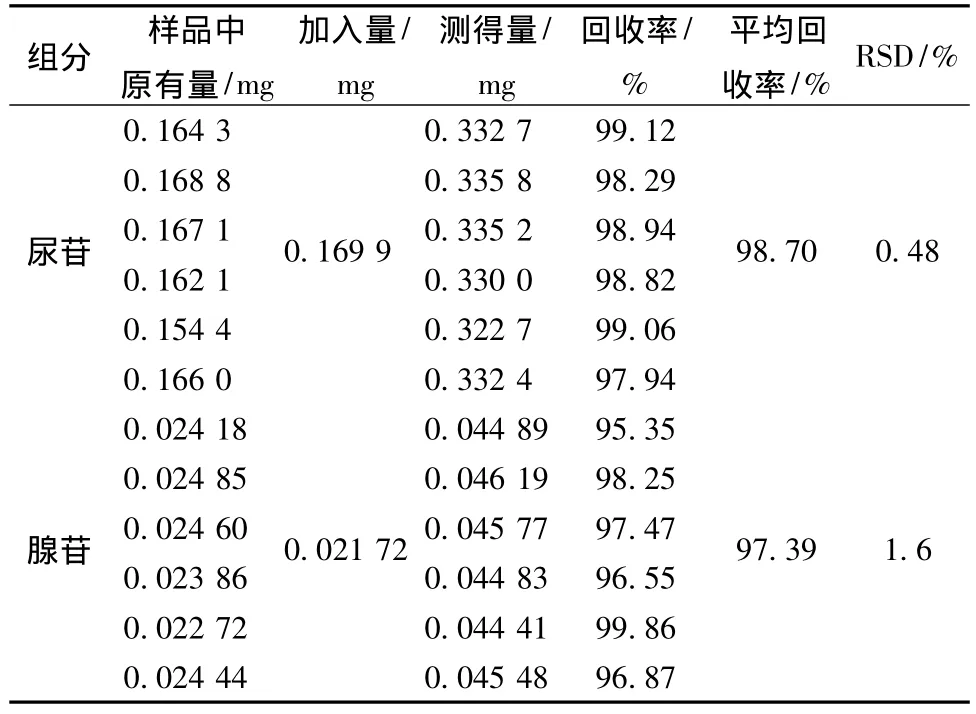
表4 回收率实验结果 (n=6)
2.10 结果 按所建立的测定方法,对10批冷冻保鲜冬虫夏草进行测定,结果表明:10批冷冻保鲜冬虫夏草中按干燥品计,尿苷的质量分数范围为0.129%~0.176%,平均质量分数为0.159%;腺苷的质量分数范围为0.0143%~0.0300%,平均质量分数为0.0232%,结果均在此测定方法的线性范围内。
上述实验表明,该方法样品处理简便,回收率好,精密度,重复性均符合有关要求,可用于冷冻保鲜冬虫夏草的质量控制。
3 讨论
3.1 根据上述定量测定结果可以发现,10批冷冻保鲜冬虫夏草中腺苷的质量分数范围为0.0143%~0.0300%,平均质量分数为0.0232%,高于2010年版《中国药典》中的限量0.010%;由于核苷类成分为生物代谢产物,其含有量越高表明越多的虫体组织转变成了菌丝体[9]。
3.2 在前期对冬虫夏草干燥品指纹图谱研究的基础上[10],比较了这10批冬虫夏草新鲜品色谱图与原来干燥品指纹图谱的区别,见图2,发现在相同称样量下冷冻保鲜冬虫夏草中色谱峰的数量和面积均大于干燥品,表明冷冻保鲜冬虫夏草具有较好的起效物质基础。
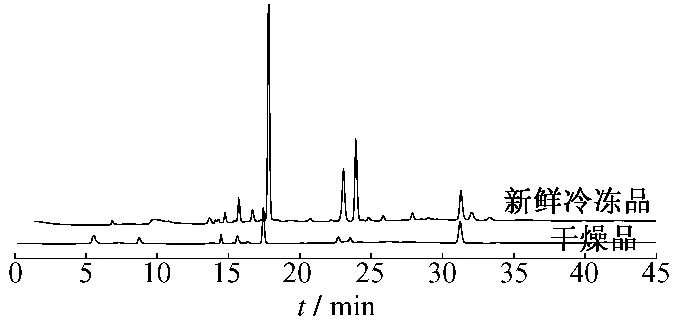
图2 冷冻保鲜冬虫夏草和干燥品的图谱比较
[1]赵余庆,于 明,陈立君,等.冬虫夏草属真菌化学研究概况[J].中草药,1999,30(12):950-953.
[2]石 岩,王钢力,林瑞超,等.冬虫夏草的化学成分综述[J].中医研究,2006,19(7):54-56.
[3]国家药典委员会.中华人民共和国药典:2010年版一部[S].北京:中国医药科技出版社,2010:106.
[4]栾 兰,王钢力,林瑞超,等.冬虫夏草与虫草发酵菌丝体的HPLC指纹图谱比较研究[J].中成药,2010,32(6):893-897.
[5]张元杰,钱正明,陈肖家,等.HPLC法同时测定补益中药中尿苷、腺嘌呤、鸟苷和腺苷的含量[J].药物分析杂志,2010,30(1):112-115.
[6]许 勇,王 柯,季 申.高效液相色谱法测定冬虫夏草口服液中腺苷[J].中成药,2011,33(5):909-911.
[7]杨 钊,迟少云,张春辉.冬虫夏草及其代用品中腺苷和虫草素的LC-MS-MS定量分析研究[J].中国中药杂志,2007,32(19):2018-2021.
[8]黄兰芳,郭方遒,梁逸曾,等.HPLC-ESI-MS测定冬虫夏草和蚕蛹虫草中腺苷和虫草素含量[J].中国中药杂志,2004,29(8):762-764.
[9]梁洪卉,程 舟,杨晓伶,等.HPLC定量分析冬虫夏草的主要核苷类有效成分[J].中药材,2008,31(1):58-60.
[10]王钢力,金红宇,韩晓萍,等.冬虫夏草药材的质量研究及存在问题[J].中草药,2008,39(1):115-118.

