PrP106-126对星形胶质细胞层黏连蛋白和纤黏连蛋白表达的影响
李玉荣,武现军,吴 浩,陈立功,霍书英,高玉红
(1.河北农业大学动物医学院,河北保定071001;2.河北省兽用生物制品工程技术研究中心,河北保定071001;3.保定市畜牧水产局,河北保定071051)
朊病(Prion disease)又称传染性海绵状脑病(Transmissible spongiform encephalopathies,TSEs),是由朊病毒引发人和动物的一组中枢神经系统疾病[1]。其主要病原分子是由正常细胞表达的细胞型朊蛋白(cellular prion protein,Pr PC)构象改变而成的具有蛋白酶抗性的致病型朊蛋白(scrapie prion protein,Pr PSc)。朊病毒主要引起中枢神经系统的病理学变化,包括神经元空泡化、丧失和胶质细胞增生[1]。尽管国内外展开大量的研究,但迄今为止,人们尚未能完全掌握Pr PSc聚集引起朊病发生的确切机制。
BV-2小胶质细胞系保留了小胶质细胞的表型和功能特征,常用于朊病的研究[2-3]。体外合成人源朊蛋白多肽Pr P106-126,对应人Pr P氨基酸序列106-126,具有与Pr PSc相同的理化性质,包括富含β-折叠成分、可自发形成淀粉样纤维和具有相对蛋白酶 K 抗性等[4-5]。Pr P106-126 可导致体外培养的不同组织来源的原代神经元的死亡[6],导致视网膜细胞的凋亡和改变视网膜的电位[7],成为研究朊病毒的良好病毒模型[4-7]。
星形胶质细胞增生是TSEs的一个重要特征,且早于神经元的退行性变化[8]。增生的星形胶质细胞可通过降低谷氨酸的摄入,导致胞外高谷氨酸水平,表现出神经毒性[9]。体外研究表明,Pr P106-126诱导小胶质细胞活化并释放一系列的活性因子如IL-1和IL-6,从而促进多因子诱导的星形胶质细胞增生活化[9]。但目前并不能确定哪一种或几种物质起主要的作用[10],因此,本文选择Pr P106-126作用于小胶质细胞的条件培养基作用于星形胶质细胞,以检测PrP106-126对星形胶质细胞的间接影响。另因Pr P106-126作用于星形胶质细胞对其胞内蛋白质和氨基酸表达变化知之甚少,仅见有关星形胶质细胞内胶质纤维酸性蛋白、谷氨酰胺、IL-1R、IL-6R和细胞周期相关蛋白的报道[8-11]。星形胶质细胞合成并分泌层黏连蛋白(Laminin,LN)和纤黏连蛋白(Fibronectin,FN)到胞外基质,具有神经保护作用,促进神经突的生长[12],且在氧化压力存在的条件下胞外基质中LN、FN的表达增加以阻止神经元的死亡[13]。本文拟研究PrP106-126对星形胶质细胞的直接和间接作用,并检测细胞的增殖活性和LN、FN的表达水平,为阐明朊病的发生机制提供基础资料。
1 材料与方法
1.1 材料
朊蛋白多肽Pr P106–126:KTNMKHMAGA AAAGAVVGGLG,打乱序列 Scr(LVGAHAGKMGANTAKAGAMVG)作为阴性对照,由上海生工生物工程技术服务有限公司合成;干粉多肽以PBS(p H 7.4)溶解,制成5 mmol/L的储备液,冻存于-20℃;小胶质细胞BV-2购自中国科学院细胞生物所;鼠单克隆抗体FN、LN为美国Santa公司产品;鼠单抗β-actin抗体、二抗羊抗鼠为北京中杉金桥生物公司产品;ECL超敏发光液为北京普利莱基因技术公司产品;DMEM培养基和胎牛血清均为美国Gibco公司产品;TRIZOL试剂为美国Promega公司产品;M-MLV反转录试剂盒及Taq DNA聚合酶为北京博大泰克生物公司产品;MTT试剂盒为北京碧云天生物技术研究所产品;胰蛋白酶为Sigma公司产品;细胞培养板为美国Corning公司产品。
1.2 方法
1.2.1 星形胶质细胞培养及鉴定 参考Brown D R等[8]方法稍加改进。出生1 d内的SD大鼠,4只~5只,去脑膜,取大脑皮层,剪碎并吹打,0.5mL/L胰酶消化,过筛并培养于75 cm2培养瓶。常规培养至14 d细胞融合,通过振荡法移去小胶质细胞和其他杂质细胞,260 r/min 2 h,黏附细胞主要为星形胶质细胞;用胰酶处理并继续培养30 min,其中混合的小胶质细胞黏附于培养瓶而星形胶质细胞仍存在于培养基中;而后,星形胶质细胞分别种植于24孔和96孔培养板中2 h,通过更换培养基移去没有黏附的杂质细胞以进一步纯化。采用星形胶质细胞特异性的胶原纤维酸性蛋白(GFAP)多抗进行免疫细胞化学染色法鉴定星形胶质细胞。常规操作,在第一抗孵育时采用PBS稀释的1∶500兔抗人GFAP抗血清,最后采用DAB显色法观察。
1.2.2 BV-2小胶质细胞条件培养基 BV-2细胞以4×104细胞/孔的密度接种于6孔细胞培养板,培养基及培养条件同混合胶质细胞的培养,培养12 h后,分别加入 0 及 80μmol/L Pr P106-126,培养2 d后,收集培养基分别为条件培养基MiCM(conditioned medium from microglia)和 MiCMPrP106-126(为方便描述,下文称为 MiCMPrP106)。1.2.3 试验分组 星形胶质细胞培养24 h后,分别处理如下:空白对照、Scr处理组(添加80μmol/L Scr)、Pr P106-126处理组(添加80μmol/L Pr P106-126)、MiCM 组(更换培养基为 MiCM)和 MiCMPr P106组(更换培养基为MiCMPr P106),继续培养48 h。96孔板分别于24 h和48 h检测星形胶质细胞活性,24孔板于48 h用于测定LN及FN的表达。
1.2.4 MTT法检测星形胶质细胞的增殖活性 每孔加入5 g/L MTT,孵育3 h,去上清,每孔加150 μL DMSO,避光振荡10 min,酶标仪测 OD570 nm值。
1.2.5 星形胶质细胞LN和FN蛋白水平表达检测 以细胞总蛋白提取试剂分别从5个不同处理组中提取细胞蛋白。自各组取等量样品在SDS-聚丙烯酰胺凝胶进行电泳分离,进行常规 Western Blot检测,转膜后,一抗4℃ 孵育过夜,二抗作用1 h,发光液作用后,X光片显影、定影。其中β-actin作为内参对照。
1.2.6 星形胶质细胞LN和FN mRNA表达检测
1.2.6.1 cDNA的合成 利用Trizol试剂分别从5个不同处理组中提取总RNA,以等量的RNA为模板,Oligo(d T)为引物,按照 M-MLV反转录说明书进行,cDNA置于-20℃保存备用。
1.2.6.2 基因PCR扩增及DNA片段的琼脂糖检测 引物参考GenBank上已发表的序列,用Primer 5.0软件设计合成引物如下:β-actin,上游引物5′-TGCTGTCCCTGTATGCCTVCTG-3′和下游引物5′-TGCTGTCCCTGTATGCCTCTG-3′;LN,上 游引物5′-GGCTTCTATGACCTGAGTGC-3′和下游引物5′-GCCCAAGATTGGCTTCCTC-3′;FN 上游引物5′-CCGTGGAGTAGTTGGTTAGT-3′和下游引 物 5′-TCAGGGCTTGAGTAGGTCA-3′。 采 用20μL反应体系,分别取不同组别2μL cDNA,常规PCR扩增。PCR扩增产物用10 g/L琼脂糖凝胶进行电泳,以β-actin作为内参进行半定量PCR。应用Kodak凝胶成像系统进行拍照判别,并以Image tool 3.0图像分析软件分析EB染色情况,并得出目的基因与β-actin灰度比值。
1.2.7 统计分析 使用SPSS 12.0软件包,进行单因子方差分析,有试验数据均以“平均数±标准差”表示,P<0.05为差异显著,P<0.01为差异极显著。
2 结果
2.1 星形胶质细胞培养及鉴定结果
采用文献[8]方法培养星形胶质细胞,图1A为相差显微镜图,为经振荡和利用贴壁时间差纯化后的星形胶质细胞,可见以星形胶质细胞为主的细胞长满培养瓶的底层,相互衔接,胞间发生交错联系,生长良好;其上层有少量震荡后未贴壁的细胞。图1B为进一步纯化后,DAB显色GFAP抗体标记的星形胶质细胞鉴定结果,镜下可见反应阳性细胞胞浆和突起为黄褐色,即细胞表达GFAP。GFAP阳性率很高,说明所获得星形胶质细胞的纯度较高。
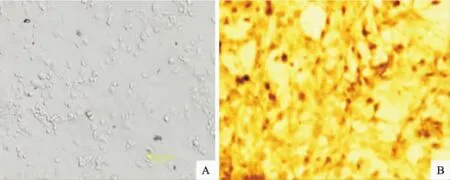
图1 体外培养的星形胶质细胞的形态学观察(A)及鉴定(B)(200×)Fig.1 Morphological observation(A)and identification(B)of primarily cultured astrocytes(200×)
2.2 Pr P106-126在MiCM存在时促进星形胶质细胞的增殖
MTT检测结果显示,星形胶质细胞的增殖活性在MiCM-Pr P106处理24 h和48 h后显著高于正常对照组(P<0.01),分别提高27% 和35% ,且活性提高呈一定的时效性;相对于MiCM分别提高20%(P<0.01)和28%(P<0.01)。单独Pr P106-126或MiCM对星形胶质细胞的生长无影响(P>0.05)。而Scr处理组未见明显变化(图2)。
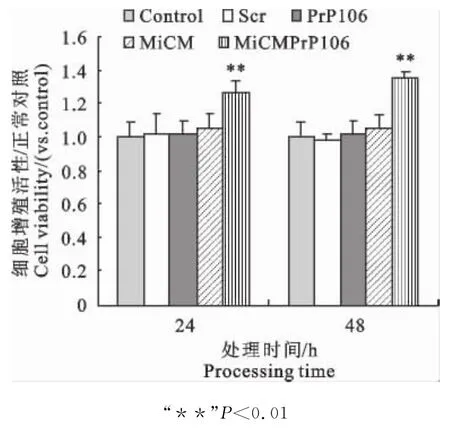
图2 培养48 h星形胶质细胞增殖活性Fig.2 Proliferation viability of the primary astrocyte cultured for 48 h
2.3 Pr P 106-126对星形胶质细胞FN和LN m RNA表达的影响
本研究采用半定量法对FN和LN的m RNA表达水平进行了检测,图3 A所示为FN、LN和βactin基因的半定量扩增结果,图3 B为统计结果。处理48 h后,FN的表达,MiCMPr P106较正常对照组提高90%(P<0.01),较 MiCM 提高86%(P<0.01),且其他组与正常对照组相比差异不显著(P>0.05)。LN的表达,Pr P106-126与 MiCMPr P106组分别较正常空白对照提高55%(P<0.01)、70% (P<0.01),MiCMPr P106较 MiCM 提高53%(P<0.01),而MiCM组与正常对照组无显著性差异(P>0.05),可见 Pr P106-126可以促进LN的表达。而Scr处理组未见明显变化。

图3 半定量RT-PCR检测Pr P106-126对FN和LN的表达的影响Fig.3 The effects of Pr P on the mRNA expression of FN and LN detected by RT-PCR
2.4 Pr P 106-126对星形胶质细胞FN和LN蛋白水平表达的影响
本研究采用Western blot法对FN和LN的蛋白表达水平进行了检测,图4 A所示为FN、LN和β-actin蛋白 Western blot检测结果,图4 B为统计结果。PrP106-126处理48 h后,FN的表达,MiCMPrP106较正常对照组提高50%(P<0.01),较MiCM 提高44%(P<0.01),而 MiCM 或Pr P106-126组与正常对照相比差异不显著(P>0.05),与m RNA水平检测结果相一致,可见单独Pr P106-126与MiCM均不能改变FN的表达水平,而只有MiCMPr P106-126提高了星形胶质细胞FN的表达。LN的表达,Pr P106-126 与 MiCMPrP106-126组分别较正常空白对照提高43%(P<0.01)、55%(P<0.01),MiCMPr P106 较 MiCM 提 高 53% (P<0.01),而 MiCM 与正常对照无显著性差异(P>0.05);可见PrP106-126可以促进LN的表达,单独MiCM不能促进LN的表达。而Scr处理组未见明显变化(P>0.05)。

图4 Western blot检测PrP106-126对FN和LN的表达的影响Fig.4 The effects of PrP on expression of FN and LN detected by Western blot
3 讨论
Pr P106-126促进星形胶质细胞的增殖具有小胶质细胞依赖性。本研究发现经PrP106-126处理的小胶质细胞培养液可以显著促进星形胶质细胞的增殖,这与 Brown D R 等[8]的结论是一致的;而Pr P106-126直接作用于星形胶质细胞则无促进作用,可见Pr P106-126对星形胶质细胞的增殖依赖于活化小胶质细胞的存在。研究表明,在朊病发生、发展过程中,小胶质细胞所释放的活性物质有组织蛋白S、细胞因子IL-1、IL-6及淋巴细胞趋化因子等,但这一活化作用不同于细菌脂多糖或淀粉体等作用于小胶质细胞的产物[14]。而这些因子的部分受体在星形胶质细胞有表达,包括IL-1R、IL-6R,这可以解释小胶质细胞释放因子参与星形胶质细胞的增殖和增生[15]。另外,Pr P106-126可直接作用于小胶质细胞而导致氧自由基和细胞因子的释放而直接或间接参与朊病的发生。
本研究表明Pr P106-126可以直接促进LN的表达,但是对FN表达的促进作用需要小胶质细胞的活化。LN是一高分子质量的异源糖蛋白(800 ku),由3条肽链构成,2短(α、β)1长(γ)。LN 同其配体结合实现其功能的调节,研究表明即便单独表达γ链,足以实现其促神经突生长的作用。近来研究表明PrPC可以与LN的γ高亲和力结合,这一结合对Pr PC的生理功能有重要的作用,经抗体结合后Pr PC相应功能消失[16]。Pr PC结合LN并与37 ku/67 ku LN受体相互作用,参与20%~50% 细胞膜蛋白Pr PC的内化。Pr PC、LN二者与37 ku/67 ku LN受体同位点结合这一特点,导致Pr PC与LN竞争结合位点。据报道,PrP106-126导致星形胶质细胞内源性Pr PC的高表达[1],这意味着LN的增加可以代偿性增加与LN受体的作用位点,实现各自的信号传导[15]。LN与Pr PC之间的关系同时也解释在诱导表达方面LN与FN的不同,LN的表达与星形胶质细胞的增殖之间没有直接的关系,如本研究的结果所述,Pr P106-126促进LN的表达,但不促进星形胶质细胞的增殖。但是,本研究的结果MiCMP106促进星形胶质细胞FN的表达与细胞增殖,意味着FN参与细胞的增殖,这一结果与文献[17]一致,但同细胞系,星形胶质细胞FN的表达和胞间沉积受多种因素的调节,如bFGF和TGF,在Pr P106-126作用下,小胶质细胞产生的某些因子可有效刺激FN的表达,FN的表达与神经胶质细胞的增殖有关,星形胶质细胞是一个分化程度比较低的细胞,相比于神经元可以通过增殖以逃避Pr P106-126的毒性。
总之,本文首次发现PrP106-126促进体外培养的星形胶质细胞细胞基质蛋白FN和LN的表达,且Pr P 106-126对FN这种作用是小胶质细胞依赖性的。这可能只是早期的变化,需要强调的是本试验是在细胞上完成的,有必要在体内进一步验证。
[1]Prusiner S B.Molecular biology of prion disease[J].Science,1991,252:1515-1522.
[2]Jang S,Kelley K W,Johnson R W.Luteolin reduces IL-6 production in microglia by inhibiting JNK phosphorylation and activation of AP-1[J].PNAS,2008,105:7534-7539.
[3]Bach C,Gilch S,Rost R,et al.Prion-induced activation of cholesterogenic gene expression by srebp2 in neuronal cells[J].Biol Chem,2009,284:31260-31269.
[4]Spinner D S,Cho I S,Park S Y,et al.Accelerated prion disease pathogenesis in toll-like receptor 4 signaling-mutant mice[J].J Virol,2008,82:10701-10708.
[5]Zhou X M,Xu G X,Zhao D M.In vitro effect of prion peptide PrP 106-126 on mouse macrophages:possible role of macrophages in transport and proliferation for prion protein [J].Microb Pathog,2008,44(2):129-134.
[6]Della-bianca V,Rossi F,Armato U,et al.Neurotrophin p75 receptor is involved in neuronal damage by prion peptide(106-126)[J].J B Chem,2001,276:38929-38933.
[7]Forloni G,Angeretti N,Chiesa R,et al.Neurotoxicity of a prion protein fragment[J].Nature,1993,362:543-546.
[8]Brown D R,Schmidt B,Kretzschmar H A.A neurotoxic prion protein fragment enhances proliferation of microglia but not astrocytes in culture[J].Glia,1996,18(1):59-67.
[9]Hafiz F B,Brown D R.A model for the mechanism of astrogliosis in prion disease[J].Mol Cell Neurosci,2000,16:221-232.
[10]Tribouillard-Tanvier D,Carroll1 J A,Moore R A.et al.Role of cyclophilin a from brains of prion-infected mice in stimulation of cytokine release by microglia and astroglia in vitro[J].J Biol Chem,2012,287:4628-4639.
[11]Hans W M,Ulrich J,Joachim K,et al.Astroglial neurotro-phic and neurite-promoting factors[J].Pharmacol & Therap,1995,65:1-18.
[12]Tanaka J,Toku K,Zhang B,et al.Astrocytes prevent neuronal death induced by reactive oxygen and nitrogen species[J].Glia,1999,28(2):85-96.
[13]Baker C A,Martin D,Manuelidis L,et al.Microglia from creutzfeldt-jakob disease-infected brains are infectious and show specific m RNA activation profiles[J].J Virol,2012,86(21):10905-10913.
[14]Kercher L,Favara C,Striebel J F,et al.Prion protein expression differences in microglia and astroglia in uence scrapie-induced neurodegeneration in the retina and brain of transgenic mice[J].J Virol,2007,81(19):10340-10351.
[15]Gwennaelle J W,Adrien K,Bernard M,et al.Determining the role of mononuclear phagocytes in prion neuroinvasion from the skin[J].J Leukocyte Biol,2012,91:5817-828.
[16]Graner E,Mercadante A F,Zanata S M,et al.Cellular prion protein binds laminin and mediates neuritogenesis[J].Brain Res Mol Brain Res,2000,76(1):85-92.
[17]Mahler M,Ben-Ari Y,Represa A.Differential expression of fibronectin,tenascin-C and NCAMs in cultured hippocampal astrocytes activated by kainate,bacterial lipopolysaccharide or basic fibroblast growth factor[J].Brain Res,1997,775(1-2):63-73.

