鸭瘟病毒YZH株的分离鉴定及其TK基因的序列分析
余爱花,杨 阳,张宝来,谷长勤,张万坡,程国富,胡薛英*
(1.华中农业大学动物医学院,湖北武汉430070;2.天津市津南区动物疾病预防控制中心,天津300350)
鸭瘟是鸭、鹅及多种雁形目动物的一种急性、高致死率的传染病[1],又称鸭病毒性肠炎。在我国广大养鸭地区该病多见于成年种鸭和蛋鸭,主要表现感染鸭软弱、下痢、流泪和部分病鸭出现头颈部肿胀;食道黏膜出血或溃疡,泄殖腔黏膜出血与坏死,肝出血或有坏死灶[2]。目前该病的诊断主要依赖流行病学、临床症状和剖检变化及病毒的分离、鉴定。该病的病原为鸭瘟病毒(Duck plague virus),属疱疹病毒科α疱疹病毒亚科,核酸为线状双股DNA[3]。国内外学者对鸭瘟病毒引起的病理变化和鸭瘟病毒的抗原定位有较多的研究,如Francisco J等[4]较为详细地研究了鸭瘟病毒感染水禽引起的各组织病理变化;Plummer P J等[5]根据UL6段保守区序列并设计引物,进行PCR扩增,得到相应片段;胡薛英等[6]应用单克隆抗体的免疫组织化学法研究雏鸭体内鸭瘟病毒的分布;谢芝勋等[7-8]对鸭瘟病毒核酸进行PCR检测,结果良好。
目前对鸭瘟病毒基因结构及功能的研究比较少,仅报导了部分毒株的UL6,UL7基因,TK基因,聚合酶基因的克隆和测序[9-12]。胸苷激酶(thymidine kinase,TK)基因是疱疹病毒的主要毒力基因和病毒增殖的非必需基因[13],其编码产物胸苷激酶是嘧啶生物合成补救途径中所必需的酶。它可使胸腺嘧啶磷酸化为dTMP,然后继续磷酸化成为dTTP,参于病毒DNA的合成,在神经组织感染及潜伏性感染中具有重要作用[14-15]。研究TK基因的结构及其编码蛋白为进一步研究鸭瘟病毒的致病机理奠定基础。
1 材料与方法
1.1 材料
试验用动物樱桃谷鸭2周龄,购自武汉市畜牧兽医科学研究所,未进行任何免疫接种及药物治疗;DNA病毒基因组提取试剂盒为北京索莱宝科技有限公司产品;PCR反应PremixTaqDNA聚合酶,DNA Marker D L 2 000均为宝生物工程(大连)有限公司产品。
1.2 方法
1.2.1 病料采集和处理 病料采自湖北省武汉市某养鸭场送检20日龄商品代樱桃谷肉鸭,病死率90%。采集送检病鸭的肝组织病料剪碎,按1∶5的比例加入灭菌PBS(0.2mol/L,pH 7.2)匀浆,6 000 r/min离心20min,取上清液,220nm微孔滤膜过滤,用灭菌的PBS稀释20倍后作为接种材料。
1.2.2 鸭瘟病毒TK基因的序列分析
1.2.2.1 病毒DNA的提取 分别取送检死亡鸭的肝脏和空白组剖杀鸭的肝脏,加灭菌PBS于研磨器中研磨,后置于1.5mL中反复冻融3次,6 000 r/min离心15min,取上清液备用。严格按照DNA病毒基因组提取试剂盒说明书操作。
1.2.2.2 引物设计与合成 根据GenBank上发表的DPV序列,使用Primer5.0设计引物,由上海英骏生物技术有限公司合成了如下引物。上游引物:5′-TCACTGCGCGACTCTTGCGAACG-3′;下 游引 物: 5′-ATTAATTGTCATCTCGGTATTGTATT-3′。目的片段为1 077bp,使用前将引物稀释、分装、置-20℃保存备用。
1.2.2.3 PCR扩增 对影响PCR的主要条件进行优化,包括退火温度(50℃~60℃)和引物浓度(0.1μmol/L~0.6μmol/L)。最佳PCR扩增反应体系采用25μL反应量:2×PremixTaqDNA聚合酶12.5μL;上游引物(10mmol/L)1.0μL;下游引物(10mmol/L)1.0μL;模板2.0μL;灭菌超纯水8.5μL;总体积25.0μL。根据梯度PCR扩增结果,目的片段的最适退火温度为50℃,扩增条件为:95℃5min;94℃1min,50℃1min,72℃1min,33个循环;72℃7min;10℃60min。产物于1.0 g/L琼脂糖凝胶中电泳,检测扩增情况。
1.2.2.4 测序与序列分析 纯化回收PCR产物,将回收产物送上海英骏生物技术有限公司测序,使用DNA Star软件将YZH-TK序列与GenBank上已发表的鸭瘟病毒TK基因序列进行比对分析。
1.2.3 动物回归试验 12羽健康雏鸭分为2组,攻毒组6只,每只接种0.2mL病毒稀释液。对照组6只,每只接种0.2mL灭菌的PBS。隔离饲养,观察。待雏鸭死亡时,剖检并记录病变,采取组织病料用100mL/L福尔马林溶液固定,常规石蜡包埋、切片,苏木素-伊红(HE)染色,显微镜观察。取胸腺,2.5mL/L戊二醛溶液固定,备做透射电镜观察。
2 结果
2.1 DEV的PCR鉴定
用设计合成的鸭瘟病毒TK基因核苷酸序列扩增引物,对DPV基因组进行PCR扩增后,电泳显示在1 000bp附近有一条带出现,与预计片段大小(1 077bp)相符(图1)。
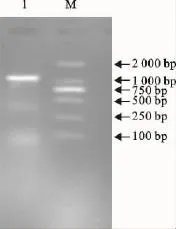
图1 鸭瘟病毒TK基因PCR扩增产物Fig.1 PCR products of duck plague virus TK gene
2.7 鸭瘟病毒TK基因序列的测定分析
所鉴定的病毒与GenBank发表的序列AY963569进行比较,同源性可达到99.16%。与GenBank上已发表的鸭瘟病毒TK基因序列AY911509、EF173464、AY963569、DQ640611 和EF053033鸭瘟病毒UL23序列、人疱疹病毒TK基因序列EU541367、鹑鸡疱疹病毒1型TK基因序列AY741134、猕猴疱疹I型病毒TK基因序列EF426678做遗传进化树分析,结果表明,此次分离到的病毒与已发表的几株鸭瘟病毒TK基因在同一分枝,且同源性均可达到99%,其推导的氨基酸序列同源性均可达96%以上(图2和图3)。
2.1 动物回归试验
2.1.1 临床症状和剖检病变 接种后3d,攻毒组鸭表现流泪,整群雏鸭表现精神沉郁,匍匐,不愿站立。接种后4d到第8天,攻毒组共死亡4羽。剖检死亡鸭可见肝肿大,质脆,表面有弥散性大小不一的出血点和灰白色坏死灶(图4);脾脏极度肿胀,胰腺有白色坏死点;肠道浆膜面可见红色环状出血带,亦可见针尖大小的红色斑点(图5)。法氏囊有出血点。而对照组无异常。
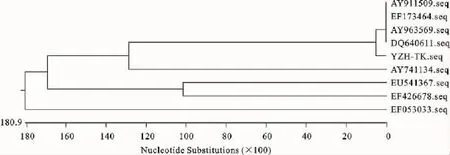
图2 疱疹病毒中TK基因序列编码氨基酸的遗传进化树分析Fig.2 The Phylogenetic tree analysis of deduced amino acid sequenees of TK gene in Alphaherpesvirinae

图3 疱疹病毒中TK基因推导氨基酸的同源性比较Fig.3 Homology comparison of deduced amino acid sequences of TK gene in Alphaherpesvirinae

图4 感染雏鸭的肝脏Fig.4 The liver of infected ducklings
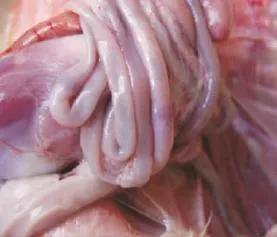
图5 感染雏鸭的肠道Fig.5 The intestine of infected ducklings
2.1.2 组织切片观察 肝脏:感染后肝细胞发生水泡变性、脂肪变性,中央静脉周围有炎性细胞的浸润。坏死灶分布广泛,呈均质红染无结构状,坏死灶中出现异嗜性粒细胞的浸润,并有少量吞噬了异物的巨噬细胞,有出血病变。
十二指肠:黏膜上皮细胞坏死脱落,固有层至肌层可见淋巴滤泡增生,滤泡中的淋巴细胞有排空现象,并出现坏死;黏膜下层表现出血病变(图6)。
食道:黏膜上皮细胞变性、坏死,固有层、黏膜下 层组织有出血和水肿(图7)。
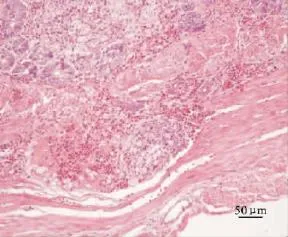
图6 感染雏鸭的肠道(HE)Fig.6 The intestine of infected ducklings

图7 感染雏鸭的食道(HE)Fig.7 The oesophageal of infected ducklings
法氏囊:感染后黏膜上皮细胞脱落,固有层水肿,淋巴滤泡髓质发生凝固性坏死;皮质中淋巴细胞数量急剧减少,网状细胞增多,出现巨噬细胞;固有层发生水肿、出血;严重时,髓质区淋巴滤泡失去固有结构,只剩下一些网状结构和少量淋巴细胞。
2.1.3 电镜观察 接种病毒后7d,可见胸腺中有的细胞内线粒体肿胀,胸腺中有多个坏死细胞,在坏死崩解的细胞中观察到直径100nm~180nm,有囊膜圆形的病毒粒子(图8)。

图8 胸腺中可见病毒粒子Fig.8 The viral particles in thymus
3 讨论
鸭瘟病毒感染造成的病死率和病变有较大的差异。家养鸭感染的总病死率为5%~100%不等。临床临床以急性败血症过程为特征,表现为精神沉郁,两腿麻痹,下痢,流泪和部分病鸭头颈肿大[16]。该病为一种广泛嗜全身性感染的传染病。本试验人工感染病例表现肝脏的肿大、坏死和出血;胸腺,法氏囊,食道黏膜出血等病理变化,与报道的鸭瘟的临床症状,病理变化等相一致[5];在胸腺透射电镜结果中可观察到球形,直径100nm~180nm,有囊膜,圆形的病毒粒子,与报道的鸭瘟病毒粒子的形态相符[17]。因此确诊此次送检的病例为鸭瘟病毒感染。在易感动物体内,病毒在法氏囊、胸腺、脾脏和肝脏的上皮细胞和巨噬细胞内进行增殖[1],因此本研究采样胸腺作为电镜检测病毒的材料。
DPV自然易感宿主仅限于鸭、鹅和天鹅,7日龄到成年种鸭均可感染[1],因此本研究中感染动物主要为雏鸭,雏鸭感染的病理变化呈现出典型的鸭瘟病毒感染的特征[1]。
本试验根据已发表鸭瘟病毒TK基因片段的序列,设计合成引物,利用PCR特异地扩增出1 077 bp片段。将该基因片段的序列与已报道序列比较发现,二者的同源性为99.16%。与GenBank上已发表的鸭瘟病毒TK基因序列AY911509、EF173464、AY963569、DQ640611和 EF053033鸭瘟病毒UL23序列、人疱疹病毒TK基因序列EU541367、鹑鸡疱疹病毒1型TK基因序列AY741134、猕猴疱疹I型病毒TK基因序列EF426678做遗传进化树分析,发现其与AY911509、EF173464、AY963569、DQ640611序列同源性均大99%,氨基酸同源性分别为97.2%、97.6%、97.6%、97.7%。
TK蛋白有2个活性中心,分别是位于N端的ATP结合结构域DGPYGTGK和核苷酸结合结构域DRH。ATP结合结构域代表疱疹病毒TK蛋白的核心序列,它形成了一个疏水的袋状构象,以便与ATP腺嘌呤环结合。而在DPVTK基因的两个活性中心分别位于31位~39位和133位~135位,其中的3个氨基酸残基(G)中的1个发生突变,则会影响TK蛋白的构象及其与APT的结合,导致TK蛋白功能丧失而致弱[18-19]。本研究中根据TK基因序列推导出的核苷酸序列中两个活动中心序列ATP结合结构域和核苷酸结合结构域未发生改变,而其第6位氨基酸由S(Ser)变为F(Phe),从第12开始到22氨基酸序列都发生了改变,这种改变是否会对病毒蛋白翻译和毒力产生影响还有待于进一步研究。
[1] Sandhu T S,Shawky S A.Duck virus enteritis(duck plague)[M]//Saif Y M ,Barnes H J,Glisson J R,et al.Diseases of Poultry.11thed.Ames:Iowa State U-niversity Press,2003:354-363.
[2] 甘孟侯.中国禽病学[M].北京:中国农业出版社,1999.107-119.
[3] 郭玉璞,蒋金书.鸭病[M].北京:北京农业大学出版社,1988:21-28.
[4] Francisco J.Histopathological and ultrastructural changes associated with herpesvirus infection in waterfowl[J].Avian Pathol,2000,31:133-140.
[5] Plummer P J.Detection of duck enteritis virus by polymerase chain reaction[J].Avian Dis,1998,42:554-564.
[6] 胡薛英,谷长勤,程国富,等.应用单克隆抗体的免疫组织化学法研究雏鸭体内鸭瘟病毒的分布[J].中国预防兽医学报,2006,28(3):320-322.
[7] 谢芝勋,谢志勤,刘加波,等.用聚合酶链反应检测鸭瘟病毒的研究[J].中国兽药杂志,2000,34(4):10-12.
[8] 郭宵峰,廖 明,严英华,等.利用PCR检测鸭瘟病毒[J].中国兽医科技,2002,32(4):13-16.
[9] 李昌主,韩先杰,邹 玲,等.鸭瘟病毒AV1221株TK基因的克隆与序列分析[J].青岛农业大学学报:自然科学版,2007,24(3):162-164.
[10] 马秀丽,宋敏训,李玉峰,等.PCR用于鸭瘟病毒诊断的研究[J].中国预防兽医学报,2005,27(5):408-411.
[11] 郭霄峰,廖 明,辛朝安,等.鸭瘟病毒北京株UL6和UL7基因的克隆及序列测定[J].畜牧兽医学报,2002,33(6):615-618.
[12] 王红海,胡薛英,苏敬良,等.商品肉鸭鸭瘟病毒的分离与鉴定[J].中国预防兽医学报,2006,28(1):105-108.
[13] 王 琳,杨润德,陈丽君,等.伪狂犬病病毒冀A株TK基因的克隆及序列分析[J].动物医学进展,2007,28(4):29-33.
[14] 张桂红,童光志,王 柳,等.传染性鼻气管炎病毒TK基因缺失株的构建[J].中国预防兽医学报,1999,21(4):275-277.
[15] 吴德铭,罗满林,黄毓茂,等.伪狂犬病毒粤A毒株TK基因的扩增/克隆与序列测定[J].华南农业大学学报,2002,23(3):71-73.
[16] 许媛媛.鸭瘟的动态病理学研究和鸭CD4的克隆[D].湖北武汉:华中农业大学硕士学位论文,2010.
[17] 郭宇飞,程安春,汪铭书,等.鸭瘟病毒的纯化及电镜负染形态观察[J].中国兽医科学,2008,38(5):393-396.
[18] 刘文波,周 斌,黄 兵,等.传染性喉气管炎病毒烟台株TK基因序列测定及TK蛋白功能初步分析[J].西农林科技大学学报:自然科学版,2005,33(10):75-79.
[19] 宋得华,潘华奇,黎应胜,等.鸭瘟病毒TK基因及其编码蛋白的生物信息学分析[J].安徽农业科学,2007,35(31):9935-9936.

