不同冷冻保护剂和冷冻方法对小鼠耳皮肤成纤维细胞冻存效果的影响
肖 雄,邓玉金,赵海龙,吴有博,李跃民
(西南大学动物科技学院,重庆400715)
耳皮肤成纤维细胞因具有取材方便、易获取、体外增殖能力强、细胞形态结构稳定、较易进行传代培养和不易发生转化等特点,在体细胞核移植、转基因技术、治疗性克隆和诱导性多能干细胞等研究领域具有重要的应用价值。但是,体外培养的细胞,随着传代次数的增加,细胞各种生物学特征会逐渐发生变化,同时,长期传代也会造成资源浪费。因此,在细胞传代过程中,需要适时进行细胞冷冻保存,以保证体外培养细胞的质量,又便于取用。液氮(-196℃)冷冻保存细胞,理论上是无限久的,但由于目前技术局限,冻存时间越长,细胞复苏后存活率越低。因此,细胞在不同冻存温度、不同冻存方法和不同冷冻保护剂下冻存效率存在差异。本试验以DMEM为基础培养液,以二甲基亚砜(dimethyl sulfoxide,DMSO)或甘油(glycerol,GL)作为冷冻保护剂,并添加胎牛血清(fetal bovine serum,FBS)组成冷冻保护液,分别采用4种冷冻降温方法,对体外培养的第3代小鼠耳皮肤成纤维细胞进行冷冻保存。通过比较不同处理组复苏后细胞的存活率和培养48 h后的细胞贴壁率,探讨不同冷冻保存方法和冷冻保护剂对小鼠耳皮肤成纤维细胞解冻复苏后细胞存活率和贴壁率的影响,并对适宜冷冻方法所得小鼠耳皮肤成纤维细胞的生长曲线进行研究,旨在筛选适宜的小鼠耳皮肤成纤维细胞的冷冻保存体系,为小鼠耳皮肤成纤维细胞用于体细胞核移植和重编程为多能干细胞等研究奠定基础。
1 材料与方法
1.1 材料
1.1.1 实验动物 昆明系小鼠,8周龄~10周龄雌鼠,体重23 g~28 g,购于重庆市中药研究所动物研究中心。
1.1.2 主要试剂与仪器 DMEM粉末,Gibco公司产品;DMSO,GL,胰蛋白酶,乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA)Sigma公司、杭州四季青生物工程材料有限公司产品。
CO2培养箱(3111)Thermo Forma公司产品;倒置显微镜(T-DH)Nikon Japan公司产品;超低温冰箱(720)Thermo Electron Corporation公司产品;液氮罐(YDS-30B)成都液氮容器厂生产。
1.2 方法
1.2.1 小鼠耳皮肤组织的获取 颈椎脱臼法处死小鼠,手术刀片剔除耳毛,经酒精消毒,用无菌眼科剪剪取耳朵,称重后,置于加有750 mL/L酒精的玻璃培养皿中浸泡、清洗30 s~40 s后取出,在含有青、链霉素的无Ca2+、Mg2+的磷酸盐缓冲液(phosphate buffered saline,PBS)中清洗3遍后,将耳皮肤组织移入35 mm的玻璃培养皿中备用。
1.2.2 小鼠耳皮肤成纤维细胞的原代培养 将耳皮肤组织块剪碎,用无Ca2+、Mg2+的PBS清洗,弃去上层悬浮组织,加入5 mL 2.5 g/L胰蛋白酶-EDTA,置于37℃的培养箱中消化30 min后取出,加5 mL含血清DMEM培养液终止消化,移液枪反复吹打,经200目不锈钢细胞筛过滤,取滤液于10 mL离心管中,以1 000 r/min离心10 min,弃上清液,再加无Ca2+、Mg2+的 PBS清洗、摇匀,重复离心(1 000 r/min,10 min),弃上清液。调整细胞密度至1×105个/mL,接种于无菌的12.5 cm2培养瓶中,体积分数为5% 的CO2培养箱中,37℃并且饱和湿度条件下进行原代培养。
1.2.3 小鼠耳皮肤成纤维细胞的传代培养 当小鼠耳皮肤成纤维细胞贴壁生长铺满瓶底,达到80%~90%时,采用1.25 g/L胰蛋白酶-EDTA消化,传代培养。
1.2.4 小鼠耳皮肤成纤维细胞的冻存 当培养的第3代小鼠耳皮肤成纤维细胞贴壁生长铺满瓶底,达到80%以上时,弃去培养液,无 Ca2+、Mg2+的PBS清洗两遍,加入1.25g/L胰蛋白酶-EDTA消化至大部分细胞变圆后,采用含血清的DMEM培养液终止消化,将细胞吹散后经1000 r/min离心10 min,弃去上清液,收集细胞,加入DMEM培养液,重复离心,将冷冻保护液重新悬浮细胞加入2 mL细胞冻存管中并标记试验编号和日期等。
以100 mL/L FBS + 100 mL/L DMSO +DMEM 或 100 mL/L FBS + 100 mL/L GL +DMEM作为冷冻保护液,分别采用4种冷冻方法对体外培养第3代小鼠耳皮肤成纤维细胞进行冷冻保存(表1)。

表1 小鼠耳皮肤成纤维细胞的冷冻方法设计Table1 Cryopreservation methods of mouse ear skin fibroblasts
1.2.5 细胞的复苏 细胞经液氮冻存1个月后,从液氮罐中取出冻存管,检查是否有盖子松动(若盖子松动则弃去此样品),迅速投入37℃恒温水浴锅中,并不断摇动冻存管使其迅速解冻。待完全溶化后取出冻存管,用750 mL/L酒精消毒。以完全培养液稀释,将溶液转至10 mL离心管内,以1 000 r/min离心10 min,弃去上清液(冷冻保护液)以减少冷冻保护剂对细胞的毒性作用。
1.2.6 细胞计数和细胞存活率的统计 将小鼠耳皮肤成纤维细胞悬液与4 g/L台盼蓝染液按4∶1的比例混匀,静置2 min,采用血球计数板统计细胞密度和细胞存活率,其中死细胞被染成蓝色,而活细胞不着色。
细胞密度(细胞数/mL)=(四大格的细胞数/4)×10 000×稀释倍数
细胞存活率(%)=[(细胞总数-死细胞数)/细胞总数]×100%
1.2.7 细胞贴壁率的统计 将解冻复苏后的小鼠耳皮肤成纤维悬液进行细胞计数,计为细胞浓度1,然后将细胞接种到12.5 m2培养瓶中培养,48 h后吸弃培养液,无Ca2+、Mg2+的PBS清洗2遍~3遍后,采用1.25 g/L胰蛋白酶-EDTA消化已贴壁细胞,统计细胞密度计为细胞浓度2。
细胞贴壁率(%)=(细胞浓度2/细胞浓度1)×100%。
细胞贴壁率=(48 h后贴壁细胞浓度/接种细胞浓度)×100%
1.2.8 小鼠耳皮肤成纤维细胞的生长曲线绘制采用筛选所得适宜冷冻方法和冷冻保护剂进行小鼠耳皮肤成纤维细胞的冷冻保存。调整解冻复苏后的第3代小鼠耳皮肤成纤维细胞接种浓度为5×104个/mL,接种于24孔培养板中,每孔滴加0.4 mL,即每孔的最初细胞总数约为2×104个,每2 d换液1次。从接种时间算起,每隔24 h用1.25 g/L胰蛋白酶-EDTA消化3孔细胞,用血球计数板分别进行计数,求其平均值,连续进行7 d。以培养时间为横坐标、细胞总数为纵坐标绘制生长曲线。
1.2.9 统计学分析 试验数据以“平均数±标准差”表示,采用SPSS 13.0软件对小鼠耳皮肤成纤维细胞的存活率和贴壁率进行单因素方差分析(One-Way-ANOVA)。
2 结果
2.1 不同冷冻保存方法和冷冻保护剂对小鼠耳皮肤成纤维细胞冷冻-解冻后细胞存活情况的影响
不同冷冻保存方法和冷冻保护剂对小鼠耳皮肤成纤维细胞解冻复苏后细胞存活情况的影响见表2。由表2可知,以100 mL/L DMSO作为冷冻保护剂进行小鼠耳皮肤成纤维细胞的冷冻保存时,方法3处理组的解冻复苏后细胞存活率高于方法2(P>0.05),极显著高于方法1(P<0.01)和方法4处理组(P<0.01)。以100 mL/L GL作为冷冻保护剂进行小鼠耳皮肤成纤维细胞的冷冻保存时,方法3的解冻复苏后细胞存活率高于方法2(P>0.05),并分别极显著高于方法1(P<0.01)和方法4处理组(P<0.01)。在相同方法的情况下,100 mL/L DMSO作为冷冻保护剂处理组的解冻复苏后的细胞存活率均分别高于100 mL/L GL处理组,并且在方法2中表现出极显著的差异(P<0.01)。因此,宜选用100 mL/L DMSO作为冷冻保护剂,采用方法3进行冷冻保存可以获得较高的小鼠耳皮肤成纤维细胞解冻复苏后的细胞存活率。

表2 不同冷冻保存方法和冷冻保护剂对小鼠耳皮肤成纤维细胞冷冻-解冻后细胞存活率(%)的影响Table2 Effect of different cryopreservation methods and cryoprotectants on survival rate(%)of mouse ear skin fibroblasts after being thawed
2.2 不同冷冻保存方法和冷冻保护剂对小鼠耳皮肤成纤维细胞冷冻-解冻后培养48 h细胞贴壁情况的影响
不同冷冻保存方法和冷冻保护剂对小鼠耳皮肤成纤维细胞冷冻-解冻后培养48 h细胞贴壁情况的影响见表3。
由表3可知,以100 mL/L DMSO作为冷冻保护剂进行小鼠耳皮肤成纤维细胞的冷冻保存时,方法3处理组的解冻复苏后培养48 h细胞贴壁率与方法2无显著性差异(P>0.05),但极显著高于方法1和方法4处理组(P<0.01)。以100 mL/L GL作为冷冻保护剂时,方法3处理组的解冻复苏后培养48 h细胞贴壁率极显著地高于其他各处理组(P<0.01)。就同一种冷冻方法而言,100 mL/L DMSO作为冷冻剂处理组的解冻复苏后培养48 h细胞贴壁率均高于100 mL/L GL处理组,且在方法2中表现出极显著差异(P<0.01),在方法3中表现出显著性差异(P<0.05)。因此,宜选用100 mL/L DMSO作为冷冻保护剂,采用方法3进行冷冻保存可以获得较高的小鼠耳皮肤成纤维细胞解冻复苏后培养48 h细胞贴壁率。

表3 不同冷冻保存方法和冷冻保护剂对小鼠耳皮肤成纤维细胞解冻复苏后培养48 h细胞贴壁率(%)的影响Table3 Effect of different cryopreservation methods and cryoprotectants on adhesive rate(%)of mouse ear skin fibroblasts after being thawed and cultured for 48 h
2.3 小鼠耳皮肤成纤维细胞的生长曲线
小鼠耳皮肤成纤维细胞的生长曲线见图1。图1表明,培养1 d~2 d为小鼠耳皮肤成纤维细胞培养的潜伏期,3 d~4 d为对数生长期,第5 d后细胞数量开始减少,为平台期和衰退期。冷冻解冻后的细胞呈现正常的分裂增殖生长模式,这表明以100 mL/L DMSO作为冷冻剂,采用方法3进行冷冻保存对小鼠耳皮肤成纤维细胞后续生长影响较小。
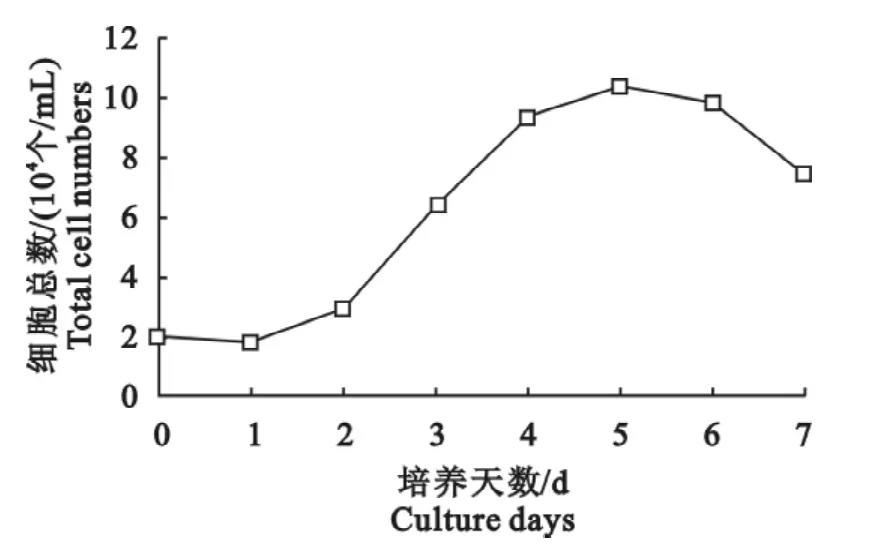
图1 小鼠耳皮肤成纤维细胞的生长曲线Fig.1 The growth curve of the mouse ear skin fibroblasts
3 讨论
3.1 不同冷冻保护剂对耳皮肤成纤维细胞冷冻效果的影响
冷冻保护剂是指通过稀释溶液中的溶质浓度,减少冷冻和解冻过程中对细胞造成的损伤(如细胞内结冰、脱水、溶质浓度提高和蛋白质变性及骨架结构的损伤等)的某一类化合物[1]。50多年前,英国的一个研究小组在一次试验中偶然发现了对精子和人红细胞的有效冷冻保护剂之后[2],相继出现了二甲基亚砜(DMSO)、乙二醇(ethylene glycol,EG)和甘油(GL)等其他冷冻保护剂,其最重要的特点是能够稳定渗入细胞,且在浓度为1 mol/L左右时对细胞相对无毒,其保护功能的基本机制是在降温过程中透过细胞膜进入细胞内,使得细胞皱缩程度降低[3]。另外,葡聚糖、聚乙烯吡咯烷酮、羟乙基淀粉、聚乙二醇以及蔗糖等非渗透性冷冻保护剂的功能在于加快溶液的玻璃化,稳定蛋白质和细胞膜,以及防止进一步的结冰[4]。
目前多采用DMSO、GL或EG等作为细胞冻存的冷冻保护剂。这几种物质分子量小,溶解度大,易穿透细胞膜,降低冰点以减少冷冻保护剂对细胞的毒性作用。王红梅等[5]采用DMSO作为冷冻保护剂的效果好于EG,使用DMSO细胞存活率达到70%~90%,而EG只有30%~50%。任芳丽等[6]研究表明200 mL/L DMSO保护液对牛皮肤成纤维细胞的冻存保护效果好于其它浓度的DMSO、EG及GL,复苏后平均贴壁率达到87.9%。赵雪萍等[7]比较了DMSO、GL和EG 3种冷冻保护剂对麋鹿耳皮肤成纤维细胞的冷冻保存效果,结果表明添加100 mL/L DMSO的冻存液效果最佳,解冻后细胞贴壁率达87.78%。王亮等[8]采用200 mL/L FBS+100 mL/L DMSO+70%细胞悬液对奶牛耳皮肤成纤维细胞进行冻存,复苏后细胞存活率达到86.68%,培养48 h贴壁率为86.40%。周向梅等[9]以100 mL/L DMSO+900 mL/L FBS为冷冻保护液冷冻保存第3代矮马耳缘组织成纤维细胞,复苏后存活率达92.2%。本试验以100 mL/L FBS+100 mL/L DMSO+ DMEM 作为冷冻保护液,得到最高的细胞存活率为84.88%,培养48h后的细胞贴壁率为 81.00%;以 100 mL/L FBS+100 mL/L GL+DMEM作为冷冻保护液,得到最高的细胞存活率为71.65%,培养48 h后的细胞贴壁率为67.03%。较 100 mL/L GL 相 比,100 mL/L DMSO作为冷冻保护剂效果更佳。但是,由于DMSO、GL和EG是一种有毒的化学物质,高浓度下作为冻存保护剂也会对细胞造成损伤,将DMSO提前4℃预冷,有利于降低其对细胞的毒性损害[8]。近年来,一些学者研发出了新型冷冻保护剂,如抗冻蛋白、乙酞胺、海藻糖、植物类抗冻因子等,这些冻存保护剂在低浓度时对细胞有较好的保护效果。
3.2 不同冷冻保存方法对耳皮肤成纤维细胞冷冻效果的影响
细胞冷冻效果受冷冻速率的影响。常规冷冻法下,若冷冻速率过快,则易形成胞内冰晶,这些细胞内冰晶在温度回升过程中会发生再结晶而导致细胞受损;如果降温速率过慢,则细胞收缩过剧烈,并且细胞处在高浓度溶液中也会引起损伤。本试验中,采用方法3的效果好于其他几种方法,这可能与小鼠耳皮肤成纤维细胞悬挂在液氮罐内的气态氮中4 h,使细胞内水分充分外渗又不完全脱干,从而减少冰晶形成,降低对细胞的损伤有关。气态氮处理的方法在其他动物细胞冷冻上也有使用,如陆会宁等[10]将冻存管在4℃冰箱中放置30 min~1 h后,在液氮面过夜,次日放入液氮罐中保存,解冻后贵德黑裘皮羊耳成纤维细胞存活力为93.16%,24 h后的贴壁率为85%;赵雪萍等[7]将冻存管在4℃放置30 min,移入-20℃放置1.5 h,再在液氮面上方悬吊7 h~8 h后投入液氮,解冻后麋鹿耳皮肤成纤维细胞贴壁率达87.78%。本试验中,方法1和方法2虽经过预冷平衡,控制了降温速率,但可能其速率仍会导致细胞内冰晶形成,从而使细胞复苏后存活率和贴壁率低于方法3。陈华等[11]比较了3种冷冻方法对波尔山羊成纤维细胞冻存效果的影响,结果表明方法3(4℃平衡1 h、-80℃过夜,然后投入液氮)冷冻细胞解冻后得细胞贴壁率为61.6%,明显优于方法1(4℃平衡1 h,-20℃冷冻6 h,直接投入液氮)和方法2(4℃平衡1 h,-20℃冷冻6 h,-80℃过夜,直接投入液氮),并认为-20℃不利于细胞保存,推测可能是由于-20℃左右是细胞冷藏的危险区域,且易发生低温损伤,建议细胞在此阶段不宜停留时间过长。许丹娜等[12]采用将冻存管在4℃下平衡30 min后置于-80℃超低温冰箱过夜,第2天投入液氮的方法对食蟹猴成纤维细胞进行冻存,解冻后第7代细胞的存活率达95.15%。关伟军等[13]将冻存管放入装有异丙醇的冷冻盒中,于-70℃冰箱中过夜,第2天放入液氮罐中保存,小尾寒羊耳组织成纤维细胞复苏后的存活率达94.7%。马月辉等[14]采用同样的方法冷冻保存矮马耳缘组织成纤维细胞,复苏后存活率达92.2%。但是,李忠秋等[15]采用4℃平衡40 min,在-20℃冷冻2 h,在-70℃过夜,次日投入液氮保存种公牛耳组织成纤维细胞,细胞复苏后的存活率也高达93.7%。因此,-20℃冷冻处理对细胞是否具有很大的损伤作用还有待进一步的研究。另外,本试验中,采用方法4得到的细胞存活率、贴壁率显著偏低,可能原因是降温速率过快,形成胞内冰晶,这些细胞内冰晶在温度回升过程中会发生再结晶而导致细胞受损。
因此,宜采用100 mL/L DMSO冷冻保护剂,经4℃预冷平衡0.5 h,接着悬挂在液氮罐内的气态氮中4 h,然后沉入液氮的方法冻存小鼠耳皮肤成纤维细胞。
[1]郭 娟.牛卵母细胞玻璃化冷冻保存的研究[D].新疆乌鲁木齐:新疆农业大学,2009.
[2]Rapatz G,Nath J,Luyet B.Electron microscope study of erythrocytes in rapidly frozen mammalian blood[J].Biodynamica,1963,9:83-94.
[3]Woods E J,Zieger M A,Gao D Y,et al.Equations for obtaining melting points for the ternary system ethylene glycol/sodium chloride/water and their application to cryopreservation[J].Cryobiology,1999,38(4):403-407.
[4]高大勇,丁力行,吕金虎,等.细胞冷冻保存的最佳降温速率及其影响因素[J].仲恺农业技术学院学报,2007,20(3):54-59.
[5]王红梅,黄俊成,刘明军,等.利用动物耳皮肤组织培养耳成纤维细胞的研究[J].草食家畜,2001(S2):210-214.
[6]任芳丽,李 煌,张 涌.牛皮肤成纤维细胞的体外培养与冻存[J].黄牛杂志,2002,28(1):8-10.
[7]赵雪萍,张寒莹,王子玉,等.麋鹿耳皮肤成纤维细胞的分离培养与核型分析[J].南京农业大学学报,2008,31(1):67-71.
[8]王 亮,刘婷婷,彭 涛,等.荷斯坦奶牛耳组织成纤维细胞分离培养及冷冻保存方法研究[J].黑龙江畜牧兽医,2006,5:9-12.
[9]周向梅,马月辉,关伟军,等.云南矮马耳缘组织成纤维细胞系的建立及其生物学特性[J].动物学报,2004,50(5):863-868.
[10]陆会宁,刘丑生,王志刚.贵德黑裘皮羊耳成纤维细胞系的建立和生物学特性的研究[J].中国草食动物,2007,27(2):3-6.
[11]陈 华,朱必龙,章孝荣.波尔山羊耳成纤维细胞的分离培养与保存[J].黑龙江动物繁殖,2007,15(3):7-10.
[12]许丹娜,许惠艳,凌泽继,等.食蟹猴耳部成纤维细胞体外培养体系的初步建立[J].安徽农业大学学报,2009,36(3):469-475.
[13]关伟军,马月辉,丁 鸿,等.小尾寒羊耳组织成纤维细胞系的建立与生物学特性研究[J].畜牧兽医学报,2005,36(5):511-516.
[14]马月辉,周向梅,关伟军,等.用胶原酶消化法培养德保矮马耳缘组织成纤维细胞初探[J].中国农业科学,2005,38(6):1282-1288.
[15]李忠秋,马 红,郭镇华,等.种公牛耳组织成纤维细胞的分离与培养[J].中国兽医杂志,2010,46(2):18-20.

