化学平衡教学中的两个误区
高盘良
(北京大学化学与分子工程学院 北京 100871)
化学平衡是物理化学教学中的重要内容,有的教科书关于化学平衡的表述存在一些模糊说法,有的教师也提出过类似的问题,现在把两个典型的问题提出来与同行讨论。
1 化学反应一定存在化学平衡吗?
有学生反映:化学反应一定存在化学平衡,并且从来没有听说达不到化学平衡的反应。据说这个结论来自教师讲课。果真如此吗?为了回答这个问题,先举例[1]说明如下。
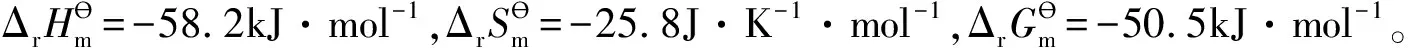
(1)

那么不存在化学平衡的反应是否仅是个例呢?答案是否定的。忻新泉教授早在1994年就给出“固相化学无平衡”[2-3]的结论,即无论是无机还是有机固相反应,其中有的不存在化学平衡,只要反应中无气体物质参加的纯凝聚相的固-固或固-液反应,ΔrGm<0(≠0),反应一旦发生,便可以一直维持到反应进行到底,使反应物为化学计量比时全部转化为产物。其后又有一些化学家发表了相当多的论文,揭示了无化学平衡的化学反应,尤其以Kaupp教授的研究[4]最为典型,他在研究了25类1000多个有机固相反应的基础上,提出了100%收率的结论,即不存在反应限度的无化学平衡的反应。
由此可将T、p一定、无有用功时的化学反应分为两类,并示于图1。
第一类:ΔrGm<0及ΔrGm≠0,有方向、无限度,不存在化学平衡,如图1中反应R1。存在相平衡,遵守相律。这类反应在合成化学中有广阔的应用前景,并受到重视。
第二类:ΔrGm=0,有方向、有限度,存在化学平衡,如图1的反应R2。这类反应在教科书中已有详细的讨论,故不细述。
因此,“化学反应一定存在化学平衡”的说法是片面的,不符合实际的。

图1 化学反应的G-ξ图
2 化学平衡时,“反应物的化学势等于生成物的化学势”这种说法对吗?
这个问题早在20世纪80年代就讨论过[5-6],现在又出现在物化教材及教学中,因此仍有必要讨论。
化学平衡时,T、p一定、无有用功时的化学反应0=∑νBB,化学平衡时可得:
(2)
有人把ΔrGm=0错误地理解成ΔrGm=G产物-G反应物=0,在物化教科书或课堂上讲成“产物的Gibbs自由能等于反应物的Gibbs自由能”,更有甚者讲成“反应物的化学势等于生成物的化学势”[5]。以上说法有许多概念性错误[6],为此可结合图2进行讨论。
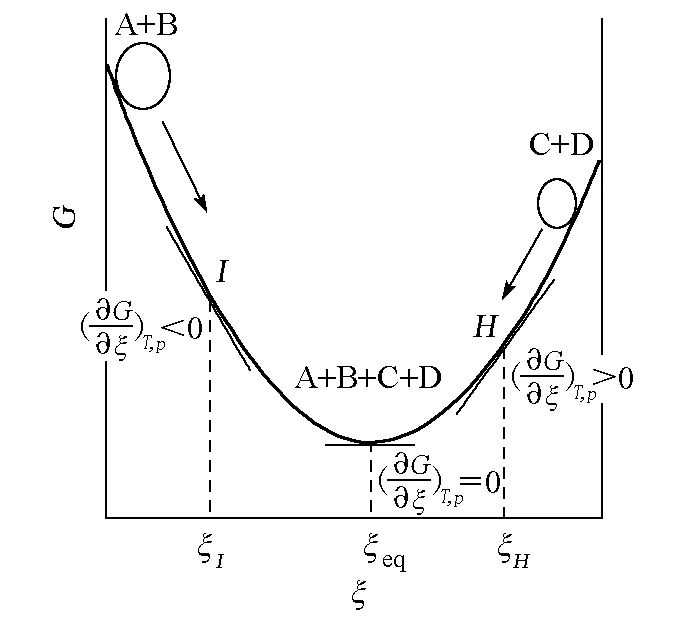
图2 (∂G/∂ξ)T,p示意图[8]
首先是对化学势概念理解错误。所谓化学势一般是指在多组分体系中某一个组分的化学势,且不知绝对值;不同组分的化学势不能比较,由于是强度量,不同组分的化学势不能加和,因此一切以体系化学势为基础的论点都是错误的。
有人认为如把化学反应方程式中量纲为1的计量数νB当成量纲为摩尔的物质的量来处理,则平衡时∑νBμB=G生成物-G反应物=0,岂不是“产物的Gibbs自由能等于反应物的Gibbs自由能”了吗?首先,物理量的量纲是不能任意人为改变的,故该式不成立。这里还存在一个概念性的错误,即ΔG与ΔrGm的区别[1,8]。ΔG是化学反应体系的终态Gibbs自由能Gf与始态Gibbs自由能Gi的差值,即ΔG=Gf-Gi,其量纲为J。而ΔrGm是G-ξ曲线上某一点的切线斜率,是偏摩尔反应Gibbs自由能变,其量纲是J·mol-1[1,7]。
如对于理想气体反应0=∑νBB,不难推导出:
ΔG-ξiΔrGm,ξi=RT∑nB,0ln(pB,ξi/pB,ξ0)
(3)
当为反应始态,即ξi=ξ0=0,ΔG(ξ=ξ0)=0,上式即为 0-0×ΔrGm,ξ0=0,从G-ξ曲线上始态时, ΔrGm,ξ0≠0,ΔrGm,ξ0与ΔG(ξ=ξ0)的差异就显现出来了。
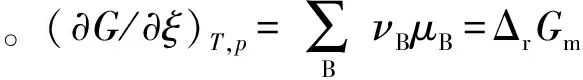
物理化学教学要做到“常教常新、常教常精”。“新”是指将新的学术思想、内容、方法及应用等及时纳入教学,以适应科学技术发展的需要;“精”则是在融会贯通教学内容的基础上,挑选最基本的内容、方法及典型应用充实教材。以上讨论的两个问题都是物化教学的基本内容,而又在部分教师中存在模糊认识,希望能通过讨论提高教学内容的科学性。
参 考 文 献
[1] 韩德刚,高执棣,高盘良.物理化学.第2版.北京:高等教育出版社,2009
[2] 忻新泉,郑丽敏.大学化学,1994,9(6):1
[3] 忻新泉,周益明,牛云垠.低热固相化学反应.北京:高等教育出版社,2010
[4] Kaupp G.TopCurrChem,2005,254:95
[5] 褚德莹.化学通报,1981(7):64
[6] 杨永华.化学通报,1984(3):59
[7] 高执棣.大学化学,1987,2(2):48
[8] 朱志昂,阮文娟.近代物理化学(下册).第4版.北京:科学出版社,2008
——以匀加速直线运动公式为例

