Gaussian软件在环境化学教学中的应用*
裴克梅
(浙江理工大学化学系 浙江杭州 310018)
环境化学是在化学科学的传统理论和方法基础上发展起来的,主要研究化学物质在环境介质中的存在、化学特性、行为和效应及其控制的一门学科[1]。当前,环境化学已经发展成为应用化学、环境科学及相关专业本科生和研究生的一门基础课程。由于环境问题的重要性,该学科发展迅速,知识更新速度很快,导致环境化学课程的理论和实验教学目前没有统一的体系和大纲。因此在强调基础知识的同时向学生介绍一些反映该学科基本理论或前沿的计算方法,有利于培养学生将理论知识用于处理实际问题的能力,进而取得良好的教学效果[2-4]。
Gaussian03是做半经验计算和从头计算使用最广泛的量子化学软件,可以研究分子能量和结构、过渡态的能量和结构化学键以及反应能量、分子轨道、偶极矩和多极矩、原子电荷和电势、振动频率、红外和拉曼光谱、NMR、极化率和超极化率、热力学性质、反应路径等。GaussView是Gaussian03的图形用户界面,可以直接设置和提交计算任务,并且能以图形界面显示计算结果,所以很受化学教育者的青睐。实践表明:让Gaussian软件走进环境化学课程,可使教学内容从抽象到直观、从复杂变得简单,有助于增强学生学习的积极性,提高教学质量和教学效果,使学生更快、更好地从本质上掌握知识。下面结合环境化学课程的教学特点,介绍Gaussian软件在辅助教学方面的一些应用。
1 有机污染物的紫外光谱模拟
大多数有机环境污染物在紫外区域都有很强的吸收,因此紫外吸收光谱的测定是了解和研究环境污染物的重要手段之一[5]。大多数环境科学专业或应用化学专业的学生都会用实验的方法测定紫外吸收光谱,但是对紫外光谱的实质或者不通过实验获取紫外光谱性质的方法了解很不充分。Gaussian03可以准确地预测紫外吸收的位置、强度以及相关电子跃迁的轨道,而GaussView则可以直观地显示目标紫外吸收带跃迁轨道的本质。图1为实验测定的硝基苯紫外吸收光谱图。表1为TD DFT(B3LYP/6-311g(d,p))方法计算得到的硝基苯紫外吸收带、强度及跃迁轨道的结果。图2为GaussView显示的跃迁最强吸收带对应的分子轨道信息。图1、图2和表1表明:硝基苯处于267nm处的紫外吸收带是由于分子从基态到第4激发态跃迁引起的吸收,实质是由于苯环上π键与硝基上的π反键轨道引起的。

图1 200~400nm范围内硝基苯的紫外吸收光谱

表1 TD B3LYP/6-311g(d,p)方法计算得到的硝基苯紫外吸收带、强度及跃迁轨道

图2 267nm吸收带相关的跃迁分子轨道31和33
2 二次有机气溶胶形成的化学过程
二次有机气溶胶是大气光化学反应的产物,也是大气中细粒子的主要成分[6]。由于二次有机气溶胶对环境、气候和人体健康的影响严重,正受到日益关注。甲苯是大气中最丰富的芳香族碳氢化合物之一,也是形成有毒二次有机气溶胶最重要的来源之一。OH自由基是大气中最重要的一种氧化剂,对流层大气中几乎所有的可被氧化的痕量气体主要是通过与OH自由基反应而被转化和去除的。对许多重要化合物而言,与OH自由基的反应是它们降解的决速步, 因此OH自由基的浓度决定了它们在对流层中的大气寿命。在OH自由基与甲苯的反应过程中,仅有少量OH自由基能从甲苯中提取氢原子,大部分OH自由基能够加成到芳香环上,正是OH自由基和甲苯的加成反应对甲苯的光氧化过程和它们的后续反应有很大的影响。为了深入了解OH自由基与甲苯加成同分异构体的结构和动力学参数,Suh等对OH自由基和甲苯加成反应进行了量子化学计算研究[7]。研究结果表明:用密度函数理论方法来研究OH自由基和甲苯加成反应,可以得到反应能量以及反应速率常数,这些结果与实验数据基本一致。当OH自由基分别被加成到甲苯的4个不同的位置(ortho、para、meta以及ipso)时,将形成4种OH自由基和甲苯加成的同分异构物,它们的反应分支比分别为0.52、0.34、0.11和0.03。综上所述,甲苯与OH自由基反应后的主要产物为邻位加成产物,而邻位加成产物与O2反应生成甲酚,甲酚继续与大气中其他物质结合形成二次气溶胶。
3 酸解离常数pKa的量子化学计算
酸离解常数pKa是各种弱酸的重要参数,在酸碱平衡计算中有许多具体应用。已有研究表明[8-9],XOm(OH)n型化合物水溶液中酸离解常数取决于X—O和O—H这2个键上的键电荷密度比f:
f=ρ(O—H)/ρ(X—O)
f>1时为碱性,其值越大,碱性越强;f<1时为酸性,其值越小,酸性越强。因此可以通过计算分子f值的大小来判断化合物酸碱性的强弱。本文以文献[10]中关于苯氧乙酸类的研究结果为例(图3)。表2为利用量子化学计算方法CNDO/2计算所得的苯氧乙酸分子中羧基的键电荷密度比f和pKa实验值。
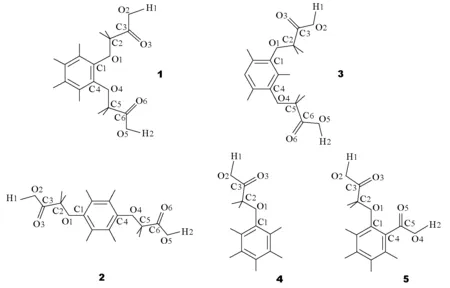
图3 5种苯氧乙酸类物质的计算模型结构

表2 苯氧乙酸类分子中羧基的键电荷密度比f和pKa实验值
表2中f表示—COOH中的C—O单键和O—H键之间的相对强弱,该值越小,O—H键越弱、C—O单键越强,则越易离解出质子,pKa也就越小。对于含2个或2个以上羧基的化合物来说,应该是f最小的羧基优先离解并决定其一级酸离解常数的大小。从表2可以看出,化合物1~5的一级酸离解常数对应的f分别为0.85446、0.85352、0.85268、O.84839和0.82977,这与表2中的pKa实验值的大小顺序是完全相同的。以上分析表明,由量子化学计算得到的f可以作为比较苯氧乙酸类化合物酸性强弱的判据。此外,化合物5中的羧甲氧基和羧基的f分别为0.82977和0.85631,这说明羧甲氧基比羧基更易离解,其酸性强于苯甲酸,这与电子效应的解释相符,也与测定结果完全一致。因此f可以作为定性分析分子酸性强弱的参数之一。通过这个示例,学生不仅能学会利用计算的方法判断分子酸性强弱,而且能更深入理解酸离解常数pKa的意义及影响因素。
参 考 文 献
[1] 邓南圣,吴峰.环境化学教程.武汉:武汉大学出版社,2006
[2] 杨小弟,崔世海.大学化学,2005,20(1):35
[3] 谢惠定,郭蕴苹,黄燕.光谱实验室,2010,27(1):55
[4] 刘晓东,胡宗球.大学化学,2006,21(5):34
[5] 郝瑞霞.用紫外光谱参数表征污水中溶解性有机污染物.中国科学院上海冶金研究所博士论文,2000
[6] 王振亚,郝立庆,张为俊.化学进展,2005,17(4):732
[7] Suh I,Zhang D,Zhang R,etal.ChemPhysLett,2002,363:454
[8] Pauling L.The Nature of the Chemical Bond.London:Oxford University Press,1960
[9] 徐光宪,吴瑾光.北京大学学报(自然科学版),1956(4):489
[10] 张剑锋,胡岳华,王淀佐,等.应用化学,2004,21(8):766

