尖晶石型Cu0.6Ni0.4Al2O4粉体的制备及其可见光性能
刘 楠, 姜 妍 彦, 刁 云 超, 周 凤 霞
( 大连工业大学 纺织与材料工程学院, 辽宁 大连 116034 )
0 引 言
随着工业的不断发展,工业废水越来越多且成分复杂。废水中的染料主要来源于纺织品工业和染料工业,如今50%~70%的市售染料都是偶氮类化合物,且大多数偶氮染料不能用生物降解法降解[1-2]。多相光催化是一种较理想的废水处理方法,广泛应用于废水处理[3]。自1972年日本东京大学(University of Tokyo)教授Fujishima和Honda发现TiO2可以光解水制氢以来,国际上掀起了半导体光催化的研究热潮[4-6]。光催化不仅可以将太阳光能转化为化学能、电能,同时还可以直接利用太阳光降解矿化水和空气中的各种污染物,所以它在环境净化和新能源开发方面具有可观的发展前景。
最近30年,TiO2被视为最优秀的光催化剂而广泛应用于有机染料的氧化降解,然而由于其禁带宽度较大(3.2 eV),只能在紫外光照射下表现出优异的光催化活性,而紫外光仅占太阳光总能量的4%[7]。为了充分利用占太阳光能43%的可见光和大量人工光源,研发高性能可见光响应型光催化剂是十分必要的。尖晶石类化合物是一种重要的功能材料,具有较窄的禁带宽度、较高的稳定性、高熔点等特点,已被广泛应用于磁性材料、颜料、电极材料以及耐火材料[8-10],但在光催化性能方面的研究还很少。本实验利用溶胶-凝胶法制备了Ni掺杂尖晶石型Cu0.6Ni0.4Al2O4纳米粉体,以有机染料活性艳红K-2G作为模拟降解液,对Cu0.6Ni0.4Al2O4的可见光催化活性进行了研究,探讨了催化剂用量和光照时间等因素对光催化降解反应的影响。
1 实 验
1.1 Cu0.6Ni0.4Al2O4光催化剂的制备
将Cu(NO3)2·3H2O、Ni(NO3)2·6H2O和Al(NO3)3·9H2O(均为AR级)按照0.6∶0.4∶2的摩尔比称取,然后溶于一定量的去离子水中,将柠檬酸按照与溶液中阳离子(Cu2+、Ni2+、Al3+)为2∶1的摩尔比称取并溶于去离子水中配置成溶液,然后将其缓慢加入到上述硝酸盐的混合溶液中,并在50~70 ℃下搅拌30 min后,加入氨水调节溶液pH至2.5左右,持续搅拌一定时间直至形成凝胶。将其置入130 ℃恒温干燥得干凝胶,于800 ℃下热处理(保温3 h)得到Cu0.6Ni0.4Al2O4粉体。
1.2 性能测试
采用日本理学D/max-3B 型X射线衍射仪(X ray diffraction, XRD)对粉体进行分析,确定其晶相结构。测试条件:Cu Kα辐射,连续扫描,速度为 4°/min,λ=1.540 6 nm。利用JEOL-JEM-1200EX型透射电镜(transmission electron microscope, TEM)观测样品的表面形貌及颗粒尺寸。利用Perkin-Elmer 650-B型紫外-可见分光光度计测定Cu0.6Ni0.4Al2O4粉体的紫外-可见漫反射吸收光谱和监测活性艳红K-2G水溶液光催化降解前后在可见区513 nm处的吸收度变化,用以表征有机物的降解程度。
1.3 光催化降解实验
取50 mL活性艳红K-2G水溶液(质量浓度为10 mg/L),向其中加入一定量的Cu0.6Ni0.4Al2O4光催化剂,在125 W自镇流荧光高压汞灯(λ>400 nm,上海飞利浦亚明照明有限公司)下照射一定时间后取样,然后取上层清液离心沉降并过滤后测其吸光度,并计算脱色降解率。用商用P-25(TiO2)粉作对照降解实验。
D=[(A0-A)/A0]×100%
式中,D为脱色降解率,%;A0、A分别为有机物原溶液及光照一定时间后溶液的吸光度。
2 结果与讨论
2.1 Cu0.6Ni0.4Al2O4晶体结构与形貌分析
图1为Cu0.6Ni0.4Al2O4粉体的XRD谱图,其衍射峰与CuAl2O4的标准谱图(PDF卡号为:330448)的衍射峰相吻合,表明材料中Ni2+的掺入只是取代了基质中部分Cu2+的晶格位置,并没有改变基质的尖晶石晶体结构,属立方晶系,Fd3m空间群。由XRD数据,根据Scherrer公式计算粉体的平均晶粒尺寸。
Dhkl=kλ/Bhklcosθ
式中,Dhkl为垂直于晶面(hkl)的平均晶粒尺寸,nm;Bhkl为衍射峰的半高宽,nm;k为常数(通常取0.89);λ为X射线的波长,nm;θ为相应的衍射峰所对应的衍射角的一半。由公式计算出Cu0.6Ni0.4Al2O4在垂直于(311)晶面的平均粒径尺寸约为25.49 nm。
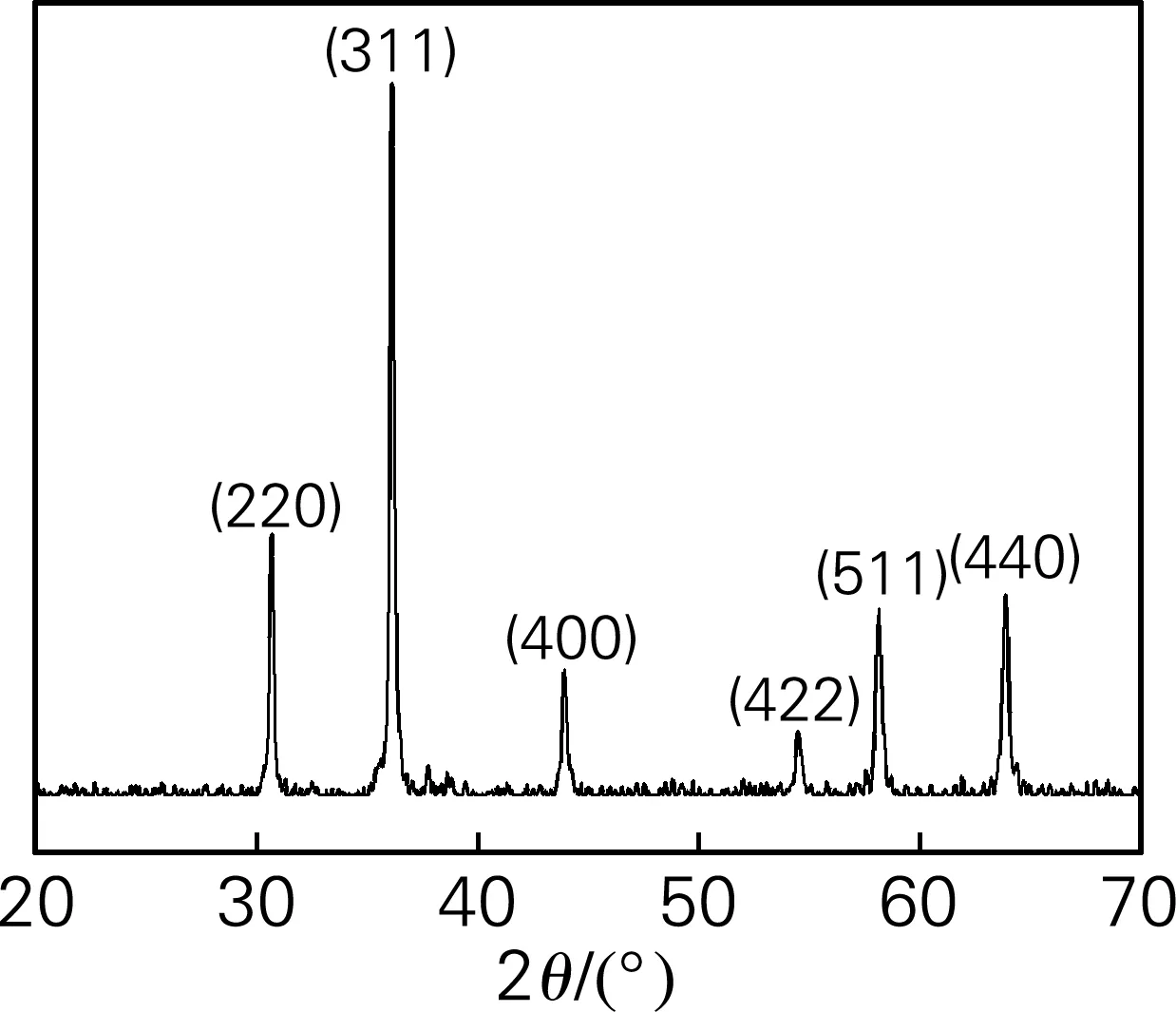
图1 样品的XRD谱图
图2为800 ℃保温3 h热处理的Cu0.6Ni0.4Al2O4粉体的TEM照片。由图2可知,Cu0.6Ni0.4Al2O4粉体呈无规则颗粒状,从图像的边缘隐约可见颗粒尺寸非常细小,由于表面效应,其比表面能非常大,导致粉体发生严重的团聚,正如电镜照片所见,呈一团团的簇状。

图2 Cu0.6Ni0.4Al2O4粉体的TEM照片
2.2 紫外-可见漫反射吸收光谱
图3为尖晶石型Cu0.6Ni0.4Al2O4粉体的紫外-可见漫反射吸收光谱图。由图3可以看出,尖晶石型纳米Cu0.6Ni0.4Al2O4催化剂除在紫外区有较大吸收外,在可见光区450~550 nm仍然有较大的吸收,并且吸收极限波长红移至782 nm。根据吸收极限波长λ0与禁带宽度Eg的计算公式:
Eg=hc/λ0=1 240/λ0
式中,h为Planck常数;c为光速;λ0为波长,nm。可以计算出Cu0.6Ni0.4Al2O4的禁带宽度Eg为1.59 eV,而P-25的吸收极限波长为390 nm,对应的禁带宽度为3.18 eV。
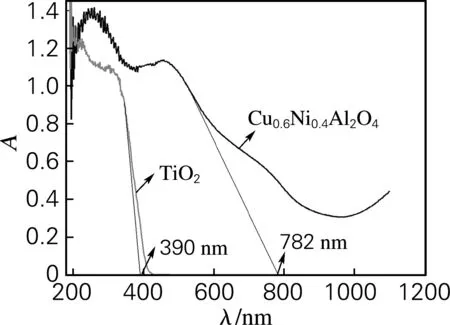
图3 Cu0.6Ni0.4Al2O4和P-25(TiO2)粉体的紫外-可见漫反射吸收光谱
Fig.3 Ultraviolet-visible diffuse reflectance absorption spectrum of Cu0.6Ni0.4Al2O4and TiO2powders
2.3 Cu0.6Ni0.4Al2O4催化剂的光催化性能
2.3.1 有机染料的光催化降解
偶氮染料活性艳红K-2G在有催化剂体系和无催化剂体系中的降解脱色效果如图4所示,实验条件:光源为125 W自镇流高压汞灯,活性艳红K-2G染液50 mL(质量浓度为10 mg/L),催化剂用量为100 mg/L。观察图4可知,在可见光照射下,60 min内染液脱色率急剧上升,90 min 脱色率达到94.7%,120 min脱色率高达99%,较同条件下制备的纯CuAl2O4的120 min脱色率(81.4%)更高,表现出了优异的可见光催化活性;而TiO2光催化剂在可见光下照射下,染液的脱色率上升趋势比较缓慢,光照射90 min染液脱色率为9.4%,光照120 min时,染液的脱色率仍不到10%;在相同光照条件下,没有光催化剂的体系中,活性艳红染液没有脱色效果。根据光催化机理可知,只有当照射光的光子能量大于或等于光催化剂的带隙能时,价带上的电子才会被激发跃迁至导带,在价带上留下相应的空穴,产生电子-空穴对,与表面吸附水反应,从而产生大量的羟基自由基(·OH),利用羟基自由基(·OH) 和光生空穴超强的氧化能力,实现降解染液的目的。由图3可知,尖晶石型Cu0.6Ni0.4Al2O4粉体的极限吸收波长为782 nm,能够充分利用可见光,当用125 W自镇流高压汞灯照射时,Cu0.6Ni0.4Al2O4催化剂能够吸收的光子,产生大量光生电子-空穴对和羟基自由基(·OH),氧化降解活性艳红,因此2 h内染液脱色率达到99%。而TiO2的光吸收范围只在紫外区,很难利用可见光能量,在可见光照射下,虽然对染液有一定的脱色效果,但从光照90~120 min脱色率基本保持恒定,推测可能是由于催化剂颗粒细小,出现表面吸附所致。
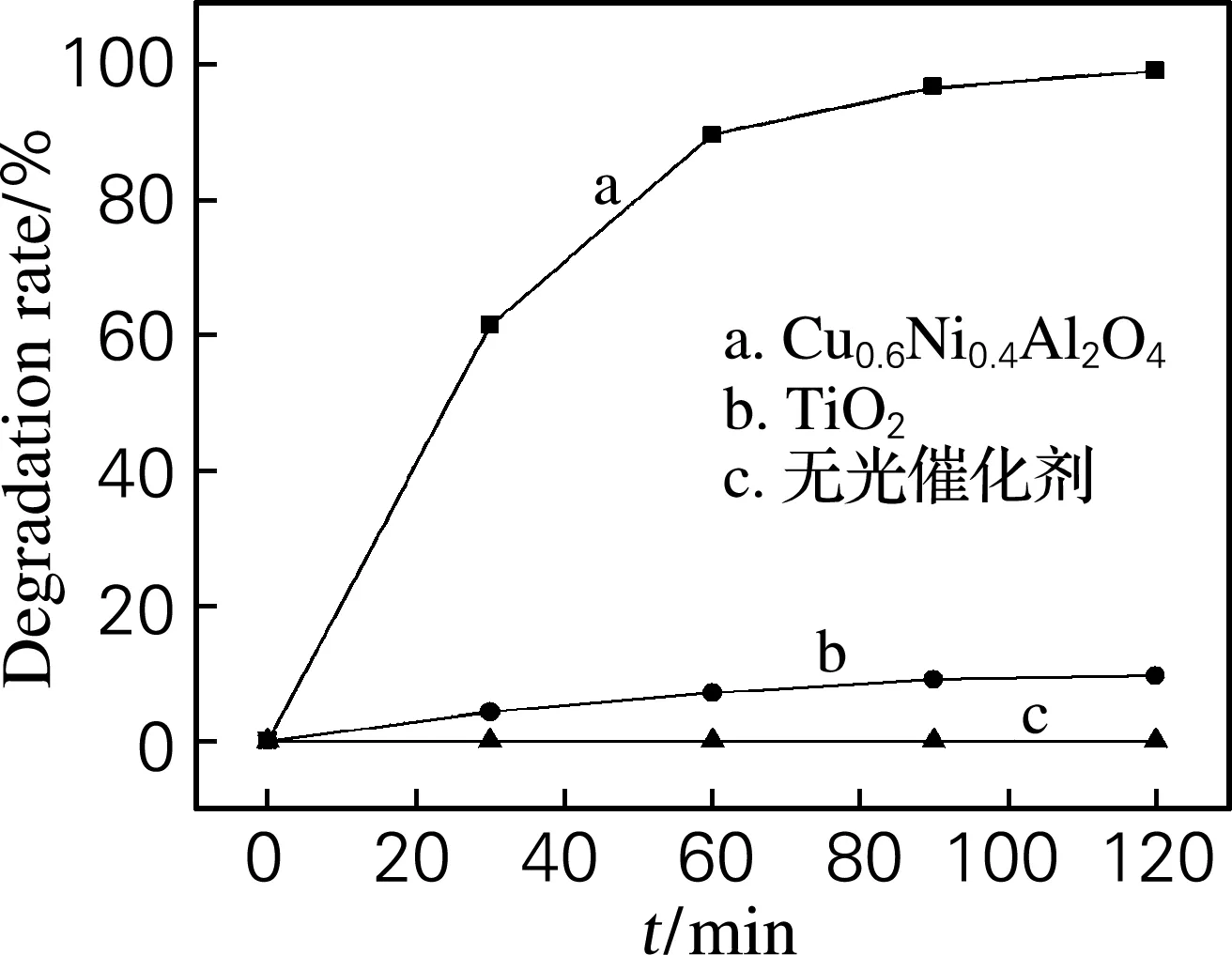
图4 活性艳红K-2G在不同光催化剂体系中的降解率
Fig.4 Degradation rate of creative red K-2G in different systems of catalyst
2.3.2 催化剂用量对降解率的影响
在50 mL(质量浓度10 mg/L)的活性艳红染液中分别添加50、80、100、120和150 mg的Cu0.6Ni0.4Al2O4光催化剂,在125 W自镇流高压汞灯下照射120 min,染料的光催化脱色效果如图5所示。从图5中可以看出,当催化剂用量从50 mg 增加到100 mg时,染液的降解脱色率随着催化剂用量的增多而提高,尤其是用量从50 mg增加到80 mg时,降解率提高显著,主要是因为催化剂用量少时,催化反应作用位点较少,脱色率相对较低;当催化剂用量增多时,增加了与染料接触的面积,反应活性位点增多,所以催化降解率增强。但用量增加到150 mg时,染液的降解率仍然约为99%,可能因为催化剂用量增多,催化反应活性位点虽然也会相应的增多,但是由于过量的光催化剂会对照射光线有一定的遮挡作用,抵消了因作用位点增多致使脱色率提高的作用,所以染液降解脱色率仍为99%;同时还造成催化剂的浪费。因此光降解染液的最佳催化剂用量确定为100 mg,即2 g/L。
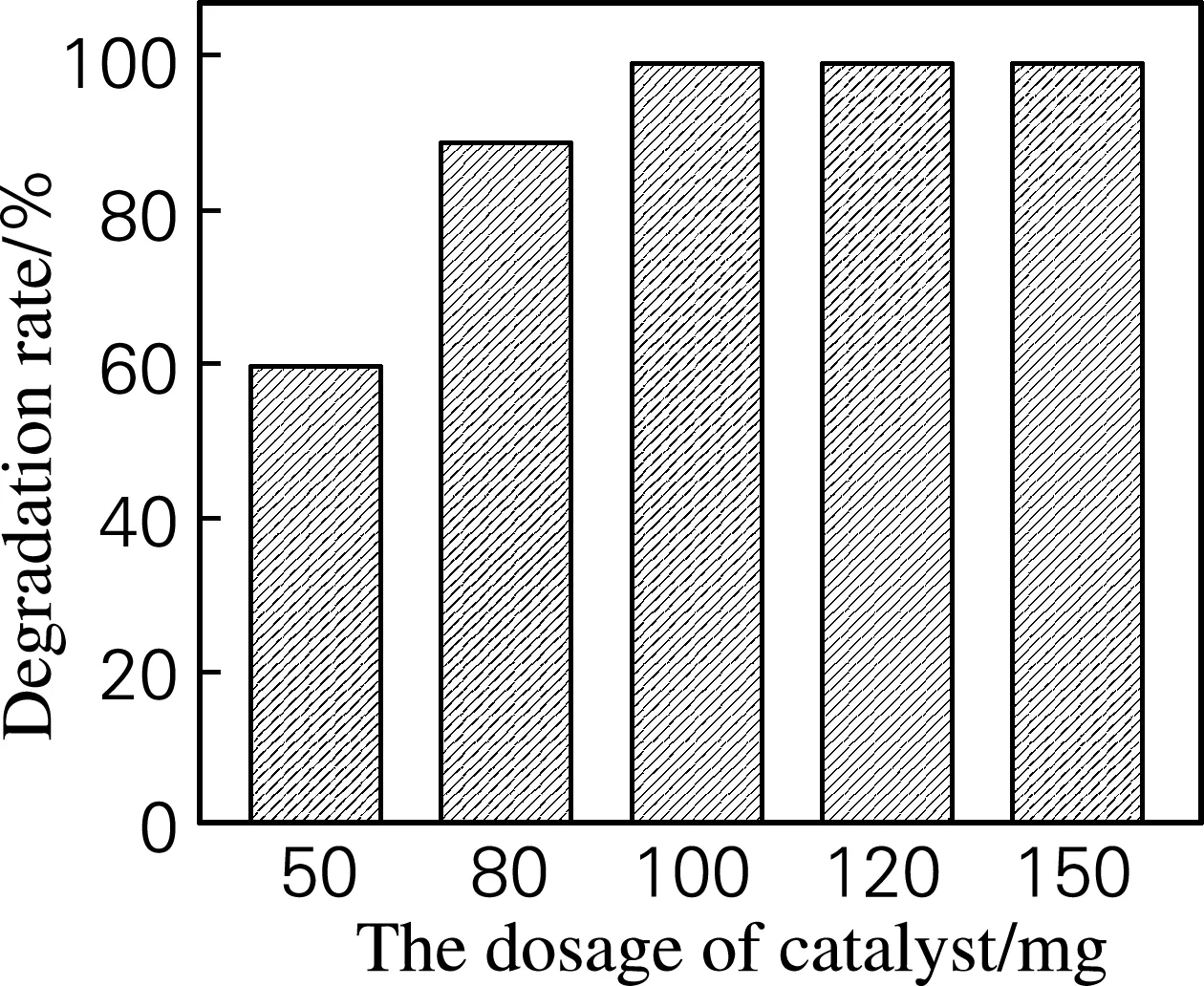
图5 催化剂用量与活性艳红K-2G降解率的关系
Fig.5 The relationship of degradation rate of creative red K-2G and the dosage of catalyst
3 结 论
以铜、镍、铝的硝酸盐为原料,采用柠檬酸络合溶胶-凝胶法成功制备Cu0.6Ni0.4Al2O4粉体,XRD晶相分析表明所得Cu0.6Ni0.4Al2O4具有尖晶石晶型,TEM观察粉体颗粒呈无规则颗粒状,粒径范围为5~40 nm,极限吸收波长为782 nm,对应的禁带宽度为1.59 eV。通过对模拟降解染液活性艳红K-2G的可见光催化降解实验,发现Cu0.6Ni0.4Al2O4在光照60 min后就能达到近90%降解率,光照2 h时降解率高达99%,展现出优异的可见光催化性能,而P-25(TiO2)光照2 h对染液的降解率不到10%。通过不同催化剂用量与染液降解率关系的实验,得到最佳催化剂用量为2 g/L。尖晶石型Cu0.6Ni0.4Al2O4作为一种窄带隙半导体光催化剂,在太阳光照射下对有机染料的降解具有潜在的应用价值。
参考文献:
[1] HITZ H R, HUBER W, REED R H, et al. The adsorption of dyes on activated sludge[J]. Journal of the Society of Dyers and Colourists, 1978, 94(2):71-76.
[2] KONSTANTINOU I K, ALBANIS T A. TiO2-assisted photocatalytic degradation of azo dyes in aqueous solution:kinetic and mechanistic investigations:a review[J]. Applied Catalysis B:Environmental, 2004, 49(1):1-14.
[3] HU Chun, WANG Yizhong. Decolorization and biodegradability of photocatalytic treated azo dyes and wool textile wastewater[J]. Chemosphere, 1999, 39(12):2107-2115.
[4] FUJISHIMA A, HONDA K. Electrochemical photolysis of water at a semiconductor electrode[J]. Nature, 1972, 238(5358):37-38.
[5] JIANG Yanyan, LI Jinggang, SUI Xiaotao, et al. Preparation and photocatalytic degradation behaviors to dyes of zinc spinel ZnM2O4(M=Cr, Mn, Fe) nanocrystals under visible light irradiation[J]. Journal of the Chinese Ceramic Society, 2007, 35(11):1439-1443.
[6] 姜妍彦,隋小涛,宁桂玲,等. 螯合剂对CuAl2O4粉体形貌及可见光性能的影响[J]. 稀有金属材料与工程, 2010, 39(增刊2):438-441.
[7] 姜洪波,高濂,张青红. Fe2O3/TiO2和ZnO/TiO纳米颗粒薄膜的亲水性能和光催化性能的研究[J]. 无机材料学报, 2003, 18(3):695-699.
[8] 周红茹,胡志强,康姣. CuCr2O4/TiO2复合薄膜电极对染料敏化太阳能电池光电性能的影响[J]. 大连工业大学学报, 2011, 30(5):357-360.
(ZHOU Hong-ru, HU Zhi-qiang, KANG Jiao. Effect of CuCr2O4/TiO2composite film electrodes on DSSC photoelectric properties[J]. Journal of Dalian Polytechnic University, 2011, 30(5):357-360.)
[9] 王岩,胡志强,秦颖,等. 尖晶石型MAl2O4(M=Cu、Ni)粉体的制备及其光电性能[J]. 大连工业大学学报, 2012, 31(3):187-190.
(WANG Yan, HU Zhi-qiang, QIN Ying, et al. Preparation and photoelectric properties of spinelMAl2O4(M=Cu, Ni) nanopowders[J]. Journal of Dalian Polytechnic University, 2012, 31(3):187-190.)
[10] JONES P T, DESMET D, GUO M X, et al. Using confocal scanning laser microscopy for the in situ study of high-temperature behaviour of complex ceramic materials [J]. Journal of the European Ceramic Society, 2007, 27(12):3497-3507.

