药物代谢动力学软件设计(三室模型)
范景行
(甘肃民族师范学院,甘肃 合作 747000)
药物代谢动力学软件设计(三室模型)
范景行
(甘肃民族师范学院,甘肃 合作 747000)
本文的研究范畴是三室模型线性药物动力学,包括一次静脉推注给药、一次血管外给药、静脉滴注给药3种模型。首先根据模型列出微分方程组,求出方程组的特解方程,然后将参数整合,根据已知数据求出参数值,也就是拟合出一条曲线。拟合曲线使用最小二乘法和Gauss-Newton迭代法求解,针对奇异矩阵导致Gauss-Newton法迭代结果发散的缺点,引进了Levenberg-Marquardt法,针对残差平方和偏重高密度数据点的缺点,引进了权重。所有算法都用C语言实现。
药物代谢动力学;最小二乘法;Gauss-Newton法;Levenberg-Marquardt法
药物代谢动力学(也称药动学、药物动力学、药代动力学,PK)是研究药物及其代谢物在体内吸收、分布、转化和排泄过程中,随着时间不同,不断进行运动变化规律的科学。药物代谢动力学研究的对象是人体,对患病的机体以及正常人体用药后,观察药物在体内的变化过程。根据该科学可对患者提供安全、有效的治疗方案,包括给药途径、用药剂型、用法、用量、给药间隔等,实现给药方案个体化;可重新审查给药计划,对不良反应做出解释;可按计划对正在进行血液、腹膜透析的患者给药,预防中毒。根据该科学可及时地进行血药浓度的监测,广泛地收集药学情报,为临床提供科学的给药方案,进一步提高疗效,减少药物的不良反应。所以该学科所肩负的任务非常重要,其研究是采用数学手段(如用图像、公式、参数等方法)来描述药物在体内运动过程中的规律,因而可为用药方案的设计提供重要的参考依据。
药物代谢动力学从数学的角度可分为两类:线性药物代谢动力学和非线性药物代谢动力学。在线性药物代谢动力学中,药物代谢动力学参数如半衰期与剂量无关;而在非线性药物代谢动力学中,药物代谢动力学参数随剂量(或体内药物浓度)而变化,如半衰期与剂量有关。本文所讨论的内容准确地说属于线性药物代谢动力学范畴,并以三室模型为研究对象,对一次静脉推注给药、一次血管外给药、静脉滴注给药3种常见的给药方式做详细介绍。
1 模型的建立
1.1 一次静脉推注给药的三室模型
药物的三室模型可以这样设想:假定药物进入中心室后,逐渐向两个周边室转运,在中央室与周边室之间药物进行着可逆的运动,药物在中央室按一级过程消除[1],其体内过程模型见图1。

图1 一次静脉推注给药的三室模型
图1 显示:X0为静脉注射给药剂量;XC为中央室的药量;XP和XB为周边室的药量;k12和k21为中央室与浅外室之间的运转速度常数;k13和k31为中央室与深外室之间的运转速度常数;k10为药物从中央室消除的一级速度常数;VC、VP、VB分别为中央室、浅外室、深外室的表观分布容积。
假如药物的转运过程均服从一级速度过程,即药物的转运速度与该室药物浓度(或药量)成正比,则各室药物的转运可用下列微分方程组定量描述[2]。

当t=0时,注射的药物全部存放于中心室内,尚未转运至其他各室。所以XC(0)=X0,XP(0)=XB(0)=0,这就是以上方程组的初始条件。
因为实际测量的数据普遍都以中央室为主,所以我们只讨论中央室的血药浓度与时间的关系。设C为中央室药物浓度,通过求解化简可得需要拟合的数学方程:

1.2 静脉滴注给药的三室模型
设剂量为X0的药物,在τ0这段时间内,以恒速k0=D0/τ0滴入中心室,其体内过程模型[3]见图2。

图2 静脉滴注给药的三室模型
图2 显示:X0为静脉注射给药剂量;XC为中央室的药量;XP和XB为周边室的药量;k12和k21为中央室与浅外室之间的运转速度常数;k13和k31为中央室与深外室之间的运转速度常数;k10为药物从中央室消除的一级速度常数;VC、VP、VB分别为中央室、浅外室、深外室的表观分布容积。
在经过滴注时间t(0≤t≤τ)时,中心室的药量为XC(t),周边室的药量为XP(t)和XB(t)。除滴注是恒速K0之外,如果其余各转运过程服从一级动力学过程,则各室间的药物转运方程为[4]:

当t=0时,XC(0)=XP(0)=XB(0)=0,这就是以上方程组的初始条件。
因为实际测量的数据普遍都以中央室为主,所以我们只讨论中央室的血药浓度与时间的关系。同理可得:
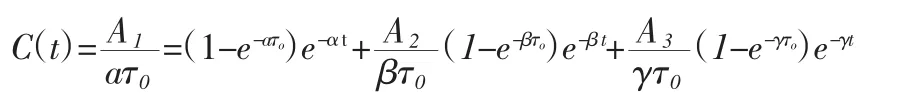
这就是滴注后中心室的药物浓度与时间关系。其中,是从滴注完成时算起。
1.3 一次血管外给药的三室模型
有些药物不能做静脉推注给药时,则采用血管外给药,仅需在静脉推注给药的三室模型中心室前增加一个吸收室,让药物逐渐从吸收室转运至中心室,再转运至两个周边室[5](见图3)。

图3 一次血管外给药的三室模型
图3 显示:X0为给药剂量;Xa为吸收室药量;XC为中央室的药量;XP和XB为周边室的药量;kа为吸收速度常数;k12和k21为中央室与浅外室之间的运转速度常数;k13和k31为中央室与深外室之间的运转速度常数;k10为药物从中央室消除的一级速度常数;Vа、VC、VP、VB分别为吸收室、中央室、浅外室、深外室的表观分布容积。
假定吸收过程仍是一级过程,则各室间的药物运转可用下列方程表示[6]:
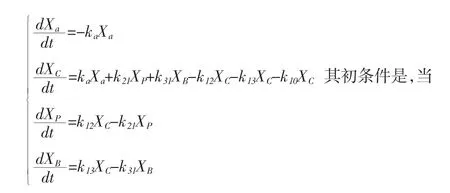
因为实际测量的数据普遍都以中央室为主,所以我们只讨论中央室的血药浓度与时间的关系。同理可得:
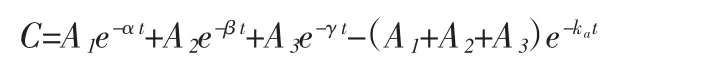
2 模型的求解算法
Gauss-Newton 算法步骤归纳如下[7,8]:
(1)取初始近似值A0,允许误差ε;
(2)计算 F(XY,A0),DF(X,Y,A0),DF(X,Y,A0)T;
(3)解线性方程组:

得△A;
(4)以△ A修正 A0,即计算:A=A0+△ A;
(5)若|△ A|>ε,则 A0=A,即将 A 作为初值 A0,重复步骤(2)、(3)、(4),直至|△ A|<ε。
由于Gauss-Newton法采用的是将非线性函数在初值附近做Taylor展开,然后略去二次及二次以上诸项,做简单线性近似的方法,所以无法避免两种情况的发生:一是Gauss-Newton法对初值的依赖非常严重,如果初值选取不当,往往发散,即越迭代越远离目标值;二是如果Taylor展开后略去的二次及二次以上诸项的值相对过大,依然会造成Gauss-Newton法不收敛。
克服这个困难的一种途径是采用Levenberg-Marquardt的方法[9,10],即加大 DF(X,Y,A0)TDF(X,Y,A0)的主对角元素,而得到改善,将步骤(3)中的方程改写成:

式中:μ——阻尼因子;
In——n阶单位矩阵或DF(X,Y,A0)TDF(X,Y,A0)的主对角元素构成的矩阵(本论文中的算法选择后者)。相应的算法步骤归纳如下:
(1)取初始近似值A0,计算
(2)取一个适中的μ值,如μ=0.001;
(3)计算 F(X,Y,A0),DF(X,Y,A0),DF(X,Y,A0)T;
(4)解线性方程组[DF(X,Y,A0)TDF(X,Y,A0)+μ In]△A=-DF(X,Y,A0)TF(X,Y,A0),得△ A,并计算 V(X,Y,a1,+V a1a2+V a2,L,an+V an,);
(5)如果 V (X,Y,a1+V a1,α2+V a2,L,an+V an)≥ V(X,Y,a1,a2,L,an),则将 μ扩大 10 倍(或其他的具有意义的倍数),再回到步骤(4);
(6)如果V(X,Y,a1+V a1,a2+V a2,L,an+V an)<V(X,Y,a1,a2,L,an),则将μ缩小10倍(或者其他的具有意义的倍数),将△A+A0代替 A0,再回到步骤(4);
(7)直至|△ A|<ε或 V(X,Y,a1,a2,L,an)的变化量<ε,迭代停止,输出结果。
[1]刘昌孝,刘定远.药物动力学概论[M].北京:中国学术出版社,1984.
[2]梁文权.生物药剂学与药物动力学[M].北京:人民卫生出版社,2000.
[3]袁亚湘,孙文瑜.最优化理论与方法[M].北京:科学出版社,2003.
[4]关治,陆金甫.数值分析基础[M].北京:高等教育出版社,2002.
[5]韦鹤平.最优化技术应用[M].上海:同济大学出版社,1987.
[6]谭浩强.C程序设计[M].2版.北京:清华大学出版社,2002.
[7]蒋长锦.科学计算和C程序集[M].合肥:中国科学技术大学出版社,1998.
[8]William H P,Saul A T,William T V,et al.C数值算法[M].2 版.北京:电子工业出版社,2004.
[9]张贤达.矩阵分析与应用[M].北京:清华大学出版社,2004.
[10]肖爱玲.Some algorithms of nonlinear least squares[J].数学理论与应用,2004,24(2),86~90.
G431
A
1671-1246(2012)17-0042-03

