硫胺素调控奶牛微生物发酵适宜添加量的筛选
喻礼怀 郝志敏 付 聪 王梦芝 王洪荣
(扬州大学动物科学与技术学院,江苏扬州225009)
近年来,关于硫胺素在反刍动物方面的研究已有相关的报道。本实验室的前期研究表明,奶牛在常规日粮(精粗比为3∶7)条件下饲喂可以不添加硫胺素。而在高精料日粮下反刍动物日粮中有必要添加硫胺素。因此有必要通过试验来确定硫胺素的适宜添加量。
1 材料与方法
1.1 试验材料
盐酸硫胺素:纯度≥99%(Solarbio)。
1.2 试验动物及底物组成
从扬州大学试验牧场选取体重接近、身体健康及安装永久性瘤胃瘘管的荷斯坦奶牛4头。试验底物及硫胺素添加量见表1,人工唾液盐的配制见表2。
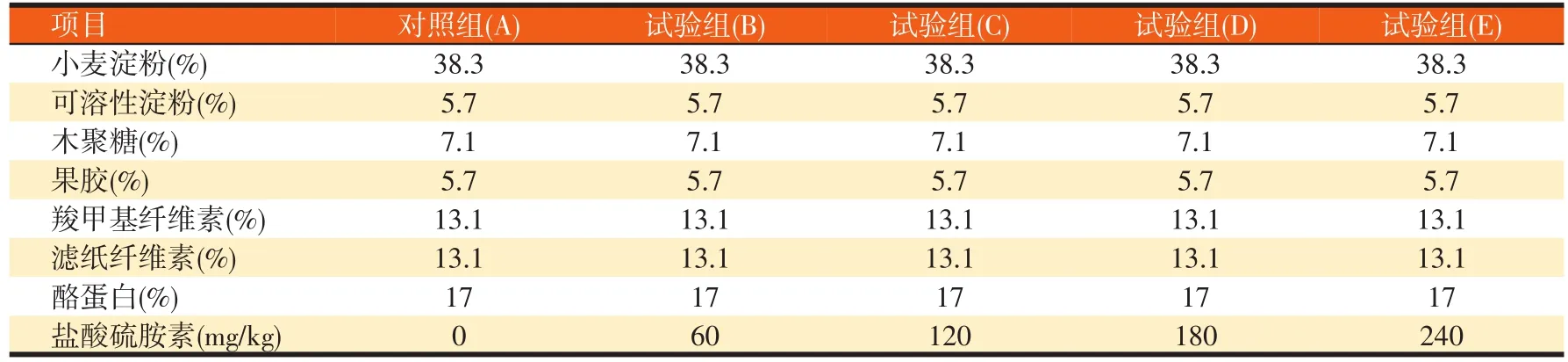
表1 底物组成与硫胺素的添加量
1.3 试验设计及饲养管理
试验采用单因子试验设计,5个硫胺素水平,分别是0、60、120、180和240 mg/kg。对照组不添加盐酸硫胺素,试验组分别添加不同剂量的盐酸硫胺素(纯度≥99%,硫胺素的有效含量分别为0、53.5、107.0、160.5、214.0 mg/kg),每组3个重复。

表2 人工唾液盐缓冲液组成含量(g/l)
采集瘤胃液用于体外培养,培养底物是半纯合日粮,其精粗比设计为6∶4。培养时间72 h。分别在0、1、3、6、10、24、48、72 h采集培养液。试验期间每日7:00和19:00两次等量饲喂,自由饮水,用于采集瘤胃内容物样品。
人工唾液盐缓冲液在使用前1 d配制(见表2)并通入CO2待用。
1.4 体外培养步骤
早晨饲喂前采集奶牛瘤胃液,装在自制真空负压装置。每头瘘管牛采集100 ml瘤胃液,过滤后装入保温瓶。往保温瓶通入CO2,并置于恒温水浴中保温。
培养试验前3 h配制人工唾液盐,即配即用。每个重复(培养瓶)添加1.2 g配制好的底物,并按上述试验设计添加硫胺素;之后添加配制好的人工唾液盐80 ml,再各加入采集好的并经过过滤的瘤胃液40 ml,通入CO2至饱和,置于恒温水浴中保温。另设只含有人工唾液盐和瘤胃液的空白对照,培养72 h。分别在0、1、3、6、10、24、48、72 h采集培养液,每次采集15 ml,分装在5 ml和10 ml的离心管中,测定pH值,并将样品置于-20℃保存,测定相关指标。培养72 h后,收集培养液,分装在10 ml离心管,-20℃保存,进行微生物分离及指标测定。
1.5 指标测定
使用pHS-3C型pH计测定pH值;使用苯酚-次氯酸钠比色法测定氨氮浓度;微生物的分离采用Mar⁃tin-Orue等的方法进行测定;微生物蛋白的测定采用三氯乙酸沉淀蛋白法进行测定。
1.6 数据处理
用Excel软件进行数据整理,用SPSS Statistics 17.0统计软件分析数据。方差分析采用比较均值中的单因素ANOVA分析,显著性检验采用LSD多重比较。数据以“平均值±标准误”表示,标准误用SEM表示,显著性用P表示。
2 结果
2.1 高精料日粮条件下硫胺素对培养液pH值的影响(见表3、图1)
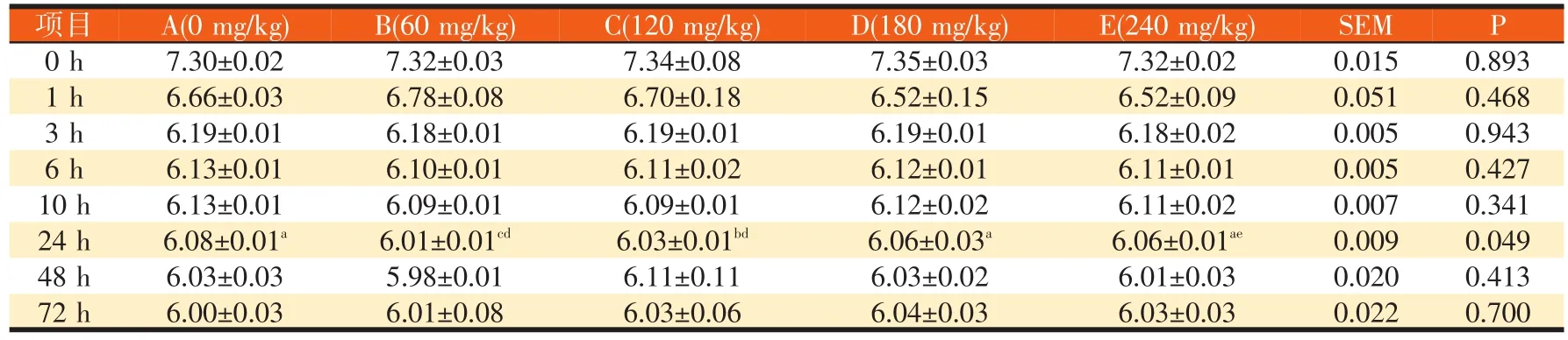
表3 高精料日粮条件下不同硫胺素水平对培养液pH值的影响

图1 高精料日粮条件下硫胺素对培养液pH值的影响
由表3可见,除24 h时间点外,各试验组与对照组相比,培养液pH值差异不显著(P>0.05)。培养液中瘤胃微生物降解营养物质,生成挥发性脂肪酸,致使各组pH值随时间呈下降趋势,基本在72 h时降到最低点。24 h时,B试验组与对照组相比,培养液pH值差异极显著(P<0.01),B试验组与D试验组相比,培养液pH值差异极显著(P<0.01)。
2.2 高精料日粮条件下不同硫胺素水平对培养液氨氮浓度的影响(见表4、图2)
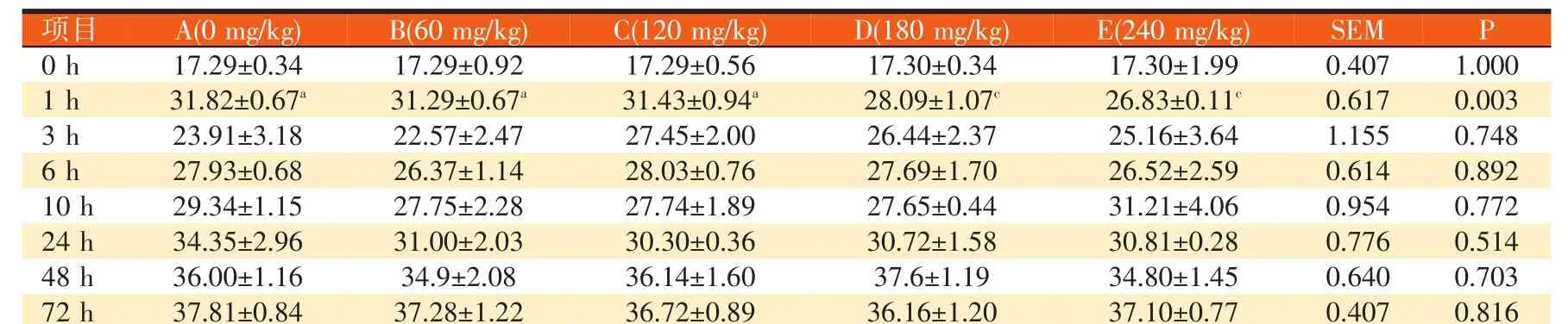
表4 高精料日粮条件下不同硫胺素水平对培养液氨氮浓度的影响(mg/100 ml)

图2 高精料日粮条件下硫胺素对氨氮浓度的影响
由表4可见,随着硫胺素添加量的增加,各试验组氨氮浓度整体上均低于对照组A组,且各个试验组之间整体上差异均不显著(P>0.05),在培养1 h时,D、E试验组极显著低于对照组,B、C试验组与对照组相比差异不显著(P>0.05)。
从同一时间点看,相比于对照组,试验各组培养液的氨氮浓度均呈现下降的趋势,NH3-N浓度随时间点的变化来看,试验各组氨氮浓度的变化趋势与对照组大体上都相似,随培养液培养时间的延长呈先升高后缓慢下降然后又缓慢上升的趋势。1 h时,对照组极显著高于D组和E组(P<0.01)。
2.3 高精料日粮条件下硫胺素对培养液原虫蛋白产量的影响(见表5、图3)

表5 高精料日粮条件下硫胺素对培养液原虫蛋白产量的影响(mg/ml)

图3 高精料日粮条件下硫胺素对原虫蛋白产量的影响
由表5可见,随着硫胺素水平增加,各组原虫蛋白产量总体上表现为先下降后上升的趋势,72 h时的原虫蛋白产量最高。在48 h时,D试验组原虫蛋白产量极显著低于对照组(P<0.01),而其它各试验组的原虫蛋白产量与对照组相比差异均不显著;在72 h时,D试验组原虫蛋白产量和E试验组原虫蛋白产量极显著低于对照组(P<0.01)。
2.4 高精料日粮条件下硫胺素对培养液细菌蛋白产量的影响(见表6、图4)

表6 高精料日粮条件下硫胺素对培养液细菌蛋白产量的影响(mg/ml)

图4 高精料日粮条件下硫胺素对细菌蛋白产量的影响
由表6可见。随着硫胺素水平增加,细菌蛋白产量呈现上升趋势,各试验组的细菌蛋白产量与对照组的细菌蛋白产量相比差异不显著(P>0.05)。各组细菌蛋白产量总体上表现为先上升后下降的趋势,总体上看,6~10阶段较高,而48~72 h阶段较低。在72 h时,B试验组细菌蛋白产量和D试验组细菌蛋白产量极显著高于对照组(P<0.01),而其它各试验组的细菌蛋白产量与对照组相比差异不显著(P>0.05)。
3 讨论
3.1 高精料日粮条件下硫胺素对瘤胃培养液pH值的影响
在反刍动物养殖中,饲喂方法、日粮组成、瘤胃内乳酸及挥发性脂肪酸等其它有机酸产生、吸收利用等因素均会影响瘤胃液的pH值,因此,我们通常所认为衡量瘤胃发酵水平和内环境综合指标的是瘤胃液的pH值。
本试验中对照组和各个试验组所记录的所有的培养液pH值的变动范围分别是6.00~7.30,5.98~7.32,6.03~7.34,6.03~7.35和6.01~7.32。体外发酵开始后,锥形瓶中的底物慢慢被瘤胃微生物降解生成乳酸、大量的挥发性脂肪酸以及其它一些有机酸,这些酸产生速度远高于微生物利用速度,以致pH值下降。随培养时间增加,瘤胃中相关微生物活动能力减弱,利用酸性物质能力降低,以致之前产生的酸性物质等其它次生代谢产物又不能及时外排,所以导致培养液pH值缓慢下降。培养结束后,与对照组相比,其它各试验组pH值都不同程度地升高,说明高精料日粮条件下模拟体外发酵试验中添加硫胺素有提高pH值的趋势。
3.2 高精料日粮条件下不同硫胺素水平对瘤胃液氨氮浓度的影响
饲料中蛋白质的含量、饲料中蛋白质在瘤胃内降解的特性、能量供应以及微生物蛋白的合成情况可以由瘤胃液中氨氮水平来反映。瘤胃内氨氮是非纤维分解菌的部分氮源,更是纤维分解菌的必需氮源,因此氨氮浓度也是体现瘤胃中微生物活力的一个很重要的指标,微生物蛋白高效率的合成一定要微生物提供充足的氮源。
本试验中瘤胃液氨氮浓度的变动范围是17.29~37.81 mg/100 ml。体外培养72 h后,各试验组的氨氮浓度均高于对照组。5组氨氮浓度随培养时间的变化规律相似,培养1 h后,各试验组瘤胃液氨氮浓度达到一个最高点,这其中主要的一个原因是瘤胃中尿素酶的活性高,这种酶能降解尿素释放氨氮,这样氨氮浓度就会上升;随后浓度开始下降,这是因为瘤胃微生物开始吸收和利用氨氮;在发酵快结束的时候氨氮浓度又开始缓慢回升,这其中一个可能的原因是纤毛虫自溶或细菌溶菌作用开始释放氨所导致的。
3.3 高精料日粮条件下硫胺素对微生物真蛋白产量的影响
瘤胃微生物利用发酵产生的挥发性脂肪酸、糖类以及ATP等作为生长所需的能源,再利用日粮中粗饲料蛋白及精料中玉米等的蛋白通过降解而产生的各种氨基酸等作为氮的来源来合成MCP,可以给动物机体提供充足的能量。MCP的合成受碳水化合物(NFC)的种类和含量、动物饲粮中可降解蛋白、瘤胃内环境、饲粮中的蛋白水平以及能氮释放等的影响。
本试验中尿素为微生物发酵提供充足氮源,但微生物合成蛋白需要其它可利用能量。随硫胺素添加,原虫蛋白产量下降。这其中主要的原因是添加硫胺素后,瘤胃液的渗透压发生改变,种属原虫的细胞壁比较薄,对渗透压的敏感性较强而对存活率造成了一定的影响。细菌蛋白产量各个试验组整体上均高于对照组,细菌蛋白产量有所提高,因为硫胺素是碳水化合物代谢中必不可少的一种水溶性维生素。添加硫胺素促进碳水化合物代谢,饲料能量的利用率也随之提高,其中以180 mg/kg的添加量效果最显著。
4 结论
①高精料日粮条件下添加硫胺素有提高瘤胃液pH值的趋势,可以提高细菌蛋白产量,但降低了培养液的氨氮浓度。
②结合奶牛瘤胃内环境指标,本试验推荐硫胺素最佳添加水平为180 mg/kg。
[1]Shaver R D,Bal M A.Effect of dietary thiamin supplementation on milk production by dairy cows[J].Journal of Dairy Science,2000,83:2335-2340.
[2]张红伟.硫胺素(VB1)对瘤胃内营养物质消化代谢的影响[D].扬州大学,2010.
[3]De Oliveira L A,Jean-Blain C,Komisarczuk-Bony S,et al.Micro⁃bial thiamin metabolism in the rumen simulating fermenter:the ef⁃fect of acidogenic conditions,a high sulfur level and added thia⁃min[J].British Journal of Nutrition,1997,78(4):599-613.
[4]Broderiek G A,Kang J H.Automated simultaneous determina⁃fion of ammonia and amino acids isolation of nlni nbacteria[J].Journal of Applied Microbiology,1980,14:794-799.
[5]Martin-Orue S M,Balcells J.Quantification and chemical compo⁃sition of mixed bacteria harvested from solid fractions of rumen di⁃gesta:effect of detachment procedure[J].Animal Feed Science and Technology,1998,4:269-282.
[6]王宁娟.人工瘤胃法研究矿物质元素及非蛋白氮对瘤胃发酵的影响[D].西北农林科技大学,2003.
[7]熊本海,卢德勋,高俊.绵羊瘤胃VFA吸收效率及模型参数的研究[J].动物营养学报,1999(11):248-255.
[8]张龙翔,张庭芳,李令媛主编.生化实验方法和技术[M].第二版.北京:高等教育出版社,1997:422-428.
[9]孙海州,卢德勋,赵秀英,等.在饲喂基础日粮条件下绵羊消化道内不同部位的淀粉消化和利用规律[J].内蒙古畜牧科学,2000,21(1):6-10.
[10]谭支良,卢德勋,胡明,等.绵羊日粮中不同碳水化合物比例对瘤胃内环境参数的影响[J].动物营养学报,2000,12(1):42-47.
[11]参有木,卢德勋,胡明,等.玉米秸秆处理方法与替换干草对绵羊瘤胃发酵与采食量的影响[J].畜牧兽医学报,2004,35(1):10-14.
[12]张霞.沙葱提取物对绵羊瘤胃发酵和微生物区系的影响[D].内蒙古农业大学,2007.

