怀孕母猪的精氨酸营养和繁殖性能
伍国耀
(美国德克萨斯州农工大学动物科学系,77843
中国农业大学,动物营养国家重点实验室,北京100193)
养猪业获得利润的关键依赖于母猪的繁殖性能。然而,为了改善现代化高产母猪的繁殖性能,我们必须克服产前死亡率这个重大的挑战。产前死亡率大约损失30%~50%的胎猪。因此,在美国初产母猪每窝生产大约仅9.62头仔猪,基于排出的卵母细胞总数,这个数字远低于潜在的14个或者更多的新生仔猪。产前损失在怀孕后的前25 d超过75%,另一个胎儿死亡期发生在怀孕后的40~60 d,尤其发生在大窝产仔数母猪怀孕早期。许多因素会造成胚胎和胎儿损失,包括排卵率、授精率、疾病(例如病毒感染)、染色体异常、发育不均匀的孕体和子宫或者子宫容量拥挤。以上这些原因中,在围植入期孕体(胚胎和胚外膜)发育不良是导致母猪怀孕后前30 d胚胎损失的主要原因,子宫容量不足是导致母猪怀孕30 d后胎儿死亡和生长不理想的主要原因。
为了提高猪和其他哺乳动物类的胚胎或胎儿的存活率,营养学家已作出了许多的努力。通过动物育种能提高窝产仔数,但效率却非常低。在1980~2000年期间,美国养猪业的窝产仔数增加的速度只有0.052头/年。遗传选择效率低的原因是窝产仔数的遗传力低。总窝产仔数的遗传力约是0.1,而活产仔数甚至更低,约0.07。另一种方法是通过超数排卵来增加排卵率,但是这种方法增加窝产仔数却很少,因为高排卵率有可能引起母猪子宫拥挤症,从而增加怀孕中期和后期的胎儿死亡率。
精氨酸是怀孕的哺乳动物包括猪的营养性必需氨基酸。精氨酸除了是蛋白质的基石外,也是合成许多生物活性分子包括一氧化氮(NO)、鸟氨酸、多胺(腐胺、亚精胺、精胺)、肌酸和胍丁胺的前体。在以上分子中,一氧化氮和多胺刺激细胞增殖和迁移、细胞重组、血管生成、血管扩张增加血流量,而肌酸是神经和骨骼肌发育必不可少的。因此,在初产母猪怀孕30~114 d的日粮中补充0.83%精氨酸[16.6 g/(头·d)]可以提高窝产仔数。许多国家包括澳大利亚、中国、荷兰、新西兰和瑞典的研究都证明在怀孕母猪日粮中补充精氨酸可减少胚胎死亡这一有利的作用。在孕鼠上也得到相似的结果。相反的是,最近有两个研究组报道在初产和经产母猪的怀孕早期(18~34 d)和后期(75~115 d)日粮中补充1.23%精氨酸[或者28 g/(头·d)]对窝产仔数无影响,甚至有可能对母猪的繁殖性能有负作用。应该牢记的是,日粮中过多的精氨酸对怀孕母猪胚胎或者胎儿的存活不一定就好。更确切地说,适当比例的氨基酸(尤其是精氨酸和赖氨酸)以及考虑日粮配方中最佳的日粮氮的摄入对于防止氨基酸间的拮抗作用和氨气对怀孕动物胚胎/胎儿的毒性影响具有重要作用。这些结果强调了了解繁殖生物学基础知识和氨基酸生物化学来设计平衡日粮对全球养猪业的重要性。
1 猪的胚胎发育、胚泡植入和胎盘形成
猪授精后,授精卵在输卵管发育和分裂为2细胞和4细胞胚胎。约在怀孕3 d进入子宫后,胚胎继续分裂,约到怀孕后7~8 d发育成胚泡,然后在透明带孵化。之后,胚泡在子宫内迁移使彼此之间的间距相等,在怀孕10~12 d期间在形态上也发生显著的变化,从一个膨胀的球状变为管状和丝状体。怀孕10 d时球形胚泡的直径约5~10 mm。但是,在怀孕11 d时球形胚泡的直径则达到了10 mm,然后仅用3 h或4 h拉长为管状和丝状孕体,长度为150~200 mm,到15 d时长度达到1 000 mm。这些初始发生的形态学的变化是通过细胞重构而不是细胞增生,但是在怀孕12~15 d期间胚泡的形态学变化既通过细胞增生也通过细胞重构来完成。
在母猪怀孕11 d,即当胚泡开始发生显著的形态学变化及分泌雌激素作为怀孕识别信号时,母体意识到自己怀孕了。在怀孕13 d,猪孕体开始附着到子宫腔上皮细胞(LE)的滋养层,然后约在怀孕18 d时完成着床,形成一个真正的上皮绒膜胎盘。猪和其他家畜动物的独特特征是为了延伸胎体滋养层而延长了胚泡植入前期的时间,然后是胚泡定位,在滋养层和子宫腔上皮细胞间附着,随后是滋养层和子宫腔上皮细胞的黏合。为了胚泡和孕体延伸而延长植入前期阶段使滋养层和子宫腔上皮细胞间建立了一个最大的表面接触面积,有利于胞胚吸收、分泌或转运通过母体的子宫上皮细胞进入子宫腔的组织营养素。这些物质是孕体存活和生长所必需的,并促进猪滋养层和子宫LE之间浅表型和非侵入性的黏结。
滋养层的延伸主要依赖于子宫腔上皮细胞、浅表型腺上皮(sGE)和腺上皮(GE)产生的促组织生成的营养。然而,胎盘卵黄囊(16~21 d)和尿囊(21 d至足月)血管的快速生长是为母体和胎儿胎盘血液之间的营养和气体的交换做准备。另外,从怀孕植入期后到怀孕后期经由绒毛尿囊膜的乳晕提供的营养也支持孕体的生长和发育。为了支持孕体发育,许多参与营养物质运输、细胞重构、血管生成、血管组织松弛以及细胞增殖和迁移的基因被表达。早期胚胎损失是因为在怀孕围植入期孕体发育和植入失败所造成。这些关于着床和胎盘形成的基本知识为怀孕母猪的营养管理提供了生理基础。
2 猪精氨酸代谢
2.1 精氨酸合成
在猪上,精氨酸来自日粮和内源性精氨酸(包括从头合成和蛋白质降解)。怀孕母猪通常采用限饲饲喂方法(例如:2 kg的玉米-豆粕型基础日粮),其目的是防止在怀孕期间过度增重和泌乳期的低采食量。因此,怀孕母猪日粮中提供的精氨酸不能满足怀孕母猪的需要。所以需要通过内源合成精氨酸来满足胚胎、胎盘和胎儿的生长发育。由于怀孕母猪维持正氮平衡(即没有净蛋白质降解),从头合成精氨酸是给母亲及其胎儿提供内源性精氨酸的唯一途径。当怀孕母猪每天限量饲喂时,在母亲和胎儿内来自谷氨酰胺、谷氨酸和脯氨酸从头合成的精氨酸可以基于胎儿和胎盘中的精氨酸含量以及肌酸的合成来计算。所有这些代谢需要的精氨酸,除了怀孕前半阶段胎盘蛋白质的合成外,都随着怀孕时间的增加而增加(表1)。为了支持这一观点,胎儿小肠在怀孕30 d后通过谷氨酰胺、谷氨酸和脯氨酸合成瓜氨酸(合成精氨酸的直接前体),该合成途径的能力在怀孕30~114 d逐步增加。

表1 怀孕初产母猪的精氨酸需要和它的内源合成a
基于对猪小肠上皮细胞的研究,我们建立了从谷氨酰胺、谷氨酸和脯氨酸合成精氨酸的酶学基础。谷氨酰胺通过磷酸激活的谷氨酰胺酶转化为谷氨酸。谷氨酸通过P5C合成酶形成5-吡咯啉羧酸(P5C)。脯氨酸通过脯氨酸氧化酶也能合成P5C。P5C通过鸟氨酸氨基转移酶酰胺化形成鸟氨酸,鸟氨酸通过氨甲酰磷酸合成酶I与氨甲酰磷酸反应产生瓜氨酸。所有涉及瓜氨酸和精氨酸合成的酶都存在于猪胎儿的小肠中。精氨酸酶活性在胎儿肠黏膜上皮几乎没有,从而最大限度地从肠道中合成和释放精氨酸。
2.2 精氨酸代谢
在怀孕母猪的小肠,精氨酸被精氨酸酶大量地代谢,肠腔中只有60%的日粮精氨酸进入门静脉循环。肠道精氨酸降解的主要产物包括鸟氨酸和脯氨酸,它们被释放到门静脉循环。门静脉中大约8%的精氨酸通过肝脏提取用于合成蛋白质和尿素。因此,考虑到玉米-豆粕型基础日粮精氨酸的真回肠消化率(85%),在怀孕母猪日粮中仅有47%的精氨酸可被肠外和肝外组织利用(见图1)。
2.3 精氨酸转运
精氨酸的转运是细胞利用此氨基酸的第一步,简单扩散不是细胞外精氨酸转运的主要机制。将精氨酸转运到细胞膜需要特殊的载体。作为一个阳离子氨基酸,精氨酸的转运载体与赖氨酸、鸟氨酸和组氨酸转运载体相同。系统y+是转运系统第一个被确定的阳离子氨基酸转运载体(CAT),它选择性转运阳离子氨基酸并且不依赖于Na+。3种不同的CAT基因已被克隆(SLC7A1、SLC7A2和 SLC7A3),编码 4种同源蛋白质CAT-1、CAT-2A、CAT-2B 和 CAT-3。另外,氨基酸转运系统 bo,+和 Bo,+在鼠胚泡中有表达,能转运中性氨基酸以及阳离子氨基酸。这两种系统通过是否依赖 Na+转运来区别,系统 Bo,+依赖于 Na+,而系统bo,+则不依赖于Na+。第4种氨基酸转运系统是y+L,对中性和阳离子氨基酸都具有高亲和力。通过这个y+L系统转运阳离子氨基酸是不依赖于Na+的,而当介质中的Na+被K+代替时,此系统对中性氨基酸的表观亲和力却显著下降。

3 精氨酸利用的多种途径
在细胞中有多种途径利用精氨酸。精氨酸作为合成许多生物分子的前体,包括鸟氨酸、多胺(腐胺、精胺和亚精胺)、脯氨酸、谷氨酰胺、肌酸、胍丁胺、NO和蛋白质。精氨酸经典的代谢方式是被精氨酸酶转化产生鸟氨酸,然后鸟氨酸被转化为多胺、脯氨酸、谷氨酸和谷氨酰胺。在哺乳动物中,精氨酸酶存在两种不同的同工酶,精氨酸酶Ⅰ是一种胞浆酶,主要在肝脏中表达。精氨酸酶Ⅱ在肝外组织的线粒体中表达,包括肾脏、大脑、小肠、乳腺和巨噬细胞。所有的尿素循环酶在怀孕母猪的小肠中表达。这些物质可作为防御在小肠中通过氨基酸代谢产生的毒性氨气的第一道防线。由精氨酸衍生得到的鸟氨酸是母体和胎儿组织合成多胺和脯氨酸的重要前体(见图2)。脯氨酸在猪胎盘和胎儿小肠合成多胺中起到了重要的作用。
精氨酸是合成NO的前体,NO合成酶(NOS)催化这一反应。NOS有3种亚型:神经元NOS(nNOS;也被称为 NOS1);诱导型NOS(iNOS;也被称为NOS2)和内皮NOS(eNOS;也被称为NOS3)。NOS1和NOS3在细胞特定区域表达,产生低水平的NO。然而,NOS2被免疫刺激 (LPS和炎症细胞因子)诱导产生大量的NO,NOS3合成的NO是一种主要的内皮细胞依赖性舒张因子。烟酰胺腺嘌呤二核苷酸磷酸(NADPH)、钙调蛋白、黄素腺嘌呤二核苷酸、黄素单核苷酸和四氢生物蝶呤(BH4)是所有的NOS亚型酶活性必不可少的辅助因子。另外,除了NOS2,NOS1和NOS3合成NO都需要钙。几乎所有类型的细胞都能经由精氨酸琥珀酸合成酶将瓜氨酸回收转化为精氨酸,这种细胞内的精氨酸-瓜氨酸循环帮助维持足够浓度的精氨酸来产生NO。胞外精氨酸浓度从0增加到10 mM,细胞和组织(包括内皮细胞、巨噬细胞和胎盘)合成NO的量也增加。精氨酸通过增加BH4的合成来增加猪胎盘中NOS的活性和NO的产生。
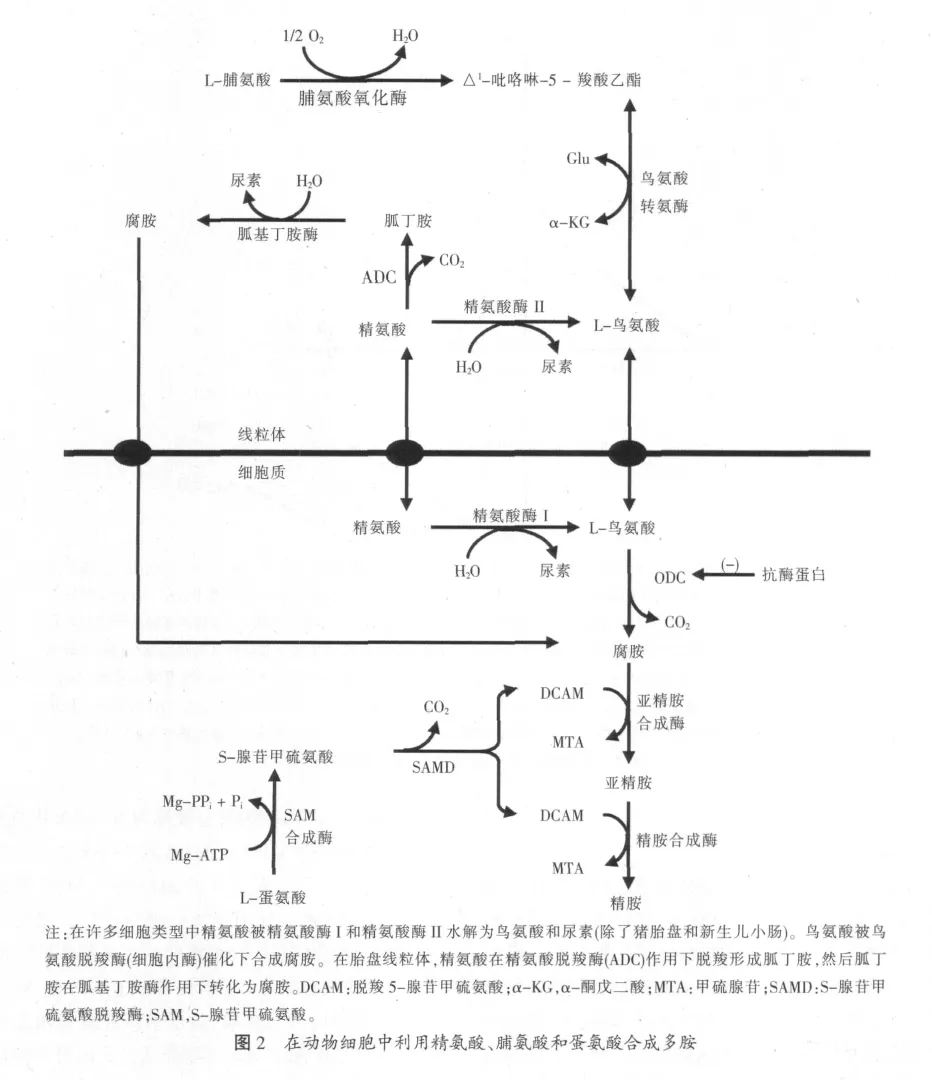
在哺乳动物,精氨酸的另一种代谢途径是合成胍丁胺。在细胞特定区域,精氨酸在精氨酸脱羧酶(ADC)作用下脱羧产生胍丁胺。胍丁胺在胍丁胺酶(一种线粒体酶)作用下降解生成腐胺。人们早已了解到,在植物和细菌中精氨酸经由ADC这一代谢途径,但是这条途径在早前被认为不存在于动物中,直到1994年在老鼠大脑中发现ADC。哺乳动物细胞中ADC基因的表达通过人ADC的克隆和鉴定也已得到证实。ADC与ODC1具有48%的氨基酸序列同源性,但是不具有ODC1的活性。ADC也存在于肝脏、肾脏、肾上腺和巨噬细胞中,但不存在于猪小肠中。目前,ADC是否在猪胎盘或者胎儿组织中表达还不清楚。
精氨酸是合成肌酸的一种氨基酸。精氨酸的胍基在精氨酸甘氨酸脒基转移酶(AGAT)作用下转移到甘氨酸的氨基上形成胍基乙酸。胍基乙酸N-甲基转移酶利用S-腺苷甲硫氨酸(SAM;一种蛋氨酸的代谢产物)作为甲基供体将胍基乙酸转化为肌酸。AGAT是肌酸合成的第一个限速酶。尽管肝细胞能快速地将胍基乙酸转化为肌酸,但是肌酸不能直接在肝脏中由它的前体(精氨酸、甘氨酸或者蛋氨酸)产生。在大鼠上,AGAT主要在肾脏中表达,然而高活性的胍基乙酸N-甲基转移酶却存在于肝脏中。这表明了合成肌酸需要内部器官间的合作。我们的研究数据表明肌酸的从头合成是怀孕母猪利用精氨酸的主要途径(见表1)。
4 精氨酸及其代谢产物在怀孕母猪的生理功能
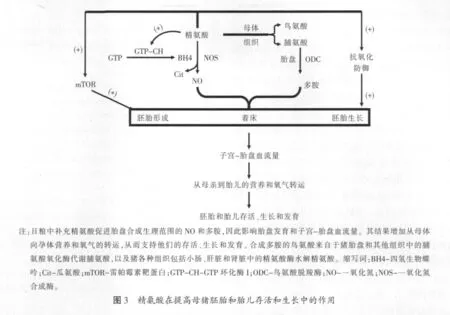
多个代谢途径和独特的化学特征使精氨酸在心血管、神经系统、内分泌和免疫系统中具有多种功能。此外,生理水平的精氨酸激活MTOR细胞信号途径,在蛋白质合成、细胞增殖和细胞内细胞骨架结构的调节中起重要作用。NO作为一种内皮衍生舒张因子调节血液流入组织(包括子宫和胎盘),因此营养物质从怀孕母猪转移给胎儿。NO同样刺激胎盘血管生成和胎盘血管生长。NO通过与可溶性鸟苷酸环化酶的血红素结合,从而增加了从鸟苷-5'-三磷酸(GTP)转化生成的环鸟苷酸(cGMP)。cGMP激活cGMP依赖性蛋白激酶和靶蛋白的磷酸化,从而引起一系列的生理反应(例如:血管平滑肌细胞的松弛和线粒体生物合成)。另外,NO通过减少内皮细胞产生抑制性内皮素-1(一种血管收缩剂)防止白细胞黏附于血管内皮细胞和血小板。
NOS基因敲除小鼠已被证明是评估雌性动物繁殖过程中NO生理功能的一种极好的模型系统。其结果表明,NO是排卵、胚胎发育和着床所必需的物质。NOS2缺乏对发情周期的长度或者排卵率没有显著的影响。然而,小鼠敲除NOS3后,发情周期增加和排卵率显著降低。与野生型小鼠相比,NOS3基因敲除小鼠植入的胚泡的数量更低。为了获得一个成功的怀孕结果,通过子宫血管壁的重构来增加子宫血流量是必需的。因此,小鼠在怀孕期间敲除NOS3基因会降低子宫动脉的重构能力。这可能是NOS3基因敲除小鼠胎儿和新生儿存活降低的主要原因。NOS3基因敲除小鼠在着床率和早期发展的着床点没有变化,但其孕中期的活胚胎和末期的窝产仔数被降低。这些损害是与缺乏NOS3基因表达后蜕膜血管细胞减少和细胞壁异常增厚相关的。所以这些研究结果表明,生理水平的NO是怀孕成功所必需的。
精氨酸可能调节分别由甘氨酸和半胱氨酸合成的CO和H2S。这些气体在心血管系统中具有重要的生物学功能。NO刺激血管组织中H2S的产生,而H2S调节主动脉和血管内皮细胞的精氨酸-NO通路。另外,内皮NO在CO-和可能的H2S-诱导血管扩张时起到一个放纵的作用。因此,各种气体信号途径间有可能相互影响,生理水平的NO与其他气体性血管活性因子协同调节血管张力和血流动力学。
多胺是动物健康怀孕必不可少的。在小鼠怀孕6~8 d期间,即胚泡刚刚着床后(怀孕4~5 d)ODC1活性急剧增加。子宫中的腐胺和亚精胺的水平也发生相似的变化。与对照组相比,在怀孕5~8 d小鼠的饮水中添加2%的DL-α-二氟甲基鸟氨酸盐(α-DFMO;一种ODC1不可逆抑制剂)阻止了胚胎怀孕18 d的发育和造成流产。在孕期,多胺的作用可能涉及到调节类固醇激素的合成、胚胎、胎盘和胎儿的生长和发育。在排卵后卵巢ODC1的活性立即增加,因为这是增加黄体分泌孕激素所需要的。阻断未成熟的雌性小鼠ODC1的活性,也抑制卵巢的生长和囊状卵泡的形成。α-DFMO处理组在发情期孕酮和雌激素的浓度降低了,从而抑制了类固醇生成因子1、细胞色素胆固醇侧链裂解酶和卵巢中类固醇激素合成急性调节蛋白基因的表达。而且,在胚胎滞育期,多胺也逐渐耗尽,这是一种在胚泡植入前胚泡发育抗逆的难以解释的现象。这些结果表明多胺在胚胎形成和胚泡着床上起至关重要的作用。
5 猪日粮补充精氨酸对胚胎/胎儿存活和生长的有利作用
在前面概念的指导下,在怀孕早期尿囊液中异常丰富的精氨酸对胚胎和胎儿存活和生长具有重要的生理功能。Mateo等测定了给怀孕母猪补充精氨酸是否会增加出生窝产仔数。这些作者发现在怀孕30~114 d的日粮中补充0.83%的精氨酸 (相当于1%精氨酸盐酸盐,每头母猪每天16.6 g精氨酸)增加每窝产活仔猪数到2头和窝初生重到24%。
给怀孕母猪基础日粮中(12%CP,0.70%精氨酸和0.57%赖氨酸;消化率为85%)添加0.83%精氨酸的理由有如下几点。第一,由于碱性氨基酸间的潜在的营养不平衡,日粮中总精氨酸含量应该低于2%(以饲喂90%干物质为基础),因此日粮中可消化的精氨酸与赖氨酸的比例应低于3。第二,怀孕母猪经口服进入小肠腔内和血液的精氨酸的半衰期较短(1.7 h),因为:①小肠代谢大量精氨酸(占日粮摄入量的40%);②在组织中多种途径快速利用精氨酸,因此需要补充充足的精氨酸在4 h内维持较高水平的精氨酸 (比未补充精氨酸的母猪的血浆中精氨酸浓度至少高25%)。第三,未补充精氨酸的母猪在采食1 h后血浆精氨酸的浓度为240 μM。在怀孕母猪上以精氨酸代谢动力学为基础,要实现补充精氨酸的怀孕母猪在采食4 h后血浆中精氨酸的浓度比未补充精氨酸母猪血浆中精氨酸浓度高25%,这就要求补充精氨酸的母猪在采食1 h后血浆精氨酸的浓度最高值为500 μM。那么日粮中可消化精氨酸的浓度则需要增加约130%,即在日粮中需要补充0.78%的精氨酸。为了方便起见,我们决定在怀孕母猪日粮中补充1%精氨酸盐酸盐(0.83%精氨酸)。
几个试验研究结果表明:给怀孕母猪补充精氨酸有效地提高了胚胎和胎儿的存活率(见表2)。首先,在实际生产条件下,在初产母猪和经产母猪怀孕22~114 d的日粮中补充0.83%的精氨酸,其结果增加了母猪胎盘重量(16%),每窝活产仔数(1.1)和每窝产活仔猪的初生重(1.7 kg)。其次,在实际生产条件下,给初产和经产母猪怀孕14~28 d日粮中补充1%精氨酸,其结果显示在初生时可增加产活仔数约1头。第三,与对照组初产母猪相比,在怀孕14~25 d日粮中补充0.4%或者0.8%的L-精氨酸组的胎盘生长增加21%~34%,每窝可存活的胎儿数量增加约2头。第四,在超排卵初产母猪怀孕14~28 d日粮中补充1%的精氨酸,怀孕70 d时每窝胎儿的数量增加3.7头。第五,在初产母猪怀孕17 d时开始补充1%的精氨酸,持续16 d,其结果表明每窝产活仔猪数增加1.2头。最后,在怀孕90~114 d的母猪日粮中补充0.83%的精氨酸,每窝产活仔猪的平均初生重增加16%。

表2 日粮补充精氨酸对怀孕母猪窝产仔数和仔猪初生重的影响
在大鼠怀孕初期或者中期的日粮中补充精氨酸也能增加胚胎存活率和窝产仔数。另外,给感染猪圆环病毒2型小鼠的日粮中补充精氨酸可降低其胚胎和胎儿的死亡。此外,给孕羊静脉注射精氨酸能提高胚胎的存活率。综上所述,这些结果都强有力地支持精氨酸通过多种机制:MTOR信号、抗氧化防御、胎盘生长(包括血管生长)和子宫-胎盘血流量,在提高哺乳动物胚胎/胎儿存活率上起到重要的作用(见图3)。增加活产仔猪数将会显著提高雌性动物繁殖和泌乳性能。另外,减少低初生体重仔猪的数量将大大提高新生仔猪的管理,最大限度地提高仔猪断奶前的存活和成长。
补充精氨酸的时间和剂量是精氨酸提高怀孕母猪繁殖性能的关键因素,这就说明在交配后立即补充精氨酸对猪胚胎存活和生长有不良影响。与对照初产母猪组相比,在怀孕0~25 d母猪日粮中补充0.8%L-精氨酸,其子宫重量下降(-20%),总胎儿数量下降(-24%),黄体数下降(CL;-17%),总胎儿重下降(-34%),总尿囊和羊水的量下降(-34%~42%),母体血浆中孕酮浓度下降(-33%),以及总孕激素下降(-35%),雌激素酮下降(-40%)和尿囊液中的硫酸雌酮下降(-37%)。在卵巢中,卵泡发育伴随CL的形成,成熟卵母细胞的排出依赖于有丝分裂的原活化蛋白激酶3和1[也被称为细胞外调节蛋白激酶1和2(ERK 1/2)]和肝脏受体类似物1(Lrh1)。有证据表明,Lrh1是小鼠通过涉及NOS3基因表达机制来排卵的必不可少的一种受体。根据现有的资料,我们假设通过补充精氨酸来增加NO的产生,可能会损害猪卵巢中ERK1/2信号和Lrh1的功能,从而减少排卵、CL的数量和母体血浆中孕酮的浓度,因此降低了卵泡的数量。在正常饲养条件下(例如:固定的2 kg玉米-豆粕型基础日粮),怀孕母猪CL减少是很少发生的,因为CL是建立和维持怀孕所需的孕激素的主要来源。前列腺素F2a(PGF2α)是一种可以消退CL的物质,从子宫上皮细胞分泌的PGF2α进入子宫循环(内循环)而不是进入子宫腔(外分泌)。PGF2α的产生被认为是调节孕体雌激素的分泌。NO通过上调环氧化酶II(一种前列腺素合成的关键酶)的表达也能刺激与PGF2α合成有关的生物化学反应。因此,母猪交配后立即补充L-精氨酸,促进动物系统中NO的合成,可能通过依赖PGF2α的途径引起CL的减少。另外,因为猪排卵通常发生在发情后约44 h,在发情后24 h内补充L-精氨酸可能会抑制或妨碍排卵,因此降低初产母猪CL的数量。
Greiner等和Zier-Rush等报道,母猪日粮中补充超过1%或者每天每头25 g精氨酸对母猪的繁殖性能没有有利的影响。例如,在母猪怀孕后18~34 d或者75~115 d给母猪每头每天补充28 g精氨酸并没有增加窝产仔数,甚至减少仔猪初生重。在缺乏基础日粮中蛋白质、精氨酸和其他氨基酸含量等数据时,我们很难解释这些结果(见表2)。在Greiner等和Zier-Rush等试验研究中,精氨酸在怀孕母猪上不能起到有效作用的原因可能是:①日粮中氨基酸之间的不平衡,尤其是精氨酸与赖氨酸的拮抗作用;②日粮中氮的摄入量增加,可能导致氨气的增加,从而降低子宫-胎盘血流量,损害柠檬酸循环,引起母体及其胚胎/胎儿的代谢负担;③在配种后第18 d开始补充精氨酸错过了早期孕体着床时期。这些负面结果都不应该否认精氨酸对母猪繁殖性能的有利作用。相反的是,它们强调的是了解繁殖生物学基础知识及氨基酸的营养和生物化学对设计平衡日粮和提高全球养猪业的重要性。
6 结论和观点
胚胎和胎儿的损失是养猪业的一个主要问题。通过遗传和动物育种方法来提高窝产仔数一直没有取得很大的进展。在怀孕的围植入期,孕体发育和植入失败被认为是胚胎损失的主要原因。精氨酸是一种在生理学上有多功能的氨基酸。它是合成鸟氨酸、多胺(腐胺、精胺和亚精胺)、脯氨酸、谷氨酰胺、肌酸、胍丁胺和NO的含氮前体物质,这些生物分子在刺激细胞增殖和迁移、细胞重构、血管生成、血管扩张和各种细胞信号途径中发挥关键作用。更重要的是,精氨酸和它的代谢产物在繁殖、包括增强胚胎和胎儿存活上具有重要的作用。除了增加窝产仔数外,日粮中补充精氨酸的益处是提高了怀孕母猪的免疫功能,由此防止疾病感染以及减少胚胎和胎儿的损失。因此,最近NRC将精氨酸作为怀孕母猪的一种条件性必需氨基酸。
许多精心设计的试验研究都证明日粮中补充精氨酸对母猪的繁殖性能具有有利的作用。然而,许多问题仍待解决。例如,精氨酸的有利作用是直接通过它的营养介导或是通过它的代谢产物如NO、多胺、肌酸或者胍丁胺来介导?此外,精氨酸在子宫和胎盘是怎样调节基因表达来提高营养素的转运和胎盘的生长?提高胚胎存活率的补充精氨酸的最佳时机?在怀孕早期、中期和后期阶段,配制日粮的最理想的氨基酸模式?不同品种的怀孕母猪对日粮中补充氨基酸的反应是否不同?为了通过补充合适的精氨酸日粮来有效地提高胚胎存活率和胎儿的生长,以上问题都必须得到肯定的回答。
[1]Bazer F W,Song G W,Kim J Y,et al.Uterine biology in sheep and pigs[J].J.Anim.Sci.Biotech.,2012,3:23.
[2]USDA:Changes in the U.S.swine industry.National Agricultural Statistics Service home page.Available at:http://www.usda.gov/nass.2009.
[3]Pope WF:Embryonic mortality in swine.In:Zavy M,Geisert R(eds)Embryonic mortality in domestic species.CRC Press,Boca Raton,FL,1994:53-77.
[4]Wu G,Bazer F W,Wallace J M,et al.Intrauterine growth retardation:Implications for the animal sciences[J].J.Anim.Sci.,2006,84:2316-2337.
[5]Bazer F W,Spencer T E,Johnson G A,et al.Comparative aspects of implantation[J].Reproduction,2009,138:195-209.
[6]Johnson R.History of litter size selection.www.nsif.com/conferences/2000/johnson.html,2000.
[7]Rothschild M F.Genetics and reproduction in the pig[J].Anim.Reprod.Sci.,1996,42:143-151.
[8]Town S C,Patterson J L,Pereira C Z,et al.Embryonic and fetal development in a commercial dam-line genotype[J].Anim.Reprod.Sci.,2005,85:301-316.
[9]Wu G,Bazer F W,Davis T A,et al.Arginine metabolism and nutrition in growth,health and disease[J].Amino Acids,2009,37:153-168.
[10]Wu G,Morris S M Jr.Arginine metabolism:nitric oxide and beyond[J].Biochem,J.,1998,336:1-17.
[11]Mateo R D,Wu G,Bazer F W,et al.Dietary L-arginine supplementation enhances the reproductive performance of gilts[J].J.Nutr.,2007,137:652-656.
[12]De Blasio M,Roberts C,Owens J,et al.Effect of dietary arginine supplementation during gestation on litter size of gilts and sows.http://www.australianpork.com.au.Accessed July 28,2009.
[13]Gao K G,Jiang Z Y,Lin Y C,et al.Dietary L-arginine supplementation enhances placental growth and reproductive performance in sows[J].Amino Acids,2012,42:2207-2214.
[14]Wu X,Yin Y L,Liu Y Q,et al.Effect of dietary arginine and N-carbamoylglutamate supplementation on reproduction and gene expression of eNOS,VEGFA and PlGF1 in placenta in late pregnancy of sows[J].Anim Reprod.Sci.,2012,132:187-192.
[15]Ramaekers P,Kemp B,van der Lende T.Progenos in sows increases number of piglets born[J].J.Anim.Sci.,2006,84(Suppl.1):394(Abstract).
[16]Campbell R.Pork CRC-NZ Seminar Series:Arginine and reproduction.http://www/nzpib.co.nz.Accessed July 28,2009.
[17]Bérard J,Bee G.Effects of dietary l-arginine supplementation to gilts during early gestation on foetal survival,growth and myofiber formation[J].Animal,2010,4:1680-1687.
[18]Zeng X F,Wang F L,Fan X,et al.Dietary arginine supplementation during early pregnancy enhances embryonic survival in rats[J].J.Nutr.,2008,138:1421-1425.

