丙型肝炎病毒Core蛋白类病毒颗粒的表达及纯化
李 祥 邹立林 吕建新 高基民
(温州医学院浙江省医学遗传学重点实验室 浙江省模式生物技术与应用重点实验室,浙江 温州 325035)
丙型肝炎病毒Core蛋白类病毒颗粒的表达及纯化
李 祥 邹立林 吕建新 高基民
(温州医学院浙江省医学遗传学重点实验室 浙江省模式生物技术与应用重点实验室,浙江 温州 325035)
目的 通过PCR将丙肝病毒(HCV)Core与蜂毒素信号肽(Mel)进行融合,构建到pIZ/V5载体上获得pIZ/V5-Core-Mel表达载体。方法 将pIZ/V5-Mel-core稳定转染Sf9细胞,经Zeocin抗性筛选,获得单克隆抗性细胞株。RT-PCR检测结果表明获得稳定表达Mel-core的细胞系Sf9-Core。对稳定细胞系Sf9-Core的上清进行离心纯化并Western印迹检测。结果 在上清离心纯化的样品中有HCV Core形成的类病毒颗粒(VLPs)。透射电镜显示Core蛋白能自组装成直径约30 nm的球形颗粒。结论 该研究成功构建了HCV Core与蜂毒素信号肽的融合蛋白并在Sf9细胞稳定表达,在细胞培养的上清中获得了VLPs。
丙型肝炎病毒;Core蛋白;类病毒颗粒
纳米颗粒作为基因转运载体,将DNA和RNA等基因治疗分子包裹在纳米颗粒之中或吸附在其表面,同时也在颗粒表面耦联特异性的靶向分子,如特异性配体、单克隆抗体等,通过靶向分子与细胞表面特异性受体结合,在细胞摄取作用下进入细胞内,实现安全有效的靶向性基因治疗。已有研究表明以纳米颗粒为基因转运载体在基因治疗中显示了良好的运用前景。丙型肝炎病毒归属于黄病毒科丙型肝炎病毒属〔1〕,为有包膜的单股正链RNA病毒,基因组全长9.4~9.6 kb,包括一个单一的9 030~9 099 nt的大开放阅读框,其编码一个3 010~3 033 aa的多聚蛋白前体〔2~5〕,从N端到C端,HCV蛋白的排列顺序为:C-E1-E2-p7-NS2-NS3-NS4A-NS4B-NS5A-NS5B。 电 镜 下HCV为直径60~75 nm的颗粒,其表面有8~15 nm的刺突〔6〕,NP-40处理除去包膜后可得直径为45~55 nm的二十面体的核衣壳〔7,8〕,而核衣壳蛋白就是Core蛋白。HCV Core蛋白是构成病毒粒子的重要成分,同时也扮演着重要的调控病毒本身以及病毒与宿主细胞相互作用的重要角色。本研究利用HCV Core蛋白这种自我组装成类病毒颗粒的特性,构建了HCV Core与蜂毒素信号肽的融合蛋白并在Sf9细胞稳定表达,同时将形成的类病毒颗粒(VLPs)分泌到细胞外,为其用于药物和基因转运的纳米颗粒载体研究奠定基础。
1 材料与方法
1.1 细胞系 实验所使用的昆虫细胞系为Sf9。Sf9来源于Spodoptera frugiperda(草地夜蛾)卵巢细胞,由中国科学院武汉病毒研究所中国典型培养物保藏中心(CCTCC,武汉)。Sf9传代培养采用25 cm2的培养瓶以单层细胞的形式多次传代,培养基为含10%胎牛血清的Grace培养基(Gibco-BRL公司),培养温度为27℃。
1.2 主要试剂和仪器 限制性核酸内切酶、核酸分子量Marker,T4 DNA连接酶等及其配套缓冲溶液均购自TaKaRa公司。PCR产物回收试剂盒和质粒纯化试剂盒购自V-GENE公司。HCV Core抗体和碱性磷酸酶标记的羊抗小鼠IgG购自深圳晶美生物公司;NBT和BCIP溶液购自碧云天生物公司。
1.3 pIZV5-Mel-Core的构建 以pBRTM/HCV1-3011为模板进行PCR特异性扩增目的片段。上游引物P1:5'GGG GAA TTC ATG AAA TTC TTA GTC AAC GTT GCC CTT GTT TTT ATG GTC GTG TAC ATT TCT TAC ATC TAT GCG ATG AGC ACG AAT CCT AAA C3',下游引物 P2:5'GGG GCG GCC TAG GCT GAA GCG GGC ACA 3'(斜黑字体为酶切位点,黑粗字体为Mel序列)。PCR条件为:94℃变性5 min,94℃ 45 s,55℃ 45 s,72℃ 50 s,72℃ 聚合延伸5 min,共循环30次。同条件做一管阴性对照。用PCR产物回收试剂盒对PCR产物回收纯化,然后与pMD-18T进行连接。用CaCl2法转化大肠杆菌DH5α,于LB培养基中培养扩增后,用质粒快速提取试剂盒提取质粒用于核酸测序。经测序正确后,用EcoRⅠ和NotⅠ酶切pMD-18TMel-Core质粒回收Mel-Core目的片段,克隆到pIZV5载体的EcoRⅠ和NotⅠ位点,构建成pIZV5-Mel-Core。
1.4 Zeocin对Sf9细胞最小致死浓度确定 在35 mm的培养皿中接种1×106的Sf9细胞,28℃培养过夜;弃去上层培养基,加入2 ml新鲜的培养基,依次加入不同浓度的Zeocin:0、50、200、400和600 μg/ml,每个浓度进行3复孔观察。28℃培养箱持续培养10~14 d,观察细胞死亡情况,以高于杀死全部细胞最小Zeocin浓度的一个梯度为筛选浓度。以筛选浓度的一半为克隆细胞维持培养的浓度。
1.5 pIZV5-Mel-Core稳定转染Sf9细胞 在35 mm的培养皿中接种1×106的Sf9细胞,28℃培养过夜;弃去上层培养基,加入1 ml不含血清的培养液洗涤细胞两次,再加入1 ml不含血清的培养基于28℃培养0.5 h以上;在细胞室中将1 μg DNA与8 μl cellfectin分别用无血清 Grace稀释至50 μl,5 min后将DNA加入稀释后的cellfectin中,每隔5 min轻轻混匀一次,45 min后在聚丙烯管中轻轻加入900 μl不含血清的Grace培养基,混匀。弃去35 mm培养皿中的培养基,加入含有转染混合物的Grace培养基,28℃温箱培养;6 h后用含10%血清的Grace培养替换原有的培养基。2 d后将细胞传代60 mm培养皿中,用10%FBS的 Grace培养基(含600 μg/ml Zeocin)培养细胞,每3天换液,筛选培养2~3 w。利用细胞克隆环获取细胞克隆,转入24孔细胞培养板培养。待24孔板内的克隆细胞密度达80%时,依次转入6孔板、60 mm,100 mm平皿进行扩大培养。平皿内的克隆细胞密度达80%~90%时,改用10%FBS的Grace培养基(含300 μg/ml Zeocin)维持培养细胞。2 w后,冻存部分细胞于液氮中,剩余细胞继续用用10%FBS的Grace培养基(含300 μg/ml Zeocin)维持培养。
1.6 稳定转染细胞株Sf9-Core的鉴定 在35 mm的培养皿中接种1×106的稳定转染细胞Sf9-Core,24 h后收取细胞。总RNA按照Trizol(Gibco-BRL)操作指南进行提取。反转录反应采用Promega公司M-MLV反转录酶,用oligo(dT)15引物引导第一链cDNA的合成。反转录的cDNA作为PCR模板,用HCV Core特异性引物P3:5'ATG AGC ACG AAT CCT AAA C 3'和P4:5'TGT CGT GGC GAT TGT AGC ACG 3'进行目的基因的扩增。反应程序为:94℃预变性5 min进入循环过程;94℃变性30 s,55℃ 退火 30 s,72℃ 延伸 1 min,30 个循环。最后以72℃延伸10 min。取3 μl在0.8%的琼脂糖凝胶中电泳,SYNGENE凝胶成像系统观察并分析结果。
1.7 稳定细胞株Sf9-Core类病毒颗粒的纯化 用100 mm平皿进行大量培养 Sf9-Core细胞,当平皿内的细胞密度达80% ~90%时收细胞上清。5 000 r/min离心10 min以除去细胞碎片。收集上清,用0.45 μm滤器过滤。35 000 r/min离心4 h,去上清,将沉淀融于PBS。用30%,40%,50%蔗糖铺好梯度,4℃放置过夜,将融于 PBS的沉淀缓慢加在最上层,35 000 r/min离心4 h。在30%与40%蔗糖之间有一条明显的条带。缓慢将此条带吸出,与PBS混匀,35 000 r/min离心4 h,以去除蔗糖。沉淀融于PBS,置于4℃保存,备用。
1.8 纯化产物透射电镜鉴定 取少量纯化的样品滴于铜网,2%磷钨酸负染2 min,室温下干燥5 min,样品置于透射电子显微镜(H-7000FA)下观察颗粒形态。
1.9 纯化产物Western印迹鉴定 用鼠抗HCV Core抗体按1∶1 000进行稀释,与纯化的类病毒颗粒进行Western杂交,以此来检测纯化的类病毒颗粒上Core蛋白的存在。
2 结果
2.1 pIZV5-Mel-Core载体的构建 以pBRTM/HCV1-3011为模版,以P1和P2为引物通过PCR扩增获得Mel-Core片段(图1),然后克隆到pMD-18T载体上。测序正确后经EcoRⅠ和NotⅠ酶切克隆到pIZV5上获得pIZV5-Mel-Core(图2)。
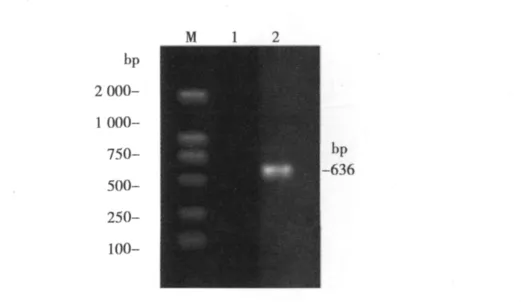
图1 Mel-HCV Core PCR结果

图2 pIZV5-Mel-Core酶切结果电泳鉴定
2.2 Zeocin筛选浓度的确定 培养2 w后,400 μg/ml以上组的CHO细胞已全部死亡,确定600 μg/ml为理想筛选浓度,300、200、50 μg/ml时细胞死亡率分为 95%、80%、60%,其中300 μg/ml为克隆细胞维持培养的浓度。
2.3 pIZV5-Mel-Core稳定转染Sf9细胞及稳定转染细胞株Sf9-Core的筛选鉴定 质粒pIZV5-Mel-Core转染Sf9细胞2 d后,在培养基中加入400 μg/ml的Zeocin。未转染的细胞逐渐死亡,转染外源基因的细胞具有Zeocin抗性存活下来,不断增殖成为细胞克隆。当获得稳定转染细胞Sf9-Core细胞后,用Trizol收集1.5×106的细胞,提取细胞总RNA,用OligodT引物进行反转录,反转录完毕后取部分产物用P3和P4作为引物进行PCR,同时以转染空载体pIZV5的细胞作为阴性对照。RTPCR结果表明,仅在转染组扩增获得636 bp的片段,而对照组无此条带(图3),说明Mel-Core基因片段已经稳定整合到Sf9细胞基因组中。
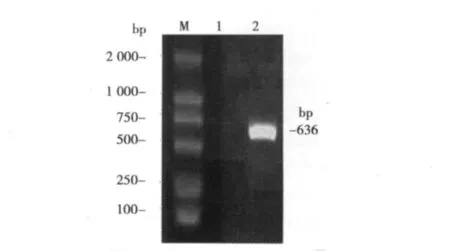
图3 pIZV5-Mel-Core稳定转染Sf9细胞RT-PCR鉴定结果
2.4 HCV Core类病毒颗粒的纯化及鉴定 收集稳定转染细胞Sf9-Core的上清,通过超速离心和梯度离心可得到纯化的类病毒颗粒。TEM电镜观察结果显示离心纯化的产物主要由一种大小均匀、直径约30 nm的球形颗粒构成 (图4)。为确定Core蛋白是否组装入类病毒颗粒,我们用鼠抗HCV Core抗体按1∶1 000稀释,与纯化的类病毒颗粒进行Western杂交。结果显示有一条约23 kD的杂交带存在(图5),表明HCV Core蛋白在类病毒颗粒中的存在。

图4 电镜观察纯化类病毒颗粒
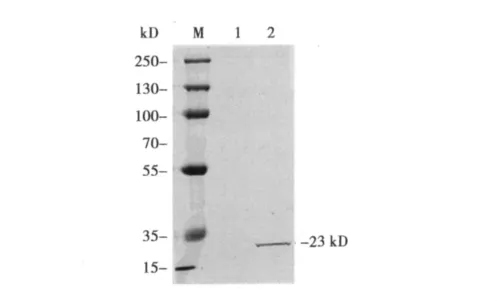
图5 Western印迹检测纯化类病毒颗粒中的HCV Core蛋白
3 讨论
HCV是输血后及散在性的非甲非乙型肝炎(NANBH)的主要病因。全世界目前约有1.7亿人被HCV感染,急性感染者中有80%转为慢性,其中20%在10~20年后将发展为肝硬化,1% ~5%可能发展为肝细胞癌(HCC)〔10〕。到目前为止,尚没有有效的治疗HCV慢性感染的药物和防止HCV感染的疫苗。VLPs和类核衣壳颗粒(CLPs)是不含病毒基组,不具有感染能力的结构,但在某些情况下能有效地产生保护的免疫性来抵抗亲代病毒的感染。如已经在使用的抗HBV的疫苗是用HBV的类病毒颗粒生产的,还有最近使用的人乳突淋瘤病毒(HPV)疫苗也是用它的类病毒颗粒产生的〔10,11〕。同时,VLPs和CLPs也成了药物和基因治疗的载体〔12,13〕。1998年,Baumert等〔14〕人首次利用重组杆状病毒表达系统在昆虫细胞中产生了由HCV结构蛋白表达后自组装形成的类病毒颗粒,其直径40~60 nm,存在于细胞质的内质网来源的空泡里,浮力密度等物化性质与病人血清中的病毒颗粒很相似。Falcon等〔15〕人则在毕赤酵母中表达了23 kD和21 kD两种形式的Core蛋白,并发现其可包装成直径20~30 nm的类核衣壳颗粒;后来又有人将HCV结构蛋白在昆虫细胞和哺乳动物细胞中表达,得到了HCV的VLPs〔16〕。但这些病毒颗粒都存在于细胞质中,随后病毒颗粒的纯化费时又浪费金钱,更重要的是纯化过程会改变VLPs的形态和活性给后续的研究带来非常不便。
本研究利用HCV Core蛋白这种自我组装成VLPs的特性,构建了HCV Core与蜂毒素信号肽的融合蛋白并在Sf9细胞稳定表达,并在细胞培养的上清中获得了类病毒颗粒VLPs,为后续的外源蛋白影响VLPs形成的机制及其纳米颗粒的应用提供理论和实验依据。单独利用HCV的Core蛋白获得HCV的类病毒颗粒,这为HCV形态发生、病毒与宿主细胞的相互作用以及寻找病毒组装的抑制子提供了思路;同时这也为纳米药物的设计提供了新的途径和平台。
1 Miller RH,Purcell RH.Hepatitis C virus shares amino acid sequence similarity with pestiviruses and flaviviruses as well as members of two plant virus supergroups〔J〕.Proc Natl Acad Sci USA,1990;87(6):2057-61.
2 Choo QL,Kuo G,Weiner A,et al.Isolation of a cDNA clone derived from a blood-borne non-A,non-B viral hepatitis genome〔J〕.Science,1989;244(1):359-62.
3 Yamada N,Tanihara K,Takada A,et al.Genetic organization and diversity of the hepatitis C virus〔J〕.Virology,1996;223(1):255-61.
4 Kato N,Hijikata M,Oot suyama Y.Molecular cloning of the human hepatitis C virus genome from Japanese patients with non2A,non2B hepatitis〔J〕.Proc Natl Acad Sci USA,1990;87(24):9524-8.
5 Takamizawa A,Mori C,Fuke I,et al.Structure and organization of the hepatitis C virus genome isolated from human carriers〔J〕.J Virol,1991;65(3):1105-13.
6 Li X,Jeffers LJ,Shao L,et al.Identification of hepatitis C virus by immunoelectron microscopy〔J〕.J Viral Hepat,1995;2(5):227-34.
7 Kaito M,Watanabe S,Tsukiyama-Kohara K,et al.Hepatitis C virus particle detected by immunoelectron microscopic study〔J〕.J Gen Virol,1994;75(7):1755-60.
8 Prince AM,Huima-Byron T,Parker TS,et al.Visualization of hepatitis C virions and putative defective interfering particles isolated from low-density lipoproteins〔J〕.J Viral Hepat,1996;3(1):11-7.
9 Saito I,Miyamura T,Ohbayashi A.Hepatitis C virus infection is associated with the development of hepatocellular carcinoma〔J〕.Proc Natl Acad Sci USA,1990;87(17):65472-549.
10 Harro CD,Pang YY,Roden RB,et al.Safety and immunogenicity trial in adult volunteers of a human papillomavirus 16 L1 virus-like particle vaccine〔J〕.J Natl Cancer Inst,2001;93(4):284-92.
11 Koutsky LA,Ault KA,Wheeler CM,et al.A controlled trial of a human papillomavirus type 16 vaccine〔J〕.N Engl J Med,2002;347(21):1645-51.
12 Takuya Shishido,Masaru Muraoka,Masakazu Ueda,et al.Secretory production system of bionanocapsules using a stably transfected insect cell line〔J〕.Appl Microbiol Biotechnol,2006;73(3):505-11.
13 Dongwei Yu,Chie Aman,Takayuki Fukuda,et al.The specific deliveryof proteins to human liver cells by engineered bio-nanocapsules〔J〕.FEBS,2005;272(14):3651-60.
14 Baumert TF,Ito S,Wong DT.Hepatitis C virus structural proteins assemble into virus like particles in insect cells〔J〕.J Virol,1998;72(5):3827-36.
15 Falcon V,Acosta-Rivero N,Chinea G.Ultrastructural evidences of HCV infection in hepatocytes of chronically HCV infected patients〔J〕.Biochem Biophys Res Commun,2003;305(4):1085-90.
16 Malika Ait-Goughoulte,Christophe Hourioux,Romuald Patient,et al.Core protein cleavage by signal peptide peptidase is required for hepatitis C virus-like particle assembly〔J〕.J Gen Virol,2006;87(4):855-60.
〔2011-12-13收稿 2012-03-12修回〕
(编辑 曹梦园)
Q7
A
1005-9202(2012)21-4700-04;
10.3969/j.issn.1005-9202.2012.21.042
浙江省自然科学基金(No.Y208676)
吕建新(1963-),男,博士,教授,主要从事临床检验诊断和分子诊断技术研究。
李 祥(1978-),男,博士,副教授,主要从事分子病毒学研究。

