三氧化矿物凝聚体对成人牙髓干细胞增殖和分化的影响
刘学军,杨良丰,史 璐,任延方,岳阳丽,吉雅丽,王庆端
(1.郑州大学口腔医学院,河南郑州450052;2.美国罗切斯特大学牙医学院,罗彻斯特14627;3.郑州大学医药科学研究院,河南郑州450052)
三氧化矿物凝聚体(mineral trioxide aggregate,MTA)是广泛应用于临床的一种新型生物材料,可用于活髓切断、髓室底穿孔修补、根尖诱导形成和根尖倒充填等多个治疗领域,并取得了令人满意的治疗效果[1-2],虽然大量临床研究报道了关于MTA的疗效,但其作用机制迄今尚不明确。
Takita等[3]研究发现,MTA能促进成人牙髓细胞增殖和分化。Paranjpe等[4]研究发现,MTA能诱导牙髓细胞向成牙本质细胞分化。但是在上述研究中并没有明确指出MTA是对牙髓组织中的何种细胞发生作用的,考虑到牙髓组织中的成牙本质细胞和成纤维细胞均属于终末细胞,而牙髓干细胞是存在于牙髓组织中且具有多向分化潜能的干细胞[5],因而推测MTA可能作用于牙髓组织中的牙髓干细胞。有鉴于此,本研究拟通过体外培养成人牙髓干细胞(human dental pulp stem cells,hDPSCs),观察不同浓度MTA对其增殖和分化的影响以验证这种推测,同时初步探讨MTA作用机制。
1 材料和方法
1.1 牙髓干细胞的培养
取第4代hDPSCs(第四军医大学口腔医学院惠赠)用含100 mL/L胎牛血清(fetal bovine serum,FBS)的α-MEM(Hyclone,美国)培养基在37℃标准环境下进行培养,当细胞生长到80% ~90%时,用胰蛋白酶消化,以1×104/mL的密度接种进行传代培养。
1.2 MTA浸提液的制备
参照 Hakki等[6]的方法,取 0.4 g MTA(Dentsply,美国)加入20 mL无胎牛血清的α-MEM培养液,在恒温振荡器内37℃,200 r/min振荡24 h后,2 000 r/min离心 5 min,取上清液,0.22 μm滤膜过滤除菌,即制成 20 mg/mL MTA 浸提液,然后再用α-MEM分别稀释成2 mg/mL和0.2 mg/mL;同时同法制备2 mg/mL的Ca(OH)2浸提液,分别4℃保存备用。
1.3 不同浓度MTA对hDPSCs增殖影响的观察
取生长良好的第5代hDPSCs,以1×104/mL的细胞密度接种于5块96孔板,加入含100 mL/L FBS的α-MEM培养液,37℃标准环境下培养24 h后,弃原培养液,并将细胞随机分为5组(1个空白对照组,1个阳性对照组和3个实验组),每组复6孔。3个实验组分别加入终末浓度为 20、2、0.2 mg/mL的MTA浸提液;阳性对照组加入终末浓度为2 mg/mL的Ca(OH)2浸提液;空白对照组加入含100 mL/L FBS的α-MEM培养液,继续培养。分别于培养后2、4、6、8 d取各组细胞,参照Kai等[7]的方法,采用MTT法在Model 680酶标仪(BIORAD,美国)上测定各组各孔490 nm波长下的吸光度(OD)值(参考波长为630 nm)。
1.4 不同浓度MTA对hDPSCs分化的影响
1.4.1 不同浓度MTA作用下hDPSCs矿化能力观察
取生长良好的第5代牙髓干细胞以1×104/mL的密度接种于6孔板,按上述1.3的方法随机分为5组并分别加入相应的浸提液,连续培养28 d。参照O h SA[8]的方法进行Von Kossa染色,荧光显微镜观察并摄片。
1.4.2 不同浓度MTA作用下hDPSCs碱性磷酸酶(ALP)活性观察
取生长良好的第5代牙髓干细胞以1×104/mL的浓度接种于96孔板,按上述1.3的方法随机分为5组并分别加入相应的浸提液继续培养。分别于培养6、9、12 d取各组细胞,按照碱性磷酸酶检测试剂盒(南京生物工程研究所)说明,在Model 680酶标仪上测定各组各孔520 nm波长下的吸光度(OD)值(参考波长为630 nm)。
1.4.3 RT-PCR 检测牙本质涎磷蛋白(dentin sialophosphoprotein,DSPP)基因的表达
取第5代牙髓干细胞以1×104/mL接种于6孔板,并随机分为3组(2个实验组和1个空白对照组),2个实验组分别加入终末浓度为2、0.2 mg/mL的MTA浸提液,空白对照组加入含100 mL/L FBS的α-MEM培养液,继续培养。待细胞生长到80% ~90%时收集细胞,按照 RNAiso Plus(Total RNA提取)试剂盒(大连宝生物工程有限公司)说明提取总RNA,测定纯度后按Prime-Script®RT-PCR试剂盒(大连宝生物工程有限公司)说明合成cDNA;运用Primer 5引物设计软件,以DSPP、GAPDH为内参设计引物,经Blast软件比对引物特异性后由大连宝生物工程有限公司合成引物。各组引物序列如下。
DSPP上游引物:5'-GGGACACAGGAAAAGCAGAA-3',下游引物:5'-TGCTCCATTCCCACTAGGAC-3',产物大小98 bp;磷酸甘油醛脱氢酶(GAPDH)上游引物:5'-GAAGGTGAAGGTCGGAGT-3',下游引物:5'-GAAGATGGTGATGGGATTTC-3',产物大小326 bp。然后按照 Prime-Script® RT-PCR试剂盒(TaKaRa,日本)说明书进行RT-PCR,反应体系分别为:10×PCR BufferⅡ5 μL,dNTP Mixture 2 μL,Primer-F 0.5 μL,Primer-R 0.5 μL,TaKaRa Ex Taq HS 0.5 μL,反转录反应液 1 μL,Rnase Free dH2O 加至 50 μL。反应条件为:94 ℃ 2 min,94 ℃ 30 s,48 ℃ 30 s,72 ℃ 45 s,共30个循环,最后72℃延伸6 min。RT-PCR产物经终琼脂糖凝胶电泳,凝胶成像系统(Kodak,美国)成像并拍照。
1.5 统计学分析
使用SPSS 17.0软件对数据进行单因素方差分析,组间两两比较用t检验,检验水准α=0.05。
2 结果
2.1 不同浓度MTA浸提液对hDPSCs增殖的影响
MTA浓度为20 mg/mL时,除培养2 d外,其他时间点的OD值均明显低于其他各实验组及空白对照组,差异有统计学意义(P<0.05);各时间点虽稍高于阳性对照组,但差异无统计学意义(P>0.05)。MTA 浓度为 2 mg/mL 和 0.2 mg/mL 时,2、4、6、8 d各时间点的OD值均明显高于空白对照组和阳性对照组(P <0.05),其中以 2 mg/mL 组最高,与0.2 mg/mL 组相比有显著差异(P <0.05)(表1)。
2.2 Von Kossa染色结果
hDPSCs培养28 d,2 mg/mL MTA组Von Kossa染色阳性并可见钙化结节(图1a、b),其他各组Von Kossa 染色均呈阴性(图 1a、c、d、e),且20 mg/mL MTA组的hDPSCs分解成碎片(图1a)。
表1 不同浓度MTA浸提液对hDPSCs增殖的影响(ODs)
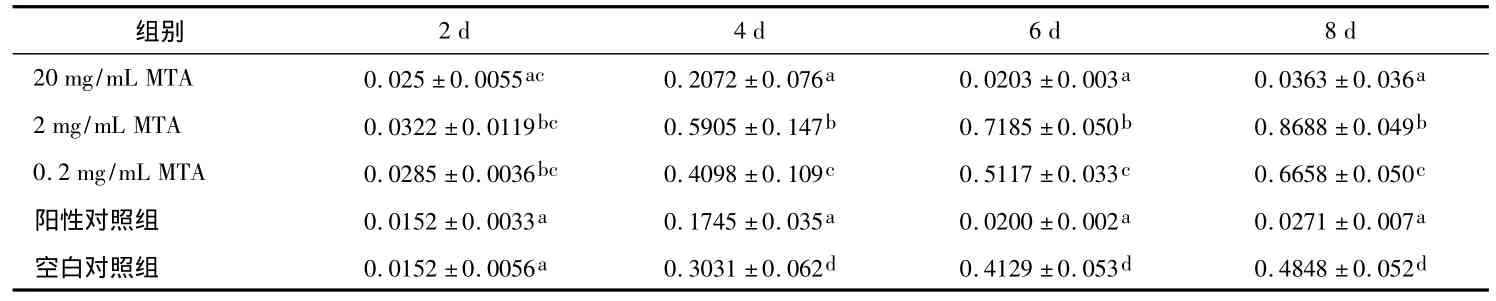
表1 不同浓度MTA浸提液对hDPSCs增殖的影响(ODs)
不同字母为同一时间点内各组相比P<0.05
2 d 4 d 6 d 8 d 20 mg/mL MTA 0.025 ±0.0055ac 0.2072 ±0.076a 0.0203 ± 0.003a 0.0363 ±0.036组别a 2 mg/mL MTA 0.0322 ±0.0119bc 0.5905 ±0.147b 0.7185 ± 0.050b 0.8688 ±0.049b 0.2 mg/mL MTA 0.0285 ±0.0036bc 0.4098 ±0.109c 0.5117 ± 0.033c 0.6658 ±0.050c阳性对照组 0.0152 ±0.0033a 0.1745 ±0.035a 0.0200 ±0.002a 0.0271 ±0.007a空白对照组 0.0152 ±0.0056a 0.3031 ±0.062d 0.4129 ±0.053d 0.4848 ±0.052d
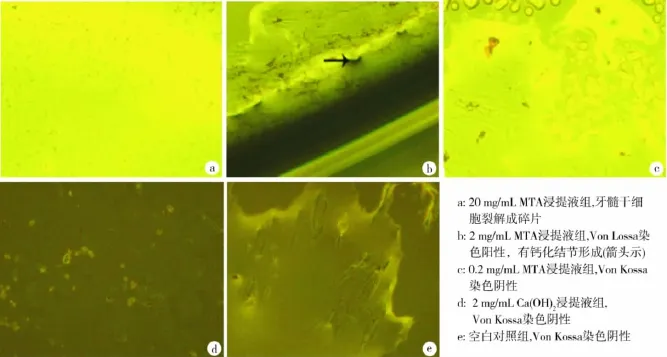
图1 hDPSCs培养28 d后Von Kossa染色(×20)
2.3 碱性磷酸酶活性测定
培养6、9、12 d各时间20 mg/mL MTA浸提液组hDPSCs的ALP活性均明显低于其他实验组和空白对照组(P<0.05),而与阳性对照组相比差异无统计学意义(P >0.05)。2 mg/mL 和0.2 mg/mL MTA浸提液组hDPSCs的ALP活性均明显高于其他各组(P <0.05),其 中 以 2 mg/mL 组 最 高,其 与0.2 mg/mL组相比有统计学差异(P<0.05)(表2)。
表2 不同浓度MTA对hDPSCs ALP活性的影响(ODs)
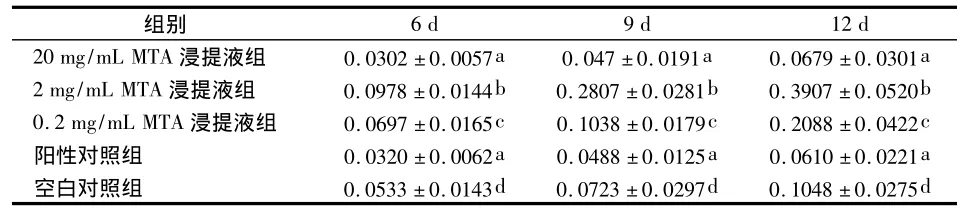
表2 不同浓度MTA对hDPSCs ALP活性的影响(ODs)
不同字母为同一时间点各组相比P<0.05
6 d 9 d 12 d 20 mg/mL MTA浸提液组 0.0302 ±0.0057a 0.047 ±0.0191a 0.0679 ±0.0301a组别2 mg/mL MTA 浸提液组 0.0978 ±0.0144b 0.2807 ±0.0281b 0.3907 ±0.0520b 0.2 mg/mL MTA 浸提液组 0.0697 ±0.0165c 0.1038 ±0.0179c 0.2088 ±0.0422c阳性对照组 0.0320 ±0.0062a 0.0488 ±0.0125a 0.0610 ±0.0221a空白对照组 0.0533 ±0.0143d 0.0723 ±0.0297d 0.1048 ±0.0275d
2.4 RT-PCR检测DSPP基因的表达
2、0.2 mg/mL MTA浸提液组和空白对照组均出现DSPP基因条带,其中2 mg/mL组条带亮度最强,其大小约98 bp,符合引物设计要求(图2)。
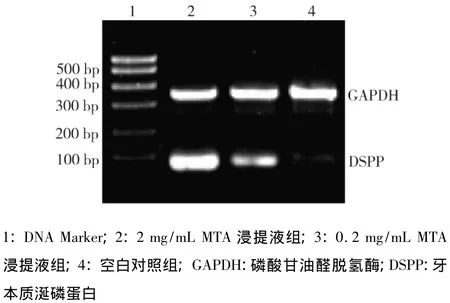
图2 DSPP基因电泳图
3 讨论
MTA因其良好的生物相容性和封闭性已在牙体牙髓及根尖周病治疗中广泛应用,并显示出良好的封闭、消毒、矿化及促进牙本质牙槽骨形成的效果[9-10]。此前虽针对MTA及同类产品展开了如理化特性、组织生物相容性、细胞反应、生理效应等有许多研究和报道,但截至目前为止,关于MTA的作用机制尚不明确。因此本实验通过观察不同浓度的MTA对牙髓干细胞增殖和分化的影响,以期探讨MTA的作用机制。
根据产品所提供的粉液比例(1 g/0.35 mL),本实验选择了与其相近的实验浓度及相差的两组浓度梯度即:2、20、0.2 mg/mL的 MTA 浸提掖与hDPSCS共同培养,结果显示,2 mg/mL MTA组的吸光度值明显高于其他各组,说明适宜浓度的MTA对hDPSCs的生长增殖具有促进作用,这可能主要是由于与氢氧化钙等相比,MTA具有相对较低的基础滴度[11],从而具有较好的细胞相容性;而20 mg/mL MTA组hDPSCs的吸光度值明显低于空白对照组及其他实验组,表明高浓度的MTA对hDPSCs的增殖具有抑制作用,推测其原因可能与20 mg/mL MTA浸提液具有较高pH值(8.63)有关,但具体原因需进一步研究证实。该结果与赵秀等[12]研究结果基本一致。
本实验以Von Kossa染色检测组织中钙盐形成及矿化。结果显示:2 mg/mL MTA组培养hDPSCs 28 d后可见Von Kossa染色阳性的钙化结节,其他各组均为阴性,而20 mg/mL MTA组可见细胞裂解碎片,表明适宜浓度的MTA可诱导hDPSCs的分化及矿化。Ca(OH)2组未见明显矿化产生。Ali等[13]用 MTA 和 Dycal® [一种 Ca(OH)2制剂,Densply,美国]进行直接盖髓的动物实验,30 d后发现MTA组牙齿形成钙化桥的比率远高于Dycal组。体外实验也证实,MTA可刺激成骨细胞的分化并产生细胞外基质蛋白形成矿化基质,从而诱导体外矿化过程[14]。
ALP是骨形成所必须的酶,ALP的表达代表着骨形成的状况,表明细胞分化的开始,并随着细胞分化的发展而增强,因此本实验以ALP作为牙髓干细胞分化的指标。结果显示:各实验组从6 d开始可检测到ALP活性,从9 d开始2 mg/mL MTA组hDPSCs表达的ALP活性快速升高,明显高于其他各组,之后缓慢升高,0.2 mg/mL MTA组虽然也有明显升高,但明显低于2 mg/mL MTA组,而20 mg/mL MTA组hDPSCs表达ALP活性明显低于空白对照组,说明适宜浓度的MTA可诱导hDPSCs的分化与矿化,且该分化过程出现在细胞生长的较早期阶段,而此前细胞处在增殖、生物合成细胞外基质进而出现细胞分化的过程,而随着基质的成熟,ALP的活性就逐渐表现出来。本实验中ALP阳性高表达的时间(9d)与 Kyung等[15](2009)的研究结果(1 d)有所不同,可能是由于细胞培养方法及培养基等的差异所致;Mori等[16]研究也发现牙髓干细胞向成骨细胞分化时,成骨培养基可更好的诱导其表达ALP。
DSPP在牙本质形成和矿化的过程中起着重要的调控作用,在牙齿发育过程中,成牙本质细胞持续表达DSPP,因此DSPP被作为成牙本质细胞分化的特异性标记蛋白。因为在上述实验中,只有2 mg/mL及0.2 mg/mL MTA组表现出 hDPSCs的增殖及分化活性,因此本实验中选取该两组进行检测。结果2 mg/mL MTA组在7 d出现DSPP目的基因条带,大小约98 bp,且条带的亮度明显高于其他两组,这与Lee等[17]研究结果一致,提示适宜浓度的MTA可诱导牙髓干细胞向成牙本质细胞方向分化。
本研究通过检测不同浓度的MTA对hDPSCs生长、分化、增殖及矿化过程的影响,表明适宜浓度的MTA(2 mg/mL)可促进hDPSCs的增殖,并可诱导hDPSCs向成牙本质细胞分化及矿化;高浓度的MTA(20 mg/mL)则抑制hDPSCs的增殖,并抑制其向成牙本质细胞分化,同时说明MTA具有良好的组织、细胞相容性。
[1]Aeinechi M,Eslai B,Chanbariha M,et al.Mineral trioxide aggregate(MTA)and calcium hydroxide as pulp-capping agents in human teeth:a preliminary report[J].Int Endod J,2002,36(3):22-31.
[2]Roterts HW,Toth JM,Berzins DW,et al.Mineral trioxide aggregate material use in endodontic treatment:a review of the literature[J].Dent Mater,2008,24(5):149 -164.
[3]Takita T,Hayashi M,Takeichi O,et al.Effect of mineral trioxide aggregate on proliferation of cultured human dental pulp cells[J].Int Endod J,2006,39(5):415 -422.
[4]Paranjpe A,Smoot T,Zhang H,et al.Direct contact with mineral trioxide aggregate activates and differentiates human dental pulp cells[J].J Endod 2011,37(12):1691 -1695.
[5]Gronthos S,Mankani M,Brahim J,et al.Postnatal human dental pulp stem cells(DPSCs)in vitro and in vivo[J].Proc Natl Acad Sci USA,2000,97(25):13625-13630.
[6]Hakki SS,Bozkurt SB,Hakki EE,et al.Effects of mineral trioxide aggregate on cell survival,gene expression associated with mineral tissues,and biomineralization of cementoblasts[J].J Endod,2009,35(4):513-519.
[7]Januschowski K,Mueller S,Spitzer MS,et al.Investigating the biocompatibility of two new heavy intraocular dyes for vitreoretinal with an isolated perfused vertebrate retina organ culture model and retinal ganglion cell line[J].Graefes Arch Clin Exp Ophthalmol,2011,34(2):324 -330.
[8]Oh SA,Lee H,Lee J,et al.Collagen three-dimensional hydrogel matrix carrying basic fibroblast growth factor for the cultivation of mesenchymal stem cells and osteogentic differentiation[J].Tissue Eng Part A,2011,18(9):123-129.
[9]Shahi S,Yavari HR,Rahimi S,et al.Comparison of the sealing ability of mineral trioxide aggregate and Portland cement used as root-end filling materials[J].J Oral Sci,2011,53(4):517 -522.
[10]Danesh F,Karamifar K,Abbott V,et al.Management of an extensive invasive root resorptive lesion with mineral trioxide aggregate:a case report[J].J Oral Sci,2011,53(3):397 -401.
[11]Darvell BW ,Wu RC.“MTA”—An hydraulic silicate cement:review update and setting reaction [J].Dent Mater,2011,27(5):407-422.
[12]Zhao X,He W,Song Z,et al.Mineral trioxide aggregate promotes odontiblastic differentiation via mitogen-activated protein kinase pathway in human dental pulp stem cells[J].Mol Biol Rep,2011,39(4):215 -220.
[13]Ali E,Mohammad H,Mahdieh S,et al.A comparative study on dental pulp response to calcium hydroxide,white and grey mineral trioxide aggregate as pulp capping agents[J].J Conserv Dent,2011,14(4):351 -355.
[14]Tani-Ishii N,Hamada N,Watanabe K,et al.Expression of bone extracellular matrix proteins on osteoblast cells in the presence of mineral trioxide[J].J Endod,2007,33(7):836 -839.
[15]Kyung S,Sang-Im L,Yoon L,et al.Effect of radio paque Portland cement on mineralization in human dental pulp cells[J].Oral Surg Oral Med Oral Pathol Oral Radiol Endod,2009,108(4):82-86.
[16]Mori G,Centonze M,Brunetti G,et al.Osteogenic properties of human dental pulp stem cells[J].J Biol Regul Homeost A-gents,2010,24(2):167 -175.
[17]Lee S,Lee S,Park J,et al.Effect of calcium phosphate cements on growth and odontoblastic differentiation in human dental pulp cells[J].J Endod,2010,36(9):1537-1542.

