Bio-Gide生物膜与人牙周膜干细胞的生物相容性研究
杨 昊,鲁 红,陈发明,金 岩
(第四军医大学口腔医学院,陕西西安710032)
牙周病治疗中牙周缺损的修复是国际关注的难题。传统的牙周治疗方法虽然能有效控制牙周病的发展进程,但却不能使缺失的牙周支持组织再生。自2004年美国施松涛教授发现人牙周膜干细胞(periodontal ligament stem cells,PDLSCs)以来,使干细胞治疗为牙周组织再生带来了新的希望,有望成为未来牙周病治疗的重要手段[1]。而引导组织再生术(guide tissue regeneration,GTR)作为牙周病治疗的主要方法[2],是在牙周手术中利用膜性材料作为屏障,阻挡牙龈上皮在愈合过程中沿根面生长,引导具有形成新附着能力的牙周膜细胞(periodontal ligament cells,PDLCs)优先占领根面,形成新的附着性愈合。由此可见:生物膜材料的阻挡作用和生物相容性对GTR具有重要影响[3]。Bio-Gide生物膜是瑞士Geistlich Pharma AG集团有限公司的产品,已经在临床上得到广泛应用,其为组织再生提供空间的机械屏障作用已被充分认可[4-6],但作为细胞载体材料,特别是与PDLSCs的结合及其附着能力的研究尚少,而细胞载体的研究在牙周组织工程研究中具有重要的地位和作用[7]。考虑到该材料具有长期临床应用的基础,如果能够将其作为细胞载体,应用于牙周组织工程和细胞治疗中,将加速临床转化的进程。为进一步开发Bio-Gide在牙周再生医学中的应用,本研究通过观察人PDLSCs在Bio-Gide生物膜材料上的粘附生长情况,为其作为有效的细胞载体用于牙周组织工程治疗提供实验室依据。
1 材料和方法
1.1 实验材料、试剂和仪器
Bio-Gide生物膜(Geistlich Pharma AG,瑞士);α-MEM 培养基、L-谷氨酰胺、青、链霉素、(Gibco公司,美国);胎牛血清FBS(杭州四季青生物工程有限公司);2.5 g/L胰蛋白酶(Amresco,美国);Ⅰ型胶原酶(Sigma,美国);地塞米松、β-甘油磷酸钠、异丁基甲基黄嘌呤IBMX、抗坏血酸(Sigma,美国);抗 CD31、抗 CD34、抗 CD45、抗 CD90、抗CD105、抗 CD29、抗 CD146、抗 STRO-1 抗体(R&D Systems,美国);茜素红、油红O、二甲基亚砜DMSO(Sigma公司,美国)。二氧化碳恒温培养箱(ThermoForma,美国);离心机 (Kubota2l00,日本);YJ-875型超净工作台(苏州净化设备厂);倒置相差显微镜和照相系统(OlympusIX70,日本);体视显微镜(Olympus,日本);扫描电镜(日立 S-4800,日本);6孔培养板、24孔板、平底96孔板(Falcon,美国);10 cm直径细胞培养皿(Corning,Lowell,美国);流式细胞仪(Beckman Coulter,Fullerton,CA,美国);超声震荡仪(上海生源器械厂);酶联免疫检测仪(BIO-TEK,美国);紫外线分光光度仪(Eppendorf,德国)。
1.2 人牙周膜干细胞的分离培养和鉴定
1.2.1 牙周膜干细胞的原代培养
选取5名年龄16~45岁健康(否认全身性疾病)志愿者(知情同意)拔除无牙周病的第三磨牙(上颌4个,下颌5个),立即在超净工作台内刮取根中1/3牙周膜组织,剪成1 mm×1 mm×1 mm并移入离心管内,以 I型胶原酶在37℃下消化15 min后接种于6孔板中,置盖玻片并滴加含100 mL/L FBS的 α-MEM培养基,置 37℃、50 mL/L CO2饱和湿度条件下培养10~15 d,每2天换液1次。待细胞从组织块边缘爬出并达到80%汇合时,2.5 g/L胰蛋白酶消化传代。
1.2.2 牙周膜干细胞的分离、纯化
有限稀释法克隆分离PDLSCs:取上述细胞用α-MEM制成单细胞悬液,调整细胞密度为10/mL以下,接种于 96孔板,每孔 0.1 mL,在 37℃、50 mL/L CO2饱和湿度条件下常规培养24 h,待细胞贴壁后显微镜下观察并标记含单个细胞孔,补加0.1 mL培养基继续培养,每隔2天换液。当细胞形成克隆(集落细胞数≥50)并长至孔底1/2时,胰蛋白酶消化,扩大培养,即为PDLSCs。
1.2.3 PDLSCs的鉴定
1.2.3.1 细胞克隆形成能力的检测
取克隆纯化的第4代细胞用胰酶消化后用α-MEM制成单细胞悬液,以1×103个细胞接种于10 cm的培养皿中,十字方向轻轻晃动培养皿,使细胞分散均匀后置37℃的CO2孵箱中常规培养。14 d后,弃去培养液,用PBS洗2遍,40 g/L多聚甲醛室温固定30 min,PBS浸洗2遍,甲苯胺蓝染色20 min,PBS洗2遍,显微镜下观察并拍照。以多于50个细胞的集落计为一个克隆,并计算克隆形成率。

1.2.3.2 细胞生长曲线测定
取克隆纯化的第4代细胞用胰蛋白酶消化后用α-MEM制成单细胞悬液,调整细胞密度为1×104/mL后接种于 96 孔板,每孔 200 μL,置37℃,50 mL/L CO2孵箱中常规培养。24 h后每孔加5 mg/mL的MTT液20 μL继续培养4 h,弃去上清液,每孔加160 μL DMSO振荡10 min,用酶联免疫检测仪测各孔490 nm处的吸光值(OD值)。并以时间为横坐标,OD值为纵坐标绘制生长曲线。
1.2.3.3 干细胞表面标志物检测
取克隆纯化的第4代细胞胰酶消化后用α-MEM制成单细胞悬液,调整细胞密度为1×106/mL后用含30 mL/L FBS的PBS洗2遍,装入EP管中,分别加入适当量的 CD90、CD105、CD29、STRO-1、CD146、CD31、CD34、CD45 抗体于4℃冰箱中孵育。1 h后用含3 mL/L FBS的PBS洗去抗体,用流式细胞仪在避光条件下进行抗体检测。其中STRO-1是Alexa Fluor647标记;CD45、CD146、CD90、CD31 为 PE 标记;CD105、CD29、CD34为FITC标记。
1.3 Bio-Gide生物膜的细胞毒性实验
1.3.1 Bio-Gide 生物膜浸提液的制备
参照GB/T 16886.5医疗器械生物学评价第5部分细胞毒性试验体外法,将Bio-Gide生物膜用Co60射线消毒后切成5 mm×25 mm,按3 cm2/mL的比例加入含100 mL/L的FBS的 α-MEM培养液,于37℃下浸提24 h,取浸提液用于以下实验。
1.3.2 MTT 法测细胞毒性
取克隆纯化的第4代细胞用胰蛋白酶消化后用α-MEM制成细胞悬液,调细胞密度为1×104/mL接种于 96孔板,每孔 200 μL,置 37℃、50 mL/L CO2的细胞培养箱中培养。24 h后弃原液,将细胞随机分为2组,每组8孔,其中对照组加入200 μL的 α-MEM 培养液,实验组加入200 μL的Bio-Gide生物膜浸提液,继续培养至第5天时,于各组各孔加入20 μL MTT液,培养箱内继续孵育4 h后弃上清液,每孔加160 μL的DMSO,低速震荡10 min后用酶联免疫检测仪测各孔490 nm波长处的吸光度值(OD值),记录结果,实验重复3次。以下列公式计算各组细胞的相对增殖率(RGR)。

并根据国家标准将RGR值转换成6级反应(表1),以评定材料的毒性程度:0、1级为合格;2级应结合细胞形态分析,综合评价;3~5级为不合格。

表1 RGR值转换6级反应标准
1.4 PDLSCs在 Bio-Gide生物膜上生长、粘附情况观察
1.4.1 扫描电镜观察生长情况
将 Bio-Gide生物膜剪成1.5×1.5 cm 后置24孔板中。取生长状态良好的第3代PDLSCs,胰蛋白酶消化并用α-MEM制成细胞密度为1×106/mL的细胞悬液后接种于生物膜片上常规培养,在培养后8 h、1、3、7、12 d 时中止培养,取生物膜片用固定液固定后,电镜样本制备常规扫描并观察拍照。
1.4.2 荧光显微镜观察细胞的粘附情况
将生物膜剪成1.5×1.5 cm后置24孔板中,同时设不放生物膜的孔作为对照,取生长状态良好的第3代PDLSCs用含100 mL/L FBS的α-MEM制成细胞密度为1×106/mL的细胞悬液后接种于上述24孔板中,每孔1 mL,37℃、50 mL/L CO2孵箱中培养,24 h后于各组各孔滴加Hochest荧光核染色剂,继续培养30 min后,吸取上清液,荧光显微镜下观察并进行细胞核计数(实验重复8次),以下列公式计算细胞粘附率。

1.5 统计学分析
使用SPSS 17.0软件进行统计分析,组间比较用独立样本均数t检验,检验水准α=0.05。
2 结果
2.1 人PDLSCs的分离培养与鉴定
本研究参照课题组前期报道[8],采用酶消化组织块法培养人PDLCs,一般10 d左右可见细胞从组织块边缘爬出,大约3周左右原代细胞达80%汇合。可见细胞呈长梭形,有细胞突触,胞核聚集在中心,具有成体干细胞的特征(图1)。培养皿内的细胞在7 d左右出现克隆集落,呈旋涡状生长,集落内细胞密度随时间逐渐增加,细胞形态为长梭形,细胞突起明显(图2)。14 d时计算克隆形成率为(12.9±0.6)%。细胞生长曲线基本成S形,第2天与第1天比较无明显增殖,第3天开始基本成对数增长,第7天时细胞增殖进入平台期(图3)。通过对细胞表面抗原的检测,对造血系标志物CD34、CD45和内皮系标志物CD31表达阴性;而高表达一系列干细胞表面标志物STRO-1、CD146、CD105、CD29、CD90(图 4)。其中 STRO-1是 11.9%,CD146是 45.5%,CD105是 92.1%,CD29是99.5%,CD90是 100%,CD34是 0.7%,CD45 是1.9%,CD31 是0.2%。
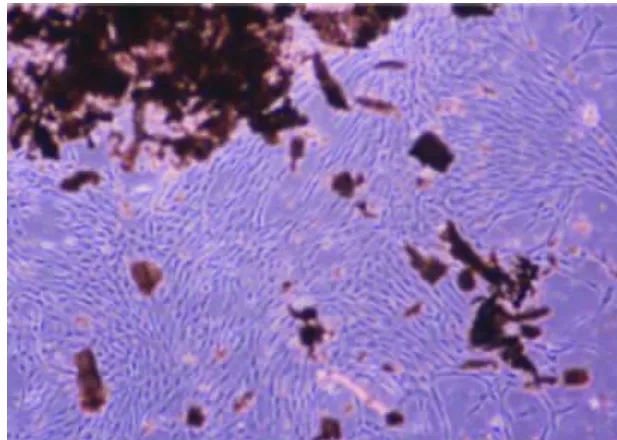
图1 牙周膜细胞原代培养10 d(×40)

图2 14 d时单细胞克隆(×15)

图3 MTT法检测细胞生长曲线

图4 流式细胞仪检测细胞表面标记物
2.2 细胞毒性实验
实验组吸光度均值明显高于对照组,差异有统计学意义(P <0.05),其增殖率 RGR=122.66%(表2)。根据表1评定标准其毒性级为0级,无毒性。

表2 细胞毒性实验结果 (n=8)
2.3 扫描电镜观察PDLSCs在Bio-Gide生物膜上的生长情况
Bio-Gide生物膜的基本组成成分Ⅰ型和Ⅲ型胶原,电镜下可见粗大的胶原纤维束(图5a)。通过对生物膜上不同时段细胞的观察,可看到细胞在生物膜上有很好的贴附生长,8 h观察细胞在生物膜上已经附着并伸展呈长梭形及多角形,部分细胞成短梭形(图5b)。而24 h细胞已经完成贴壁,视野中均为长梭形细胞,高倍镜下可见细胞附着较密集,细胞与细胞间有空隙,可见下层的胶原束(图5c)。3 d时细胞增殖较多,汇合成片状,基本覆盖细胞下方的胶原束(图5d),但在低倍镜下仍可见不同的胶原层次(图5e)。7 d时细胞已经完全成膜状生长,低倍镜下观察,生物膜表面呈平滑状,胶原束已经完全被细胞膜遮挡,膜表面可见细胞生长的片状纹理,少数细胞膜片之间未完全融合留有裂隙(图5f)。12 d时在低倍镜下观察细胞生长密集,形成的膜片较7 d时增厚,细胞膜片之间的裂隙也明显减少(图5g)。
2.4 PDLSCs在Bio-Gide生物膜上的粘附情况
将与生物膜共同培养的PDLSCs上清液用Hochest荧光核染色剂染色后,荧光显微镜下进行细胞计数,结果显示:实验组上清液中细胞数为(13.3±3.4)×104,其细胞粘附率为(86.7 ±3.4)%,明显高于对照组(P <0.05)(表3)。

图5 PDLSCs在生物膜上培养不同时间点扫描电镜观察

表3 PDLSCs在Bio-Gide生物膜上的粘附情况(n=8)
3 讨论
牙周治疗的最终目标,是实现牙周支持组织的功能性再生,传统的治疗方法虽能有效控制牙周病的发展过程,但却不能达到牙周组织再生的目的。GTR技术的应用大大提高了牙周治疗的临床效果,但其与真正的牙周支持组织的生理性和功能性再生还有一定的距离。
近年来,组织工程的发展为牙周缺损的治疗带来了新的思路,其基本方法是将体外培养的高浓度、功能相关的活细胞种植于具有良好生物相容性和生物降解性的细胞外基质材料上,经过一段时间的培养,将这种细胞与生物材料复合体植入机体病损部位,以形成新的具有原来特殊功能和形态的相应组织和器官,达到修复创伤和重建功能的目的。而牙周膜干细胞的发现又为牙周组织工程的构建提供了理想的细胞来源。大量的动物实验表明:利用牙周膜干细胞进行牙周组织的细胞治疗,均能实现较为理想的牙周缺损组织的生理性和功能性再生[9-11]。而在利用组织工程技术进行牙周治疗的过程中,细胞载体的运用起着重要的链接作用,但目前还没有一种可供临床应用的良好细胞载体,因此大大延缓了牙周组织工程(特别是细胞治疗)基础研究成果的临床转化进程。
在GTR和骨再生手术中得到广泛应用的Bio-Gide生物膜是瑞士盖氏骨替代品产品,该生物膜主要由致密层和疏松层组成。致密层主要是阻止软组织长入植骨区域,疏松层主要是容纳血细胞和成骨细胞,使骨膜能与植骨区更易贴合,更易新骨的形成。该材料良好的机械屏障作用已经得到认可,但目前还未见该材料作为细胞载体用于牙周组织再生的有关报道。因此,如能将GTR中的屏障膜作为细胞载体,特别是与PDLSCs结合用于牙周组织工程和细胞治疗中,定将加速临床转化的过程。本研究通过观察PDLSCs在Bio-Gide膜材料上的生长、粘附情况,证明该生物膜具有良好的生物相容性,无细胞毒性,能够支持PDLSCs成膜性生长,有望成为良好的牙周组织工程细胞载体材料。
[1]Seo BM,Miura M,Gronthos S,et al.Investigation of multipotent postnatal stem cells from human periodontal ligament[J].Lancet,2004,364(9429):149 -155.
[2]Bosshardt DD,Sculean A.Does periodontal tissue regeneration really work?[J].Periodontol,2000,2009,51(1):208 -219.
[3]Bottino MC,Thomas V,Schmidt G,et al.Recent advances in the development of GTR/GBR membranes for periodontal regeneration-a materials perspective[J].Dent Mater,2012,28(7):703-721.
[4]Tonetti MS,Cortellini P,Lang NP,et al.Clinical outcomes following treatment of human intrabony defects with GTR/bone replacement material or access flap alone.A multicenter randomized controlled clinical trial[J].J Clin Periodonto,2004,31(9):770-776.
[5]Schwarz F,Bieling K,Latz T,et al.Healing of intrabony periimplantitis defects following application of a nanocrystalline hydroxyapatite(Ostim)or a bovine-derived xenograft(Bio-Oss)in combination with a collagen membrane(Bio-Gide).A case series[J].J Clin Periodontol,2006,33(7):491 -499.
[6]Sculean A,Schwarz F,Chiantella GC,et al.Five-year results of a prospective,randomized,controlled study evaluating treatment of intra-bony defects with a natural bone mineral and GTR[J].J Clin Periodontol,2007,34(1):72 -77.
[7]Chen FM,Sun HH,Lu H,et al.Stem cell-delivery therapeutics for periodontal tissue regeneration[J].Biomaterials,2012,33,in press.
[8]张璟,杨昊,高丽娜,等.年龄因素对人牙周膜干细胞培养和性能的影响[J].牙体牙髓牙周病学杂志,2012,22(3):136-140.
[9]Akizuki T,Oda S,Komaki M,et al.Application of periodontal ligament cell sheet for periodontal regeneration:a pilot study in beagle dogs[J].J Periodontal Res,2005,40(3):245 -251.
[10]Liu Y,Zheng Y,Ding G,et al.Periodontal ligament stem cellmediated treatment for periodontitis in miniature swine[J].Stem Cells,2008,26(4):1065 -1073.
[11]Ding G,Liu Y,Wang W,et al.Allogeneic periodontal ligament stem cell therapy for periodontitis in swine [J].Stem Cells,2010,28(10):1829-1838.

