杏鲍菇菌丝体多糖提取条件的优化研究*
郭金龙 邢丽萍 王玉芬 孙国琴
(1.内蒙古清谷新禾有机食品集团有限责任公司,呼和浩特 010051;2.内蒙古大学,呼和浩特 010021;3.内蒙古农牧业科学院,呼和浩特 010030)
杏鲍菇 (Pleurotus eryngii(DC.)Qué l.),别名刺芹侧耳,隶属于担子菌纲,伞菌目,侧耳科,侧耳属[1]。杏鲍菇菌肉肥厚,质地脆嫩,具有杏仁香味和类似鲍鱼的口感,适合保鲜、加工,深得人们的喜爱,享有 “平菇王”的美誉。杏鲍菇寡糖含量丰富,与双歧杆菌共用,有改善肠胃功能和美容的效果[2],入药有降血压、降血脂、降低胆固醇和增强肌体免疫力之功效[3]。多糖是杏鲍菇中具有生物活性的主要有效组分之一,国内研究2003年才见报道[4]。近几年的研究结果表明,杏鲍菇所含的真菌多糖具有抗氧化、降血脂、抑制肿瘤、抗病毒、抗过敏、抗衰老、降低胆固醇和增强机体免疫的功效[5~7]。杏鲍菇子实体和液体发酵菌丝体都可作为多糖提取的原料。俞苓等[4]用热水浸提结合酶法试验结果表明,果胶酶和中性蛋白酶均可大大提高多糖得率,可分别达368 mg/g粗多糖和176 mg/g粗多糖。侯军等[8]响应面优化法能够提高杏鲍菇菌糠的多糖提取率,最大提取率达6.43%。
由于子实体生产周期长,劳动强度大,易受气候影响,产品的产量及质量不稳定,且子实体木质化程度高,因此人工栽培子实体的多糖提取利用率较低。而采用生物发酵技术生产杏鲍菇菌丝体,周期短、成本低、产量大,具有工业化生产前景[9]。相关研究表明,发酵法获得的菌丝体和人工栽培的子实体,不管是多糖含量,还是多糖的药理效果,两者都比较接近,在有些情况下菌丝体多糖的含量和药理效果比子实体还要好[10]。因此本试验选择杏鲍菇菌丝体作为原料,探讨多糖提取方法,利用正交试验对热水浸提法提取杏鲍菇多糖的最佳工艺进行了优化,为深入研究杏鲍菇菌丝体多糖奠定基础,也为杏鲍菇保健食品的开发利用提供依据。
1 材料和方法
1.1 试验材料与仪器 试验材料:通过液体发酵得到的杏鲍菇菌丝体,无水乙醇、葡萄糖、苯酚、浓硫酸 (以上均为分析纯),碘-碘化钾溶液。所用仪器:贝克曼离心机64R(3万转)、JY92-2D超声波细胞粉碎机、电热鼓风干燥箱、HHS型电热恒温水浴槽、ZK-2BS型真空干燥箱、BW320S电子天平。
1.2 试验方法
(1)菌丝体发酵培养。将斜面试管菌种接种于液体摇瓶中,25℃、150 r/min条件下培养7天制成液体母种,然后将母种以2%接种量接入液体摇瓶培养基中,培养10天左右得到菌丝体原料。
多糖提取工艺流程:菌丝体→洗涤→破碎→热水浸提→离心 (25℃)→上清液真空浓缩→醇析→离心 (4℃)→乙醇洗涤→真空干燥→粗多糖成品。
(2)醇析多糖条件研究。①乙醇加入量的选择:取浓缩后的浸提液各10 mL,分别加入95%的乙醇10 mL、20 mL、30 mL、40 mL、50 mL,密封,在低温 (4℃)下放置过夜,收集粗多糖,按照苯酚-硫酸法测定多糖含量,并计算多糖得率。②醇析时间的选择:取浓缩后的浸提液各10 mL,加入上述试验确定的乙醇量,密封,在低温下分别放置2 h、4 h、6 h、8 h、10 h、12 h,收集粗多糖,按照苯酚-硫酸法测定多糖含量,并计算多糖得率。
(3)菌丝体细胞壁破碎方法的研究。菌丝体在热水浸提前需要进行细胞破碎,目的是提高多糖的溶出率和缩短浸提时间,试验比较了以下3种方法对杏鲍菇多糖提取率的影响。
①烘干粉碎法:属于传统方法,将菌丝体在60℃电热鼓风干燥箱中烘干,用研钵粉碎,过60目筛。
②超声破碎法:采用JY92-2D型超声波细胞粉碎机,变辐杆Φ 6,功率600 W。
③低温冻融法:将菌丝体冷冻 (约-15℃),然后室温融化,反复多次。
(4)杏鲍菇菌丝体多糖的浸提条件研究。①浸提温度选择试验:确定料液比 (菌丝体湿重g/蒸馏水体积mL)为1∶8,浸提时间1 h不变的条件下,比较不同浸提温度对多糖得率的影响,以选择最佳浸提温度。②浸提时间选择试验:在料液比1∶8,及由上述试验确定的浸提温度不变的条件下,比较不同浸提时间对多糖得率的影响,根据其多糖得率确定最佳浸提时间。③浸提料液比试验:在上述试验确定的最佳温度、最佳时间不变的条件下,选择不同的料液比提取多糖,根据多糖得率确定最佳料液比。
(5)正交试验。根据单因子试验确定的条件范围,通过L9(34)正交试验,得出最佳浸提条件。
(6)多糖含量的测定。称取粗多糖样品0.01 g左右,加入100 mL蒸馏水中沸水浴30 min溶解多糖并定容至250 mL,得杏鲍菇多糖溶液。采用苯酚-硫酸比色法[11]测定吸光度,并计算多糖含量。
多糖得率 (%)=多糖含量/菌丝体干重×100%。
2 结果与分析
2.1 乙醇加入量对多糖得率的影响 醇析试验中乙醇加入量对杏鲍菇多糖得率的影响见图1。从图1可知,乙醇加入量1~3倍时多糖得率渐次明显增加,说明乙醇加入量小于3倍时,多糖沉淀不完全;而乙醇加入量大于3倍后,多糖得率趋于平缓,说明3倍的乙醇加入量已基本能把多糖完全沉淀下来,再增加乙醇用量意义不大。从经济角度考虑,选择3倍为醇析时的乙醇加入量。
2.2 醇析时间对多糖得率的影响 醇析试验中醇析时间对杏鲍菇多糖得率的影响见图2。从图2可以看出,醇析时间小于4 h多糖得率增加明显,说明多糖沉淀不完全;醇析6 h以上曲线变得平缓;8 h后多糖得率无明显增加,说明此时多糖已沉淀完全。因此醇析时间选择8 h是恰当的。
2.3 低温冻融法对多糖得率的影响 采用低温反复冻融的方法处理杏鲍菇菌丝体,并以传统的烘干粉碎法作对照,结果表明,随着低温冻融次数的增加,杏鲍菇多糖得率略有增加,但增加量很小,即使反复冻融5次,多糖得率仍然在1%左右,远远低于传统烘干粉碎法 (图3)。可见低温冻融法破碎作用较弱,只适用于细胞壁较脆弱的微生物菌体,而不适用于细胞壁较厚的杏鲍菇菌丝体。
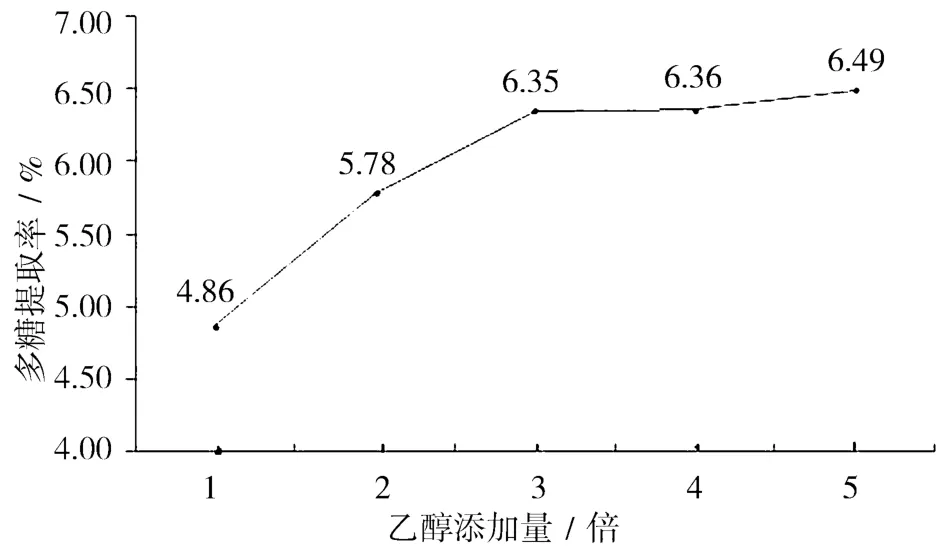
图1 乙醇加入量对多糖得率的影响

图2 醇析时间对多糖得率的影响
2.4 超声波法对多糖得率的影响 采用超声波以不同方式处理杏鲍菇菌丝体,并以传统的烘干粉碎法作为对照,结果是,只进行 10 min超声破壁而不进行热水浸提,多糖得率比传统的烘干粉碎法低,仅为超声处理5 min并进行热水浸提的50.32%。说明超声处理不能完全取代热水浸提的作用。超声处理10 min多糖得率达到最高,为 4.73%,再继续延长超声处理时间,多糖得率反而有下降的趋势,这可能是因超声波处理时间过长,导致多糖结构发生变化,糖链断裂,多糖得率下降 (图4)。因此,应选择超声处理10 min并进行热水浸提为最佳的处理条件。
2.5 不同浸提温度对多糖得率的影响 分别在60℃、70℃、80℃、90℃、沸水 (97℃)时提取杏鲍菇多糖,测定多糖得率,结果为:浸提温度对多糖得率有很大影响,80℃以下多糖的浸提得率随着温度的升高而明显增加;80~97℃多糖浸提得率增加趋于平缓;在温度为97℃的沸腾状态,多糖得率最高 (图5)。因此,97℃宜作为杏鲍菇菌丝体多糖的浸提温度。
2.6 不同浸提时间对多糖得率的影响 分别选取浸提时间1 h、1.5 h、2 h、2.5 h、3 h、3.5 h、4 h提取杏鲍菇多糖,测定多糖得率,结果如图6所示:提取时间在1~2 h之间,多糖得率是逐渐增大的;继续延长加热时间,多糖得率反而渐趋减少。因此,浸提时间选择2 h是比较合理的。
2.7 不同料液比对多糖得率的影响 按照1∶6、1∶8 、 1∶10、 1∶12、1∶14、 1∶16、1∶18、1∶20 的料液比,分别提取杏鲍菇菌丝体多糖,测定多糖得率的结果 (图7),料液比由1∶6到 1∶10时,多糖得率直线上升,继续增大加水量多糖得率变化不大。因此,选用1∶10料液比较为合理。

图3 冻融处理对多糖得率的影响

图4 超声波处理对多糖得率的影响
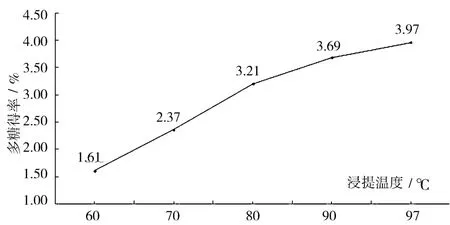
图5 浸提温度对多糖得率的影响

图6 浸提时间对多糖得率的影响
2.8 正交试验结果与分析 根据以上单因子试验结果,3个因子中最优条件分别为:浸提温度97℃、浸提时间2 h、料液比1∶10。因此,在正交试验时各因子的水平依表1选取;试验计算结果如表2所示。
从表2可以看出,对多糖得率的影响,3个因子中,A因子 (浸提温度)的极差最大,B因子 (浸提时间)次之,C因子 (料水比)最小。热水浸提法提取杏鲍菇菌丝体多糖的最佳工艺组合为A3B3C1,即浸提温度97℃,浸提时间3 h,料液比1∶8。但由于浸提时间2 h和3 h的k值仅相差0.04,而在生产上则要付出更多的能耗。为了达到最佳的经济效益,生产上应该选组合A3B2C1,即浸提温度97℃、浸提时间2 h、料液比1∶8的工艺组合。
运用SPSS(13.0)统计分析软件[12]对表2结果进行方差分析,结果见表3。从表3可以看出,浸提温度的显著值(Sig.)为0.033(0.01<P<0.05),有显著性影响;浸提时间和料液比的显著值 (Sig.)分别为0.198和0.600(P>0.05),无显著影响。说明在所选择的水平范围内,浸提温度的改变对多糖得率有显著的影响,其他2个因子对多糖得率的影响不显著。影响因子重要性顺序为A>B>C。
3 结论和讨论
3.1 结论
(1)菌丝体细胞破碎方法选择超声波法。低温冻融法不适合杏鲍菇菌丝体细胞破碎。超声波法与烘干粉碎法相比,前者不必将菌丝体烘干,既简化了提取工艺,又提高了多糖得率。
(2)醇析时优化工艺条件为:3倍体积95%乙醇沉淀8 h以上。
(3)浸提温度97℃、浸提时间2 h、料液比1∶8为最佳浸提工艺条件。在此条件下,菌丝体多糖的提取率可达6.52%,较未优化前提高近1倍。
3.2 讨论
(1)杏鲍菇多糖。自从真菌多糖抑制肿瘤的活性被发现以后,真菌多糖越来越受人们的关注,成为生物化学、免疫学、医药学和食品科学等学科的一个非常活跃的研究领域。盛伟等[3]对来源于白灵菇、杏鲍菇、阿魏菇3种不同菌类的多糖进行体外抗氧化活性研究,发现杏鲍菇对超氧阴离子自由基的清除能力最强,杏鲍菇子实体干品中多糖含量高达9.9%,它与胃肠中的双岐杆菌共同作用,具有很好的促进消化、吸收功能,是理想的美容、保健食品。挖掘食用菌潜力,提高其产品附加值,是食用菌工作者的责任和义务,我们正在采用离子束诱变技术试图提高菌丝体中的多糖含量,同时必须探索先进的提取技术将其从菌丝体中提取出来。这正是本文研究的要旨。
(2)菌丝体的前处理。多糖的提取方法常用的有热水浸提法、酸提法、碱提法、酶法等。稀酸、稀碱条件下,易使部分多糖发生水解,从而破坏多糖的活性结构,使多糖的得率减少。用酶法提取虽然条件温和,但是成本太高。因此,我们采用热水浸提法,并通过超声破碎法和低温冻融法处理菌丝体细胞来弥补传统热水浸提法需要多次浸提,多糖得率低的缺点。

图7 料液比对多糖得率的影响
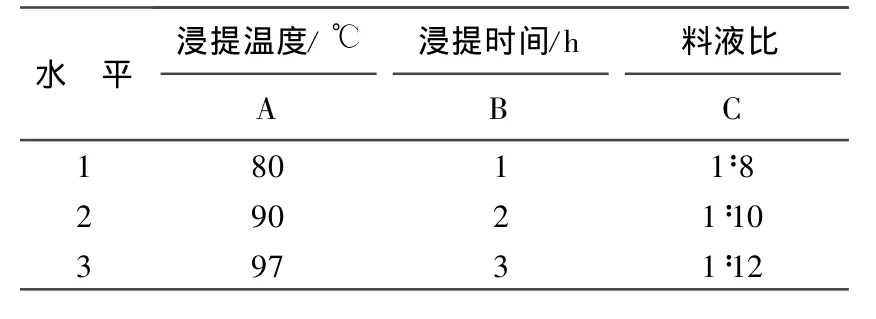
表1 正交试验因子水平表

表2 正交试验结果
(3)利用正交设计优化提取工艺。正交设计的基本特点是用部分试验来代替全面试验,通过对部分试验结果的分析,了解全面试验的情况。如本试验对浸提温度、浸提时间、料液比3因子,每个因子3水平试验,若不考虑交互作用,可利用正交表L9(34)安排,试验方案仅包含9个水平组合,就能反映试验方案包含27个水平组合的全面试验的情况,找出最佳的生产条件,再参考单因子试验确定各因素的水平,利用正交试验得出浸提时的最佳浸提工艺条件,并通过工业生产经济核算,最终确定生产中的最佳浸提工艺条件,为食用菌的精深加工提供科学技术依据。

表3 试验结果的方差分析
[1]姚自奇,兰 进.杏鲍菇研究进展[J].食用菌学报,2004,11(1):52-58.
[2]陈士瑜,陈海英.蕈菌医方集成[M].上海:上海科学技术文献出版社,2000:429-430.
[3]盛 伟,方晓阳,吴 萍.白灵菇、杏鲍菇、阿魏菇多糖体外抗氧化活性研究[J].食品工业科技,2008,29(5):103-106.
[4]俞 苓,刘民胜,陈有容.杏鲍菇菌丝体多糖提取方法[J].食品工业,2003,(3):17-19.
[5]张俊会,王 谦.杏鲍菇多糖的抗氧化活性研究[J].中国食用菌,2003,22(2):38-39.
[6]杨立红,史亚丽,王晓洁,卜庆梅,蔡德华.杏鲍菇多糖的分离纯化及生物活性的研究[J].食品科技,2005,(6):18-21.
[7]迟桂荣.杏鲍菇菌丝液体深层发酵产生多糖的分离纯化及生物学活性研究[J].德州学院学报,2006,22(4):108-110.
[8]侯 军,林晓民,李 瑛.响应面法优化杏鲍菇菌糠多糖提取工艺[J].食品科学,2010,31(24):155-158.
[9]孟艳琼,宋 敏,彭 凡,樊美珍.杏鲍菇深层发酵工艺的研究[J].安徽农业大学学报,2003,30(3):337-341.
[10]刘祖同,罗信昌.食用蕈菌生物技术及应用[M].北京:清华大学出版社,2002.
[11]张 青,张天民.苯酚-硫酸比色法测定多糖含量[J].山东食品科技,2004,(7):17-18.
[12]何秋月.SPSS在L9(34)正交试验数据处理中的应用[J].中国中医药现代远程教育,2005,3(12).

