大泷六线鱼鳍、吻端和肾脏组织原代培养的研究
郭莹,李霞,秦艳杰
(1.大连海洋大学农业部北方海水增养殖重点实验室,辽宁大连116023;2.大连海洋大学辽宁省海洋生物资源恢复与生境修复重点实验室,辽宁大连116023)
大泷六线鱼Hexagrammos otakii又名欧式六线鱼,隶属于鉳形目 Scorpaeniforms、六线鱼科Hexagrammidae[1],属于冷温性底层鱼类,主要分布于中国山东和辽宁等地的近海多岩礁海区,日本、朝鲜等国的近海也有分布。该鱼肉味鲜美,营养丰富,有“北方石斑”之称[2],是中国北方重要的经济鱼类。对大泷六线鱼的生物学研究目前主要集中在形态、生态、遗传育种等领域[3-6],但关于其细胞体外培养的研究尚未见报道。本研究中,作者主要研究了培养基和生长因子对大泷六线鱼鳍、吻端和肾脏组织原代培养的影响,建立了3种组织的原代培养体系,旨在为细胞系的构建以及应用提供基础资料。
1 材料与方法
1.1 材料
1.1.1 试验鱼 大泷六线鱼购自大连黑石礁海边鱼市,全长为160~220 cm,体质量为150~200 g。
1.1.2 培养基和生长因子 L-15培养基、DMEM培养基、DMEM/F12培养基、胎牛血清 (FBS)、胰蛋白酶均为Hyclone公司产品;人碱性成纤维细胞生长因子 (bFGF)、Ⅰ型胰岛素样生长因子(IGF-Ⅰ)、透明质酸酶、Ⅱ型胶原酶均为Peprotech公司产品;硫酸软骨素为Wolsen公司产品。
1.2 方法
1.2.1 细胞原代培养的启动
1)鳍、吻端细胞的培养 将鲜活大泷六线鱼于高双抗消毒海水 (包含1 000 IU/mL青霉素、1 000 μg/mL链霉素)中暂养16~24 h后,在超净工作台上取其鳍和吻端组织,分别放入青霉素小瓶中并加入新配置的双抗消毒液 (包含100 IU/mL青霉素、100 μg/mL链霉素)处理30 min。将双抗吸出,分别用PBS和含有5%(体积分数,下同)FBS的DMEM/F12培养基漂洗组织块一次。用无菌眼科剪刀将组织块剪成1 mm3的碎块。再用体积分数为0.5%的透明质酸酶和体积分数为0.2%的Ⅱ型胶原酶联合消化30 min。最后用含有5%FBS的DMEM/F12培养基充分悬浮并接种于25 cm2的培养瓶中。16 h后,补加培养基至 5 mL/瓶。
2)肾细胞的培养 将经过高双抗消毒海水暂养的鲜活大泷六线鱼置于超净工作台上,取其肾脏组织放入青霉素小瓶中。分别用PBS和含有5%FBS的DMEM/F12培养基漂洗组织块一次。用无菌眼科剪刀将组织块剪成1 mm3的碎块。最后用含有5%FBS的DMEM/F12培养基充分悬浮并接种于25 cm2的培养瓶中。10 h后,补加培养基至5 mL/瓶。
1.2.2 不同培养基对培养组织生长的影响试验在鳍、吻端和肾脏组织块中分别加入含有20%FBS的L-15、DMEM和DMEM/F12培养基,于25℃下进行原代培养,观察各组织在3种不同培养基中细胞的贴壁和迁出情况,确定最适培养基。
1.2.3 不同质量浓度的生长因子对细胞贴壁率和迁出率的影响试验 选用DMEM/F12培养基,分别添加bFGF、硫酸软骨素、IGF-Ⅰ 3种生长因子,各生长因子的质量浓度设置如下:bFGF为2.5、5.0、10.0、20.0 ng/mL;硫酸软骨素为10、20、40、80 μg/mL;IGF- Ⅰ 为 10、20、40、80 ng/mL,每个质量浓度设3个平行,对照组培养瓶中不加任何生长因子,同样设3个平行,在25℃、pH 7.2和5%CO2的条件下培养,24~28 h后,观察细胞贴壁生长情况。
1.2.4 原代细胞染色体的分析 取原代培养的鳍、吻端、肾组织细胞各1瓶,加入秋水仙素,使其终质量浓度达到1 μg/mL。25℃下继续培养4~6 h后,加入体积分数为0.25%的胰蛋白酶溶液1 mL,消化1 min,待细胞変圆后,吸去胰蛋白酶溶液,补加最适培养基,用吸管吹打培养瓶底,制成细胞悬液,并收集于离心管中,以1 000 r/min离心10 min后弃上清。用0.075 mol/mL KCl溶液于25℃下低渗30 min,再以1 500 r/min离心5 min。用Carnoy固定液固定3次,每次15 min,并放入冰箱内冷冻过夜。然后再一次离心,弃上清,向收集的细胞沉淀中加入新配制的固定液1 mL,采用冷滴片法滴片过火,室温下自然干燥。用Giemsa染液染色2 h,自然干燥。在Olympus显微镜下统计染色体数目并拍照。
2 结果
2.1 不同培养基对培养组织生长的影响
原代培养7 d后,鳍、吻端和肾脏组织细胞在FBS-DMEM/F12培养基中均有大量细胞迁出,迁出的细胞占瓶底面积的10%以上,在L-15和DMEM培养基中生长的3种组织细胞的迁出数量相对较少,肾脏组织分别为8%和6%,鳍为6%和4%,吻端组织仅为4%和2%。可见,含有20%FBS的DMEM/F12培养基更适合于大泷六线鱼鳍、吻端和肾脏细胞的体外培养。
2.2 不同质量浓度的生长因子对细胞贴壁率和迁出率的影响
从图1可见:当bFGF质量浓度为5.0 ng/mL时,3种组织的贴壁率和迁出率均最高,鳍组织的贴壁率和迁出率分别为92.1%、85%;吻端组织的贴壁率和迁出率分别为58.9%、50%;肾脏组织的贴壁率和迁出率分别为97.8%、89.7%。当bFGF的质量浓度达到20.0 ng/mL时,鳍细胞和肾细胞的迁出率均小于对照组,吻端细胞的贴壁率小于对照组,说明bFGF质量浓度过高会抑制细胞增殖。

图1 bFGF质量浓度对鳍、吻端和肾脏组织贴壁率和迁出率的影响Fig.1 The effects of bFGF at different concentrations on attachment rate and cell emigration of fin,lip and kidney tissues
从图2可见:当硫酸软骨素质量浓度为20 μg/mL时,3种组织的贴壁率和迁出率均最高,鳍组织的贴壁率和迁出率分别为84.4%、65.6%;吻端组织的贴壁率和迁出率分别为96.7%、63.3%;肾脏组织的贴壁率和迁出率分别为95.4%、98.6%。虽然当硫酸软骨素质量浓度达到80 μg/mL时,3种组织细胞的贴壁情况要好于对照组,但细胞迁出还是被抑制。
从图3可见:当IGF-Ⅰ质量浓度为40 ng/mL时,3种组织碎的贴壁率和迁出率均最高,鳍组织的贴壁率和迁出率分别为90.7%、88.3%;吻端组织的贴壁率和迁出率分别为88.6%、79.8%;肾脏组织的贴壁率和迁出率分别为92.8%、97.4%。当IGF-Ⅰ质量浓度达到80 ng/mL时,细胞增殖被抑制。

图2 硫酸软骨素质量浓度对鳍、吻端和肾脏组织贴壁率和迁出率的影响Fig.2 The effects of chondroitin sulfate at different concentrations on attachment rate and cell emigration of fin,lip and kidney tissues

图3 IGF-Ⅰ质量浓度对鳍、吻端和肾脏组织贴壁率和迁出率的影响Fig.3 The effects of IGF-Ⅰat different concentrations on attachment rate and cell emigration of fin,lip and kidney tissues
2.3 大泷六线鱼组织细胞原代培养的生长情况
鳍组织在DMEM/F12培养基中培养48 h后组织块边缘增厚,有上皮样细胞从周围迁出 (图4-A),培养6 d后有成纤维样细胞迁出 (图4-B),培养21 d后长成单层 (图4-C)。吻端组织在DMEM/F12培养基中培养24 h后组织块边缘增厚,培养3 d后有上皮样细胞迁出 (图4-D),培养10 d后有成纤维样细胞迁出 (图4-E),培养15 d后长成单层 (图4-F)。肾脏组织在DMEM/F12培养基中培养24 h后有大量上皮样细胞和肾小管细胞迁出 (图4-G),培养11 d后有成纤维样细胞开始迁出并迅速增殖 (图4-H),培养18 d后长成单层(图4-I)。
2.4 大泷六线鱼原代细胞的染色体观察
从染色体制片中选取形态清晰、分散良好的中期分裂相进行染色体数目统计。结果显示,大泷六线鱼3种组织原代细胞中期分裂相的染色体数目为48条 (图5)。
3 讨论
3.1 培养基对鳍、吻端和肾脏细胞生长的影响
本研究中通过比较大泷六线鱼3种细胞在L-15、DMEM和DMEM/F12培养基中的贴壁和迁出情况,发现含20%FBS的DMEM/F12(pH 7.2)是比较适合大泷六线鱼鳍、吻端和肾脏组织体外培养的培养基,这与Irnajoh等[7]报道的真鲷细胞系以及樊廷俊等[8-9]建立的褐点石斑鱼3种组织细胞系和圆斑星鲽鳃细胞系所使用的培养基一致。但目前已建立的其他海水鱼细胞系也有使用L-15培养基[10-12]和 DMEM培养基的报道。如任国诚等[13]通过在DMEM培养基中添加抗生素、胎牛血清、花鲈血清和成纤维样生长因子,成功建立了漠斑牙鲆胚胎细胞系。体外培养海水鱼类细胞系所用培养基的不同,可能与鱼类的种属及组织来源不同有关。
3.2 生长因子对细胞贴壁率和迁出率的影响
本研究在培养基中分别添加了bFGF、硫酸软骨素和IGF-Ⅰ,有效地促进了原代培养的鳍、吻端和肾脏组织的贴壁和迁出,取得了很好的效果。bFGF和IGF-Ⅰ是海水鱼类细胞培养中常用的添加因子,这两种生长因子的主要作用是与酪氨酸激酶受体结合并激活其活性,然后激活Ras蛋白,使细胞内MAP激酶的级联反应被激活,最终进入DNA合成期和分裂期,从而刺激细胞增殖[14-15]。樊廷俊等[8]在用DMEM/F12培养基培养褐点石斑鱼细胞时发现,添加10 ng/mL bFGF和40 ng/mL IFG-Ⅰ能促进褐点石斑鱼3种组织细胞的增殖能力。任国诚等[13]通过添加2 ng/mL bFGF促进漠斑牙鲆胚胎细胞的有丝分裂。硫酸软骨素是一种天然酸性黏多糖,属于高分子化合物,与细胞表面及基质中其他大分子物质密切相关,不仅对细胞具有支持和保护的作用,而且也能对细胞的分化和增殖产生作用[16]。研究表明,硫酸软骨素能促进成纤维细胞的增殖,可能是由于作为酸性物质的硫酸软骨素能够改变细胞的代谢环境,增强细胞活力,加速有丝分裂[17]。本研究中培养的大泷六线鱼3种组织细胞在培养11 d后主要都为成纤维样细胞,可能与硫酸软骨素有关。
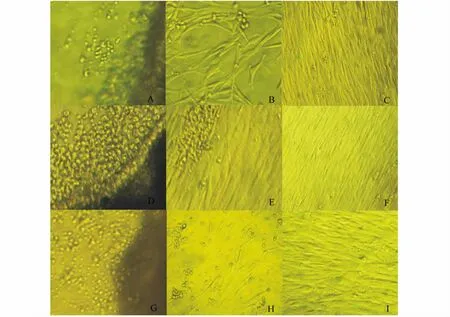
图4 大泷六线鱼鳍、吻端和肾脏原代细胞 (100×)Fig.4 Fin,lip and kidney cells from fat greenling in first passage(100×)
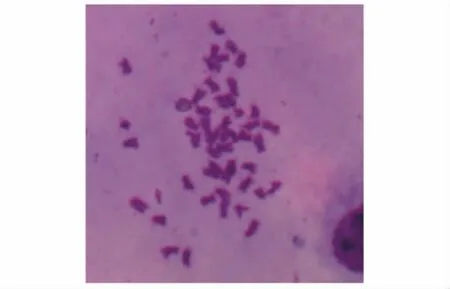
图5 大泷六线鱼鳍原代细胞染色体中期分裂相 (100×)Fig.5 Photographs of metaphase chromosomes of fin cells from fat greenling in first passage(100×)
3.3 大泷六线鱼组织细胞原代培养的生长情况和染色体观察
原代细胞培养的成功启动是建立连续性细胞系的前提。本研究中体外培养的大泷六线鱼鳍、吻端和肾脏3种细胞均质透明,生长分裂旺盛,形态均为成纤维样细胞。首次培养的72 h内首先迁出的是上皮样细胞,之后长梭型的成纤维样细胞开始迁出,随着上皮样细胞停止分裂并漂起,成纤维样细胞大量增殖并汇合成原代单层细胞。Bejar等[18]用DMEM/F12培养基培养金头鲷鳍细胞时发现,鳍组织同时迁出了上皮样细胞和成纤维样细胞,但培养几天后上皮样细胞停止生长。上皮样细胞的死亡可能与细胞寿命有关,也可能与培养基中相应的生长因子的缺乏有关,尚需作进一步地研究。
真核生物的染色体数量具有物种特异性,是一种较为准确的细胞种属鉴定指标。本研究中对染色体的观察结果显示,大泷六线鱼3种组织原代细胞的染色体数目为48条,与卓孝磊等[19]报道的大泷六线鱼染色体数目相同。除能证明所用的试验材料为大泷六线鱼外,还说明现有试验条件满足3种组织生长的需要,细胞通过有丝分裂增殖。同时本研究为利用原代细胞进行染色体分析提供了一种有效的方法。
[1]黄宗国.中国海洋生物种类与分布[M].北京:海洋出版社,1994:741.
[2]中国科学院海洋研究所.中国经济动物志(海产鱼类)[M].北京:科学出版社,1962:135-137.
[3]温海深,王连顺,牟幸江,等.大泷六线鱼精巢发育的周年变化研究[J].中国海洋大学学报:自然科学版,2007,37(4):581-585.
[4]邱丽华,姜志强,秦克静,等.大泷六线鱼仔鱼摄食及生长的研究[J].中国水产科学,1999,6(3):1-4.
[5]冯昭信,韩华.大泷六线鱼资源合理利用[J].大连水产学院学报,1998,13(2):24-28.
[6]郑家声,王梅林,史晓川,等.欧氏六线鱼性腺发育的周年变化研究[J].青岛海洋大学学报,1997,27(4):497-503.
[7]Irnajoh M,Ikawa T,Oshima S.Characterization of a new fibroblast cell line from a tail fin of red sea bream,Pagrus major,and phylogenetic relationships of a recent RSIV isolate in Japan[J].Virus Res,2007,126(1):45-52.
[8]樊廷俊,魏云波,徐晓辉,等.褐点石斑鱼三种组织细胞系的建立[J].中国海洋大学学报:自然科学版,2009,39(5):961-967.
[9]樊廷俊,郭雪阳,姜国建,等.圆斑星鲽连续性鳃细胞系的建立[J].中国海洋大学学报:自然科学版,2010,40(9):69-74.
[10]Qin Q W,Shi C,Gin K Y,et al.Antigenic characterization of a marine fish iridovirus from grouper Epinephelus spp.[J].J Virol Methods,2002,106(1):89-96.
[11]Qin Q W,Wu T H,Jia T L,et al.Development and characterization of a new tropical marine fish cell line from grouper,Epinephelus coioidcs susceptible to iridovirus and nodavirus[J].J Virol Methods,2006,131(1):58-64.
[12]Lai Y S,John J A,Lin C H,et al.Establishment of cell lines from a tropical grouper,Epinephelus awoara(Temminek & Schlegel),and their susceptibility to grouper iridovirus and nodaviruses[J].J Fish Dis,2003,26(1):31-42.
[13]任国诚,陈松林,沙珍霞.漠斑牙鲆胚胎细胞系的建立与鉴定[J].中国水产科学,2007,14(4):579-583.
[14]Hrzenjak M,Shain S A.Protein kinase C-dependent and-independent pathways of signal transduction in prostate cancer cells:fibroblast growth factor utilization of a protein kinase C-independent pathway[J].Cell Growth and Differentiation,1995,6(9):1129-1142.
[15]Sivaprasad U,Fleming J,Verma P S,et al.Stimulation of insulinlike growth factor(IGF)binding protein-3 synthesis by IGF-I and transforming growth factor-alpha is mediated by both phosphatidylinositol-3 kinase and mitogen-activated protein kinase pathways in mammary epithelial cells[J].Endocrinology,2004,145(9):4213-4221.
[16]李玉瑞.细胞外间质的生物化学及研究方法[M].北京:人民卫生出版社,1988:133-137.
[17]王红蓓,孔宪涛,张玲玲.硫酸软骨素A对NIH-3T3鼠成纤维细胞及人皮肤成纤维细胞增殖的影响[J].第二军医大学学报,1994:15(2):161-164.
[18]Bejar J,Borrego J,Alvarez C M.A continuous cell line from the cultured marine fish gilthead seabream(Sparus aurata L.)[J].Aquaculture,1997,150(1-2):143-153.
[19]卓孝磊,邹记兴.我国海水鱼核型及染色体显带研究进展[J].热带海洋学报,2007,26(5):73-80.

