块菌属研究概况*
孔庆龙,邰丽梅,刘 蓓,樊 建**,赵天瑞
(1.昆明理工大学化学工程学院,云南 昆明 650000;2.云南省供销合作社科学研究所,云南 昆明 650221)
食用菌因为具有独特的香味和口感,已经证明和潜在的生物活性,成为了一种广受人们欢迎的食物。在所有食用菌中,块菌(Genus Tuber)有着许多独特的特性,其具有极高的经济价值,是世界上所有食用菌中最昂贵的,在欧洲被称为“黑色的钻石”、“地下黄金”。根据种类的不同,在欧洲市场上块菌的价格从每千克600欧元~6 000欧元不等[1]。块菌广泛分布于北半球温带地区,欧洲、北美、东南亚是其主要分布区域。块菌在外观上与其它食用菌有很大的不同。无菌柄,无菌褶,子实体地下生,成熟的子实体呈现出密实的木质特征[2],其子囊果的主要形态特征是表面光滑或具疣突;产孢组织中实,具有白色大理石花纹状菌脉;子囊含1个~8个孢子,随机排列于产孢组织中;子囊孢子表面具有刺状或蜂窝状网纹[3]。
虽然块菌的研究已经进行了很长时间,但仅限于对其芳香性质、真菌学和人工培养等方面。最近几年才有越来越多的研究人员意识到块菌良好的生物活性,研究、探索块菌在食品工业中的应用,并通过研究证实块菌潜在的生物活性来增加块菌及其相关产品的商业价值。此外,科学家们已经研究出一些方法来控制块菌采收后的变质,来保持块菌的感官品质并延长块菌产品的货架期[4-6]。
1 块菌的化学特性
1.1 营养成分
研究表明,块菌属含有丰富的蛋白质、氨基酸和不饱和脂肪酸。此外,还含有丰富的矿物质和固醇类物质。
Kagan-Zur和Roth-Bejerano等[7]对沙漠块菌的化学组成做了分析研究,结果显示沙漠块菌固形物含有20%~27%的蛋白质(其中85%人体可以消化)、3%~7.5%的脂质、7%~13%的纤维素、大约60%的碳水化合物、2%~5%的Vc。Saltarelli等[6]对4种欧洲块菌(T.melanosporum、T.aestivum、T.magnatum、T.borchii)的蛋白质含量进行了评价,蛋白质含量在8.7%~24%(每100g干样品),并再次证明了块菌中含有丰富的半胱氨酸、甲硫氨酸和赖氨酸;且在这4种块菌中白块菌(T.magnatum)的蛋白质含量最高而黑胞块菌(T.melanosporum)最低,并推断出欧洲块菌富含含硫氨基酸,同时证实了欧洲块菌含有相当丰富的 K、P、Fe、Ca。
1.2 芳香成分
块菌属的子囊果具有独特的香味,正是这种独特的香味使块菌价值非凡、倍受欢迎,在法国和意大利块菌经常是不经过烹调就食用的,为的就是保留其独特的香味。法国佩利格尔的黑块菌被认为是最香的,而意大利的白块菌被认为是香气最好的,夏块菌的香味比黑块菌和白块菌稍逊一些,但其适中的价格和不错的香气也得到了广泛的关注[8]。为此,科学家们对块菌的挥发性成分进行了大量研究,对块菌香味的描述有泥土香气、麝香味、辛辣味等。到目前已经从不同的块菌种类中分离出了200多种挥发性组分[9,10],科学家们也更加了解了这些组分在不同块菌种类中所起到的作用。这些研究结果还明确了地理学分布、起源、宿主木和子囊果中寄生的微生物与其挥发性成分的组成有很大关系[9-11]。
Cullere等[8]采用气相色谱-嗅觉测量法(GC-O) 对黑块菌 (Black truffle) 和夏块菌 (Summer truffle) 的香气成分做了分析。结果显示,黑块菌放出17种不同的香气分子。6种是第1次被报道,即1-己烯-3-酮、2-甲基-3-呋喃硫醇、呋喃酮、3-乙基苯酚、3-丙基苯酚、5-甲基-2-丙基苯酚。黑块菌香气成分中最重要的化合物为2,3-丁二酮、二甲基二硫化合物、丁酸乙酯、二甲基硫化物、3-甲基-1-丁醇和3-乙基-5-甲基苯酚;含量最多的化合物是3-乙基-5-甲基苯酚,占到总量的50%、5-甲基-2-丙基苯酚、β-苯乙醇、3-乙基苯酚。对于夏块菌,重要的香气分子是二甲基硫化物、二甲基二硫化物、甲硫基丙醛、3-甲基-1-丁醇、1-己烯-3-酮和3-乙基苯酚;含量最多的是β-苯乙醇、二甲基硫化物和3-乙基苯酚,但夏块菌的香气成分含量比黑块菌少100倍。Gioacchini等[12]采用顶空-固相微萃取分析技术和气质联用分析技术相结合,对6种不同种类的块菌进行了分析(T.magnatum Pico、T.borchii Vittad,Tuber dryophilum Tul.、 T.aestivum Vittad.、Tuber mesentericum Vittad.、T.brumale Vittad),确认了 36种挥发性有机化合物,包括烷烃、醇、酯、醛、酮、萜和甾类等。他们还进一步确认了不同的地理起源对白块菌(T.magnatum Pico)的挥发性有机化合物组成有很大的影响。March等[13]采用动态顶空收集技术收集块菌的挥发组分,并用高灵敏度的气质联用设备对6种块菌进行了分析(T.aestivum、T.brumale、T.melanosporum、Tuber miesentericum、Tuber rufum、Tuber simonea),确认了36种挥发性有机化合物。采用相同的分析方法,Vernin等[14]用戊烷和乙醚做溶剂和固相为萃取2种方法提取黑胞块菌(T.melanosporum)的香气成分,成功确认了131种香气成分。其中对黑胞块菌芳香性贡献大的是杂环类化合物、单萜、烃类、香茅醇、倍半萜烃类、芳香族化合物、脂肪醇、有机酸、醛、硫化物、甲氧基苯和甲苯。
Aprea等[15]介绍了一种新的分析方法,即质子迁移反应质谱。他们用这种方法首次确定了来自意大利6个不同区域的18种白块菌(T.magnatum Pico) 中的不同硫化物成分。与气相色谱方法相比,质子迁移反应质谱法有更高的灵敏度,可减少样品预处理的量及破坏程度。将质子迁移反应质谱法与气质联用方法相结合能够让研究人员鉴定出更多的化合物。研究人员还发现将气相色谱-嗅觉测量法和固相微萃取技术、气质联用技术相结合就能够得到更多的关于块菌芳香成分的信息。通过这种方法,Piloni等[16]首次从采自意大利阿尔巴地区的白块菌(T.magnatum Pico)中鉴定出二乙基砜和二甲基亚砜。他们同样也找到了2种重要的白块菌香气成分,二(甲硫基)甲烷和二甲基硫化物。Cullere等[8]也从黑胞块菌(T.melanosporum)中鉴定出了5种香气成分,即1-己烯-3-酮、2-甲基-3-呋喃硫醇、呋喃酮、3-乙基苯酚、3-丙基苯酚、5-甲基-2丙基苯酚。
除了含有不同的香气成分组成以外,不同块菌中香气成分含量也是不同的。现在被科学家普遍接受的从高到底的排序是黑块菌、白块菌、夏块菌。Cullere等[8]报道过黑块菌的香气成分含量是夏块菌的100倍,这也解释了为什么黑块菌会被看作块菌中最香的。
2 块菌的生物活性
块菌除了具有优良的营养价值、独特的香气和风味,还拥有良好的生物活性,已经确定的生物活性包括抗病毒、抑菌、抗氧化、保肝、抗突变和消炎等。这些优良的生物活性使科学家们对其产生了浓厚的兴趣,他们相信这能为块菌的相关产品增加很高的经济价值。
Janakat等[17,18]报道 T.claveryi的提取物对绿脓假单胞杆菌有良好的抑菌活性,还发现Tirmania truffles的甲醇提取物的抑菌活性要强于乙醇、水、乙酸乙酯的提取物;而Terfezia的乙醇提取物对革兰氏阳性和阴性菌有最广的抗菌谱,5%的水提物对金黄色葡萄球菌有良好的抑制作用,甲醇提取物则无抑菌效果。
除了抗病毒和抑菌性,块菌的高效抗氧化性也引起科学家们的关注。氧化是导致机体衰退的重要原因,很多疾病都因氧化而起,比如一些癌症和心脏病。因此,具有抗氧化活性的食品现在倍受人们青睐,其经济价值也非常高,而块菌正是一类非常好的抗氧化食品。目前的用研究也显示部分块菌的抗氧化活性是优于其他食用菌的[19]。
Al-Laith等[20]对采自不同国家(巴林、伊朗、摩洛哥、沙特)的沙漠块菌T.nivea干品的抗氧化活性做了评估。4种块菌的抗氧化成分见表3,抗氧化性评价见表4。
从表中可以看出,主要的抗氧化活性物质为酚类,包括总酚、自由酚和黄酮类。Stanikunaite等[21]将E.granulate的提取物与细胞一起经行体外培养,采用组织活性氧荧光定量法分析,结果表明E.granulate的提取物具有很强的抗氧化能力。
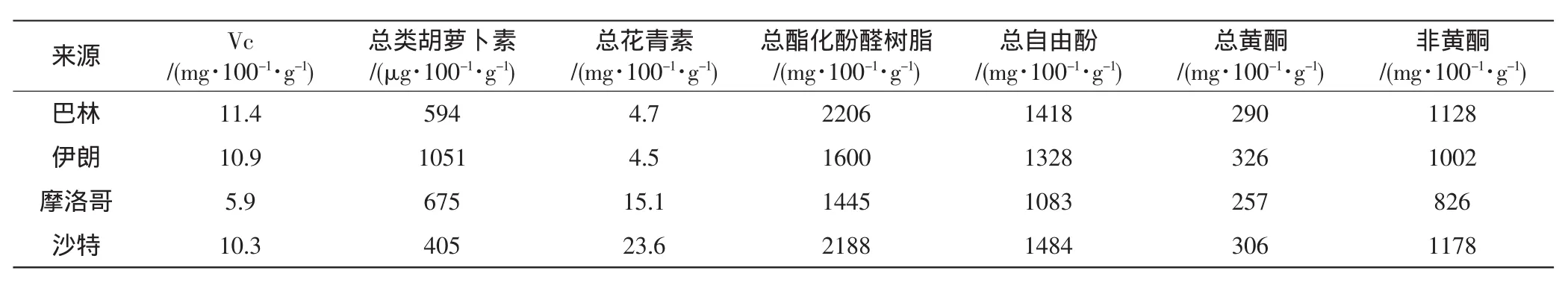
表3 不同起源块菌抗氧化成分表

表4 不同起源块菌抗氧化评价表
Janakat和 Nassar[22]用CCl4侵害雄性威斯特白鼠来评价T.claveryi的水提物、甲醇提取物、石油醚提取物对肝脏的保护作用。分别用水、甲醇、石油醚的提取物喂养白鼠,每天2次,连续3 d,之后对白鼠进行肝细胞毒性诱导剂(CCl4和橄榄油混合物)注射,注射量为每千克体重每次2 mL CCl4;在白鼠中毒后的1 h和4 h在进行2次提取物喂养,发现T.claveryi的水提物对CCl4引起的肝中毒有很强的抗性。
Fratianni等[23]对产自意大利的夏块菌(T.aestivum) 的抗突变性进行了测试。采用埃姆斯试验测试新鲜的和受过辐射的夏块菌的水提物和乙醇提取物对标准诱变剂的抗性,发现新鲜的和受过辐射的夏块菌的提取物对标准诱变剂都具有良好的抗性;新鲜夏块菌的水提物有最高的抗突变活性,新鲜夏块菌的乙醇提取物抗突变活性最弱。
Stanikunaite等[21]通过对环氧合酶-2的抑制来评价E.granulates的消炎性能。结果显示E.granulates的提取物对在浓度为50 μg·mL-1是对环氧合酶-2的清除率为68%;此外他们还发现E.granulates中含有的丁香醛和丁香酸也具有消炎作用,对环氧合酶-2的清除率以IC50表示分别为 3.5 μg·mL-1和 0.4 μg·mL-1。
块菌具有多种生物活性使其有了制成药品的潜力,使其越来越受到世人的关注。但应该注意的是,块菌的大部分生物活性都相对较弱,而且现在也不是非常清楚具体是哪种化合物在发挥相应的活性,还需要更深入的研究。
3 块菌的保藏
块菌拥有迷人的香气,丰富的营养和优良的生物活性,但这些都直接依靠块菌子实体的保藏。只有采用适当的保藏方法才能保护好块菌的香气、营养和生物活性,才能延长块菌食品的货架期,给人们带来更高的利益。
4℃冷藏是大家最认可的一种保藏方式,这种保藏方法能够有效的减少由微生物引起的和内源的腐败变质,同时最大限度的保持块菌的香气、营养和生物活性。Roberta等[24]对白块菌(T.Magnatum)、波奇块菌(T.Borchii)、黑胞块菌(T.melanosporum)、夏块菌(T.aestivum) 进行了保藏性试验。他们将样品分成3组,分别进行4℃冷藏30 d、-20℃冷冻30 d,再解冻在4℃冷藏、高压蒸汽灭菌处理。检测糖和蛋白质的含量以及酶的活性来判断保藏效果。他们的研究显示4℃冷藏是鲜块菌的最佳保藏方法。黑胞块菌和夏块菌对生化腐败的抗性要强于白块菌和波奇块菌,但白块菌对微生物腐败的抗性要强于其它的块菌。
虽然冷藏是被广泛接受的一种保藏技术,但研究发现辐照保藏也是一种很有效且高效的块菌保藏方法。Reale等[25]研究发现适当强度的辐照(1.5 KGy)能够有效的防止块菌蛋白质的分解,保持块菌的新鲜度并延长货架期。虽然辐照保藏是一种很好的技术手段,但消费者对采用辐照保藏的产品是不大接受的,这还需要各方面的普及宣传,让辐照保藏技术早日被人们所接受。
气调包装是一种常用的果蔬保藏方法,通过混合不同浓度的适当的气体来取代原有的空气,就能抑制果蔬的呼吸作用从而减缓氧化导致的变质、微生物的生长和感官的变化。Rivera等[5]发现将15%CO2和7%O2混合用微穿孔膜包装,能将黑胞块菌的货架期延长到28 d。Elias等[26]对T.uncinatum在高二氧化碳低氧环境下的新陈代谢做了研究,发现在高CO2(50%)低O2(5%)的条件下能够很好的控制微生物的生长,降低多酚的浓度和块菌的抗氧化活性,并通过抑制乙醇脱氢酶和乳酸脱氢酶的活性减少乙醇和乳酸的形成,降低精胺和亚精胺的含量,将T.uncinatum的货架期延长到29 d。但气调包装的成本较高,可能引起水分在产品表面堆积,促进微生物的生长并使产品发粘。
每种保藏方法都有一定的不足,因此需要将多种保藏方法相结合,以达到最佳的保藏性。Al-Ruqaie[27]将块菌在4%沸腾的NaCl溶液中进行热烫4 min,之后立刻在-18℃进行速冻,发现这种方法对块菌的保藏起到良好作用。Rivera等[28]将气调包装和辐照保藏相结合,采用P-Plus微穿孔膜进行气调包装,然后用2.5 KGy电子束进行辐照,再在4℃进行冷藏,可将夏块菌(T.aestivum)的货架期延长到42 d。同时还发现将夏块菌和黑胞块菌浸入到70%的乙醇溶液中,用35 Hz超声波清洗10 min,然后进行气调包装,在4℃储藏28 d后依然保持良好的感官质量[29]。
4 结论
块菌不仅能为菜肴和糖果添加特殊香味,更能将其丰富的营养和多种生物活性应用到生产中。如何将块菌的化学和生物活性融入到块菌及其相关产品中成为了现在研究的重点。有3点需要特别注意:由于采用不同的保藏方法,块菌品种可能会有较大的变化。虽然人们做了很大的努力,但是现在仍不清楚哪一种保藏方法才能最有效地延长货架期并很好地维持块菌原始的香气和感官质地;随着提取和分析技术的发展,目前能够确定更多的块菌营养成分、香气成分和生物活性成分,但如何利用这些发现加强块菌的功能性并将这些先进的技术应用到块菌的保藏中、随时监视其中的物质成分变化还有待探讨;对块菌活性成分进行鉴定、表征和提纯非常重要,因为这些活性成分很有可能成为新的药品来源。
[1]Luard E.Truffles[M].Tennessee:Frances Lincoln Ltd,2006.
[2]Hall IR,Brown GT,Zambonelli A.Taming the truffle[M].Portland,Oregon,USA:Timber Press,Inc.,2007.
[3]Trappe JM.The orders,familier,and genera of hypogeous Ascomycotian (truffles and their relatives)[J].Mycotaxon,1979(9):297-340.
[4]Nazzaro F,Fratianni F,Picariello G,et al.Evaluation of gamma rays influence on some biochemical and microbiological aspects in black truffles[J].Food Chemistry,2007(103):344-354.
[5]Rivera SC,Blanco D,Salvador LM,et al.Shelf life extension of fresh Tuber aestivum and Tuber melanosporum truffles by modified atmosphere packaging with microperforated films[J].Journal of Food Science,2010,75(4):225-233.
[6]Saltarelli R,Ceccaroli P,Cesari P,et al.Effect of storage on biochemical and microbiological parameters of edible truffle species[J].Food Chemistry,2008(109):8-16.
[7]Kagan-Zur V.,Roth-Bejerano.Dessert truffles[J].Truffles,2008(1):32-37.
[8]Cullere L,Ferreira V,Chevret B,et al.Characterisation of aroma active compounds in black truffles(Tuber melanosporum)and summer truffles (Tuber aestivum) by gas chromatography-olfactometry[J].Food Chemistry,2010(122):300-306.
[9]Diaz P,Ibanez E,Senorans FJ,et al.Truffle aroma characterization by headspace solid-phase microextraction[J].Journal of Chromatography A,2003,1017(1-2):207.
[10]Mauriello G,Marino R,D'Auria M,et al.Determination of volatile organic compounds from Truffles via SPME-GC-MS[J].Journal of Chromatographic Science,2004,42(6):299-305.
[11]Pietro B,Chiara G,Benedetta T,et al.Production of volatile organic compounds(VOCs)by yeasts isolated from the ascocarps of black(Tuber melanosporum Vitt.)and white(Tuber magnatum Pico)truffles[J].Archives of Microbiology,2005,184 (3):187-193.
[12]Gioacchini AM,Menotta M,Bertini L,et al.Solid-phase microextraction gas chromatography/mass spectrometry:a new method for species identification of truffles[J].Rapid Communications Mass Spectrometry,2005,19(17):2365-2370.
[13]March RE,Richards DS,Ryan RW.Volatile compounds from six species of truffle-head-space analysis and vapor analysis at high mass resolution[J].International Journal of Mass Spectrometry,2006(249):60-67.
[14]Vernin G,Casabianca H,Parkanyi C,et al.GC/MS analysis of the volatile compounds of tuber melanosporum from Tricastin and Alpes de Haute Provence (France)[J].Food Flavor and Chemistry:Explorations into the 21st Century,2005(300):115-135.
[15]Aprea E,Biasioli F,Carlin S et al.Rapid white truffle headspace analysis by proton transfer reaction mass spectrometry and comparison with solid-phase microextraction coupled with gas chromatography/mass spectrometry[J].Rapid Communications in Mass Spectrometry,2007(21):2564-2572.
[16Piloni M,Tat L,Tonizzo A,et al.Aroma characterisation of white truffles by GC-MS and GC-O[J].Italian Journal of Food Science,2005,4(17):463-468.
[17]Janakat SM,Al-Fakhiri SM,Sallal AKJ.Evaluation of antibacterial activity of aqueous and methanolic extracts of the truffle Terfezia claveryi against Pseudomonas aeruginosa[J].Saudi Medical Journal,2005,26(6):952-955.
[18]Janakat SM,Al-Fakhiri SM,Sallal AKJ.A promising peptide antibiotic from Terfezia claveryi aqueous extract against Staphylococcus aureus in vitro[J].Physiotherapy Research,2004(18):810-813.
[19]Sunan Wang,Massimo F,Marcone.The biochemistry and biological properties of the world's most expensive underground edible mushroom:Truffles[J].Food Research International,2011(44):2567-2581.[20]Al-Laith,Ameer AA.Antioxidant components and antioxidant/antiradical activities of desert truffle (Tirmania nivea) from various middle eastern origins[J].Journal of Food Composition and Analysis,2010(23):15-22.
[21]Stanikunaite R,Shabana KI,Trappe JM,et al.Cyclooxygenase-2 inhibitory and antioxidant compounds from the truffle Elaphomyces granulatus[J].Phytotherapy Research,2009,23(4):575-578.
[22]Janakat S,Nassar M.Hepatoprotective activity of desert truffle (Terfezia claveryi)in comparison with the effect of Nigella sativa in the rat[J].Pakistan Journal of Nutrition,2010(9):52-56.
[23]Fratianni F,Di L,Aldo,et al.Mutagenic and antimutagenic properties of aqueous and ethanolic extracts from fresh and irradiated Tuber aestivum black truffle:a preliminary study[J].Food Chemistry,2007(102):471-474.
[24]Roberta S,Ceccaroli P,Cesari P,et al.Effect of storage on biochemical and microbiological parameters of edible truffle species[J].Food Chemistry,2008(109):8-16.
[25]Reale A,Sorrentino E,Iacumin L et al.Irradiation treatments to improve the shelf life of fresh black truffles (truffles preservation by gamma-rays)[J].Journal of Food Science,2009,74(4):196-200.
[26Elias SH,Riccardo M,Rinaldo B,et al.Influence of high carbon dioxide and low oxygen on the postharvest physiology of fresh truffles[J].Postharvest Biology and Technology,2010(58):36-41.
[27]Al-Ruqaie IM.Effect of different treatment processes and preservation methods on the quality of truffles I.conventional methods(drying/freezing)[J].Journal of Food Process and Preservation,2006(30):335-351.
[28]Rivera SC,Blanco D,Marco P et al.Effects of electron-beam irradiation on the shelf life,microbial populations and sensory characteristics of summer truffles (Tuber aestivum)packaged under modified atmospheres[J].Food Microbiology,2011(28):141-148.
[29]Rivera SC,Venturini EM,Oria R,et al.Selection of a decontamination treatment for fresh Tuber aestivum and Tuber melanosporum truffles packaged in modified atmospheres[J].Food Control,2011(22):626-632.

