西藏林芝地区黑木耳优良菌株的筛选与鉴定*
刘振东,赵丹丹,孙 越,王 静,雷 虹,董泽军,张彦龙**
(1.黑龙江大学生命科学学院,微生物黑龙江省高校重点实验室,黑龙江 哈尔滨 150080;2.中科院昆明植物研究所,植物化学与西部植物资源持续利用国家重点实验室,云南 昆明 650204)
黑木耳也称木耳、云耳、光木耳,是木耳属中分布最广泛的种之一[1],它隶属于担子菌门、层菌纲、木耳科、木耳属,学名为Auricularia auricula(L.ex Hook) underw[2]。
西藏林芝地区位于青藏高原东南部,雅鲁藏布江下游,被喜马拉雅山脉、念青唐古拉山脉和横断山脉形成的群山环绕[3],自然条件复杂而独特,由于受印度洋季风影响,这里夏季雨量充沛,形成了丰富多样的植物及森林植被,同时林下也孕育着大量的食用菌资源,由于西藏独特的地理条件,使该地区的野生食用菌的种质资源相对独立。当地产的野生黑木耳,耳形好,口感佳,深受广大消费者的青睐。我国目前用于生产的黑木耳菌种老化、产量下降,同种异名的现象十分严重,因而远源新品种的开发对黑木耳产业的发展至关重要。本研究通过对在林芝地区不同地点采集到的20株优良菌株,进行筛选与鉴定,最后得到1株优良菌株。
1 材料与方法
1.1 供试材料
1.1.1 培养基
母种培养基配方(cPDA培养基):去皮马铃薯200 g(煮汁100 mL)、葡萄糖20.0 g、KH2PO43.0 g、MgSO41.5 g、琼脂14.0 g,补水至1 000 mL。
原种培养基配方:木屑(阔叶硬杂木)78%、麦麸(或米糠)20%、石膏1%、白砂糖1%,含水量60%。
栽培种培养基配方:木屑(阔叶硬杂木)84%、麦麸10%、黄豆粉2%、玉米粉2%、石灰1%、石膏1%,含水量65%。
cPDA液体培养基:去皮马铃薯200 g(煮汁1 000 mL)、葡萄糖20.0 g、硫酸镁1.5 g、磷酸二氢钾3.0 g、蛋白胨0.5 g、维生素B110.0 mg,加蒸馏水定容至1 000 mL。
1.1.2 菌株
筛选菌株:从西藏林芝地区米林、郎县、工布江达、波密、察隅、墨脱等地的20个不同地点采集得到,编号为X1~X20。
对照菌株黑29(黑龙江省应用微生物研究所)、9809(东宁县食用菌研究所)。
1.2 试验方法
1.2.1 纯种分离
首先将野外采集的野生菌株标本核对原始序号,后用高锰酸钾-甲醛溶液进行熏蒸处理30 min,最后将处理过的子实体置于超净工作台上进行无菌分离[4],将分离出来的黄豆粒大小的子实体接种到PDA培养基上,25℃培养15 d后,对菌丝进行纯化,方法是在菌落边缘挑取尖端菌丝体,移殖到试管培养基斜面上,在25℃下培养,如此重复3次。纯化后的菌种接入装有木屑培养基的试管中,作为备份。
1.2.2 初筛(生理性能测定)
将分离得到的20株菌株与对照菌株,分别接种到PDA综合培养基,置于24℃~25℃培养箱中培养,每隔24 h观察1次,并记录各菌丝的生长速度及菌落形态,并用琼脂糖扩散法[5]进行拮抗分析。拮抗反应的形态特征按照《绿色食品食用菌NY/T749-2003》规定的定义判[6]。
1.2.3 复筛(菌株比较试验)
将初筛入选的8株菌株进行复筛,每个菌株分别培养1 000袋栽培种,从中随机抽取400袋进行栽培试验。具体扩培比例是1支试管一级菌种→5袋二级菌种→400袋三级菌(栽培种),在菌种逐级扩培过程中定时观察,记录各菌株在各级培养基上的萌发时间、菌丝生长情况、抗污染能力。在田间管理阶段观察记录个菌种子实体的产量及商品性能。
纤维素酶活力测定,用3,5-二硝基水杨酸法[7]测定菌丝生长阶段和出耳阶段的纤维素酶活力,接种20 d后,定期对菌袋取样,每次取培养料20.0 g放于烧杯中,加入40 mL生理盐水后立即封口,在40℃水浴条件下提取酶液后过滤,并吸取3 mL酶液利用比色法进行测定。
1.2.4 优良菌种鉴定
(1)液体菌种的制备
将80 mL cPDA液体培养基装入250 mL三角瓶中,121℃灭菌 30 min。
冷却后接入适龄的斜面菌丝片段,25℃静止培养2 d~3 d,然后在130 r·min-1摇床培养 3 d~5 d。
(2) DNA的提取
黑木耳液体菌种扩培后,收集0.1 g菌丝体置于液氮中研磨,之后采用CTAB法提取基因组DNA并用1%的琼脂糖凝胶电泳检测,具体过程按贾定洪等的方法进行[8]。
(3) ITS序列的PCR扩增
ITS序列采用真菌通用引物[9]ITS1(5'-TCCGTAGGTGAACCTGCGG-3')和 ITS4(5'-TCCTCCGCTTATTGATATGC-3')进行PCR扩增,引物由上海Sangon公司合成,扩增在Biometra T1 Thermocycler PCR仪上进行,PCR扩增产物用1%的琼脂糖凝胶电泳进行检测,然后用琼脂糖凝胶回收试剂盒进行回收。
(4) ITS片段的克隆
将PCR纯化产物与PMD-18T Vector(Takara公司)连接后,转化至大肠杆菌JM109感受态细胞中,用含XGal、IPTG、Amp LB平板筛选,挑白色菌落培养,提取质粒做PCR检测。
(5) 测序
电泳检测阳性克隆成功后,将该管菌液送往测序北京生工测序公司进行测序。
(6)系统发育树的构建
将测得的优良菌株的ITS序列在GenBank上进行BLAST分析,利用软件Clustal X进行同源性比较,利用MEGA4软件绘制系统发育树。
2 结果与分析
2.1 初筛结果
将20株菌株接种在PDA斜面试管和PDA培养皿上,其生长情况与对照菌株的生长情况进行比较,结果有8株因与对照菌株相比生长速度慢、长势弱而被淘汰。
拮抗实验是为了检测各菌株间是否为独立的菌株,淘汰那些编号不同但基因型相同的菌株,结果有4株菌株因无拮抗现象发生而被淘汰。
2.2 复筛结果
实验菌株与对照菌株在各级培养基上的生长速度情况见表1。

表1 实验菌株与对照菌株在各级培养基上的生长速度
由表1可知,菌株6号、7号生长旺盛,菌丝粗壮、洁白。纤维素酶活力比较情况见表2。
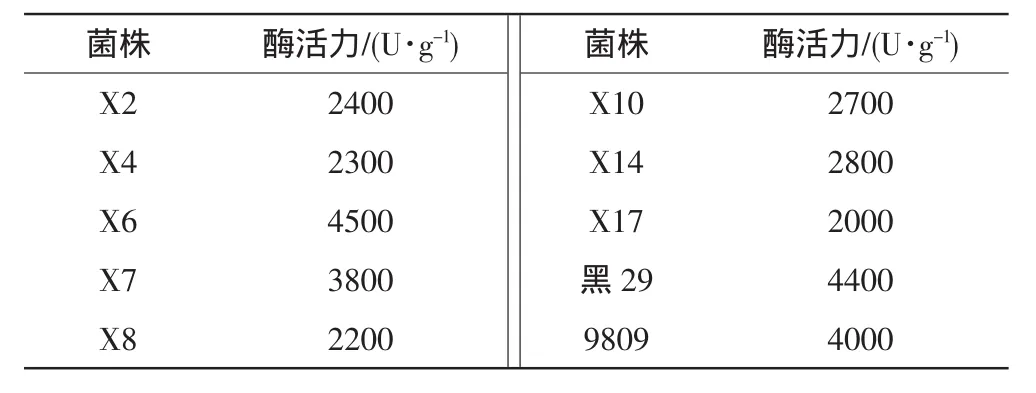
表2 纤维素酶活力比较
由表2可知,X6菌株的纤维素酶活力居参试菌株和对照菌株之首。自然条件下三级菌抗污染能力及产量情况见表3。
由表3可知,6号菌株产量达到48 g·袋-1,高于其他试验菌株与对照菌株。杂菌率方面除2号和7号菌株与对照菌株中黑29持平外,其他试验菌株的杂菌率都低于对照菌株。商品性能分析见表4。
通过对各菌株商品性能的比较分析可知,4号、6号、7号、14号和17号菌株大多呈片状或者碗状,表现为小根且易开片。
综合以上各指标可确定西藏6号,为优良菌株,结果见图1。
2.3 鉴定结果

表3 自然条件下三级菌抗污染能力及产量
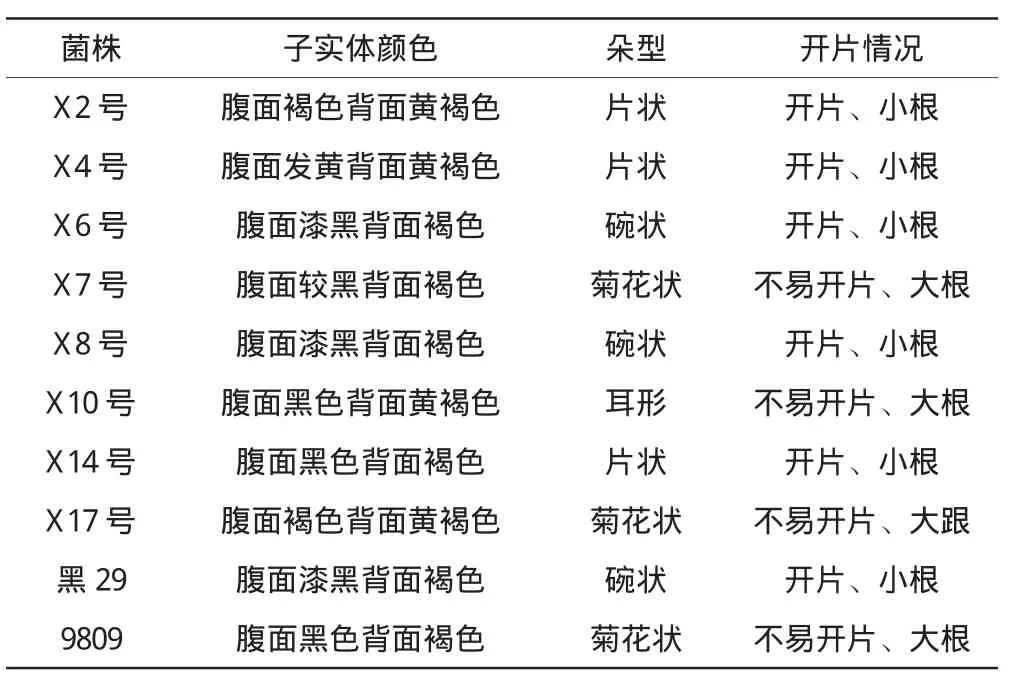
表4 商品性能分析

图1 X6菌株子实体与三级菌菌袋
用CTAB法提取黑木耳液体菌种基因组DNA,1%琼脂糖凝胶电泳检测结果见图2。
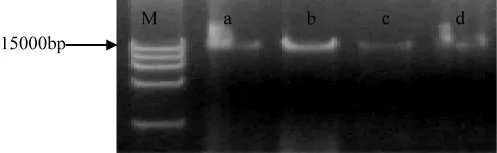
图2 电泳检测结果
由图2可知,提取的DNA条带清晰,b、c没有明显的拖尾现象,说明DNA无蛋白质及RNA污染,完整性较好,可用于后续实验。18Sr DNA PCR扩增的琼脂糖凝胶电泳结果见图3。
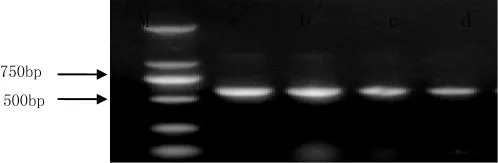
图3 18Sr DNA的PCR扩增的琼脂糖凝胶电泳(1%)
由图3可知,所获得的电泳条带600 bp左右,与预期结果一致。转化子通用引物PCR鉴定结果见图4。

图4 转化子通用引物PCR鉴定
由图4可知,菌液均出现特异性条带,可初步取定转化子为阳性。基于ITS序列构建的黑木耳属系统发育树见图5。

图5 基于ITS序列构建的黑木耳属系统发育树
通过系统进化树可知,X6菌株与数据库中的黑木耳菌株916为主的亚群处在同一分支上,因此可以确定被鉴定的优良菌株X6与黑木耳菌株916同源性最大,同为木耳属黑木耳种。
3 结论
本研究中供试材料均采自林芝地区境内有野生黑木耳分布,且周边无人工栽培黑木耳的深山,从而最大程度排除材料受人工栽培种质漂移的可能性。通过对采集并且分离得到的20株优良野生黑木耳菌株,进行常规的菌种筛选研究,最终筛选出了优良菌株X6,其在菌丝生长速度、长势、抗杂能力等方面均优于其他菌株与对照菌株。
本研究采用rDNA-ITS序列对所得优良菌株进行分子鉴定,因为该序列变异较快,可提供比较丰富的变异位点和信息位点,因此可作为一种分子标记用于探讨真菌种内变异和属内种间分子系统关系[10,11]。近年来鉴于ITS序列方便、快速的特点,因此经常用于鉴定一些未知植株,如侯军利用ITS序列对疑似菌株白羊肚菌进行了初步分子鉴定[12]。本试验对所筛选得到的X6菌株,进行鉴定的结果显示,X6菌株与数据库中的黑木耳916菌株处于同一分支,由此可断定X6菌株为木耳属黑木耳种。
明确了X6菌株的优良性能及其种属关系后,建议该菌种可作为林芝地区人工袋料栽培黑木耳的母种进行推广使用。
[l]张金霞,谢宝贵.食用菌菌种生产与管理手册[M].北京:中国农业出版社,2006.
[2]王贵祥.食用菌栽培学[M].北京:中国农业大学出版社,2008.
[3]郎奎建.西藏林芝地区景观生态格局分析[J].林业资源管理,2004(10):53-57.
[4]刘光彦.一种快速简便的黑木耳组织分离新方法[J].贵州农业科学,2005,33(1):73.
[5]Holt JG,Krieg NR,Sneath PH,et al.Bergey's manual of determinative bacteriology[M].Lippincott Williams&Wilkins,1993.
[6]农业行业标准.绿色食品食用菌NY/T749-2003[S].中华人民共和国农业部,2004.
[7]李守勉,李明,田景花,等.8个杏鲍菇菌株胞外酶活性及蛋白质含量的研究比较[J].食用菌学报,2007,29(6):11-12.
[8]贾定洪,郑林用,王波,等.五个野生木耳属菌株的ISSR分析[J].食用菌学报,2008,15(3):7-12.
[9]吴发红,黄东益,黄小龙,等.几种真菌DNA提取方法的比较[J].中国农学通报,2009,25(8):62-64.
[10]Glen M,Tommelupic,Bougher NL,et al.Specificity,sensitivity and discrimination of primers for PCR-RFLP of larger basidiomycetes and their applicability to identification of ectomycorrhizal fungi in Eucalyptus forests and plantations[J].Mycological Research,2011(105):138-49.
[11]Colpaert JV,Vandenkoornhuyse P,Adriaensen K,et al.Genetic variation and heavy metaltolerance in the ectomycorrhizal basidiomycete Suillus luteus[J].New Phytologist,2000,147(2):367-379.
[12]侯军,林晓民,江芸,等.基于ITS序列分析对疑似白羊肚菌株的分子鉴定[J].食品科学,2009,30(5):141-145.

