转TCS基因泡桐对土壤微生物的影响1)
高尚坤
(山东农业大学,泰安,271018)
刘 静 黄艳艳 罗 磊 冯殿齐
(泰安市泰山林业科学研究院)
刘玉升 牛庆霖
(山东农业大学)
自 1983 年转基因植物[1-2]首次问世以来,转基因植物的开发与应用得到了突飞猛进的发展。但转基因作物的大面积种植极有可能对农林生态系统产生多方面的危害。因此,对其释放后的生态风险评价极为必要。目前,有关转基因农作物的生物安全研究较多,其中主要涉及对非目标昆虫、农田生态系统影响以及基因漂移等,如对转基因的棉花[3-9]、水稻[10]、烟草[11]、枸杞[12]等农作物和经济作物对土壤微生物生态风险评价有大量研究,但在转基因林木方面的报道很少[13]。林木转基因生物安全性主要包括转基因的稳定性、外源基因向天然群体的基因漂移及对非目标生物的影响等[14]。
土壤微生物的多样性是保持农业生态系统稳定的基础。微生物普遍存在于土壤中,对环境条件的变化反应敏捷,它能较早地预测土壤养分及环境质量的变化过程,被认为是最有潜力的敏感性生物指标之一。研究表明,转基因作物的外源基因和基因表达产物可通过根系分泌物或残茬进入土壤生态系统,进而对土壤微生物多样性造成影响。土壤中的微生物在农业生产系统中具有其他生物无法代替的作用,随着各种抗虫、抗病等转基因作物的不断选育种植,这种变化对土壤微生物存在潜在危险而可能造成对农业生产系统的影响[15-20]。
泡桐[Paulownia fortunei(seem.)Hemsi]为玄参科泡桐属植物,原产我国,现分布于世界各地。因材质优良,速生丰产,从而成为重要的用材树种和绿化树种,广泛用于建筑、乐器和工艺品的制作以及园林绿化[21]。但由于泡桐丛枝病严重影响了畸形、幼苗枯死、大树生长缓慢,给泡桐生产造成了很大的影响,严重打击了农民种植泡桐的积极性。经研究通过转抗丛枝病TCS基因进行该病的控制,并成功获得了转基因株系,经多年试验,该株系表现良好,为更快、更安全地进行示范推广,本文采用平板培养法分析了转基因泡桐对根际土壤微生物群落数量的影响,并系统的研究了细菌菌群,为转基因泡桐环境释放后对土壤生态系统的影响提供了依据。
1 试验地概况
转抗病TCS基因泡桐位于菏泽市定陶县孟海镇牛屯试验地,面积约667 m2,为黄河冲击平原,北纬32°41″,东经115°36″;年平均气温 10.1 ℃,月平均最高温度25.6℃,最低1月份-0.7℃;全年日照时数 2035.5 h,年降水量 250.4 mm;砂壤土,pH 值7.8。试验地周围是农田及行道树107黑杨。
2 材料与方法
供试材料来源于试验田中的转基因株系、非转基因株系和非根际土壤(对照组);每个组分别采集3个单株土样,各单株树龄相当,田间管理一致。
培养基为:牛肉膏蛋白胨琼脂培养基(简称NA培养基)、马铃薯琼脂培养基(简称PDA培养基)、高氏1号培养基。
土壤取样方法:采用3点取样法。从转基因泡桐和非转基因泡桐试验地根际周围采集土样;采集时除去地面植被和枯枝落叶,铲除表面1 cm左右的表土,用取样器取离地表10 cm左右的土样;剔除杂物,转入干净的保鲜袋中带回实验室进行测定。
土壤微生物种类测定:采用稀释平板法测定土壤微生物的数量与种类。具体操作方法:①对于采集的土样,用1/1000天平准确称取10 g后加入盛有90 mL无菌水的三角瓶中,在振荡器上振荡30 min,使土样均匀分散,得到质量浓度为10-1g/mL土壤悬浊液。②充分涡旋后立即吸取1 mL悬浊液加至盛有9 mL无菌水的试管中,得到质量浓度为10-2g/mL悬浊液。按照此方法,依次将土壤悬浊液稀释,细菌测试时将土壤悬浊液稀释至 10-5、10-6、10-7g/mL、真菌测试时将土壤悬浊液稀释至 10-2、10-3、10-4g/mL、放线菌测试时将土壤悬浊液稀释至10-4、10-5、10-6g/mL。③细菌的分离、培养采用牛肉膏蛋白胨琼脂培养基(简称NA培养基),真菌的分离、培养采用马铃薯琼脂培养基(简称PDA培养基),放线菌的分离、培养采用高氏1号培养基。④细菌的分离与纯化时取土壤悬浊液质量浓度为10-5、10-6、10-7三个稀释度,真菌的分离与纯化时取土壤悬浊液质量浓度为 10-2、10-3、10-4三个稀释度,放线菌的分离与纯化时取土壤悬浊液质量浓度为 10-4、10-5、10-6三个稀释度;并且各吸取 0.2 mL至预先制备好的平板培养基上,用涂布法进行分离,各稀释度重复3次,分别置于30℃的GXZ型智能光照培养箱和YQX型厌氧培养箱中培养72 h。对于细菌,挑取表征各异的菌落,在NA划线、纯化,将纯化后的菌落分别划NA培养基斜面培养,并依次编号;对于真菌和放线菌,根据菌株的培养性状,结合显微镜观察,对菌株依次编号。
土壤微生物的数量测定:对已编号的真菌和放线菌,进行培养性状观察,采用刮板接种法计数。每毫升土壤悬浮液中菌落数=(菌落平均数×稀释倍数×20)/干土的百分数,所用数据用 Microsoft Excel 2003进行处理,计算平均值和标准偏差。
无菌条件下,将土壤细菌悬浮液按不同比例稀释,取质量浓度为 10-5、10-6、10-7g/mL 三个稀释度的定量悬浮液,分别在NA培养基平板上涂抹,30℃培养72 h。选取菌落稀疏适当的平板计算细菌菌落数,并求取3个重复的平均值,计算出每克或毫克土壤悬浮液中的细菌数。每毫升悬浮液内细菌数≈(平板菌落数×土壤悬浊液质量浓度)/平板加液量。所用数据用Microsoft Excel 2003进行处理,计算平均值和标准偏差。
土壤真菌和放线菌的种群鉴定:通过对真菌菌落的大小、形态、色素、颜色和质地等形态进行观察,对3组土壤中真菌和放线菌种类进行初步鉴定。
土壤中细菌的种群鉴定:对纯化后已编号的各细菌菌株,进行革兰氏染色[22]、芽孢染色、鞭毛染色、生理生化测定等试验,并按《伯杰氏细菌鉴定手册》第八版进行鉴定[23-26]。
3 结果与分析
3.1 土壤中微生物数量
利用刮板接种法对不同土样的真菌、放线菌菌落数量进行计数,同时利用平板菌落计数法对细菌进行计数(见表1)。由表1可以看出:与非根际土壤对比,转基因泡桐根际的微生物类群没有发生变化,以细菌为主要微生物群,其次是真菌和放线菌。从不同土样微生物数量看出,以转基因细菌群落的数量最大,其次是真菌和放线菌。
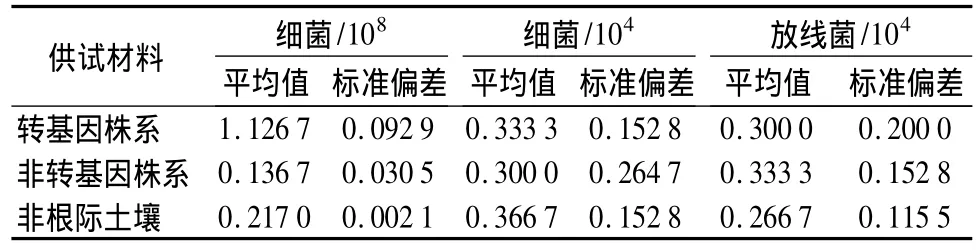
表1 土壤微生物群落计数 个·mL-1
3.2 土壤中真菌和放线菌的种群鉴定
通过对真菌菌落的大小、形态、色素、颜色和质地等形态进行观察发现,3组土壤中真菌种类相同,主要为毛霉属(Mucor)和根霉属(Rhizopus)。种群数量,毛霉属为 1.0×103个/mL、根霉属为 2.0×103个/mL;3组土壤中均发现一种放线菌,其种群数量为2.0×103个/mL。
3.3 土壤中细菌的种群鉴定
对土壤细菌进一步分离、纯化及培养观察,共有18个细菌菌株,其中从转基因株系组、非转基因株系组、对照组中均获得6个细菌菌株;经培养性状比较,相同菌株保留一株,经整理统一编号后,分别编号为1~6号、1~3号和1~2号。
3.3.1 供试菌株菌体形态和培养性状
将供试菌株在NA培养基上培养24 h,按照革兰氏染色法和3%KOH简易法,调查革兰氏阴性反应情况。经油镜和林钨酸钠复染法电镜观察菌体形态、鞭毛有无及部位、芽胞有无等性状,将分离纯化的供试菌株在NA和NB培养基上,28℃培养48 h后观察培养性状(见表2)。从表2中可看出:转基因株系组6个菌株菌体形态除3号为短杆型,其余均为长杆型,革兰氏染色均为阳性;除5号周生鞭毛外,其余均无周鞭毛生长;3号菌无芽胞生长,其余均有芽胞生长。非转基因株系组中的1号为短杆型;2号、3号菌株为周生鞭毛。非根际土壤中,1号为短杆型,2号为长杆型,均无周生鞭毛。由此得出:3个样品菌种发生了变化。
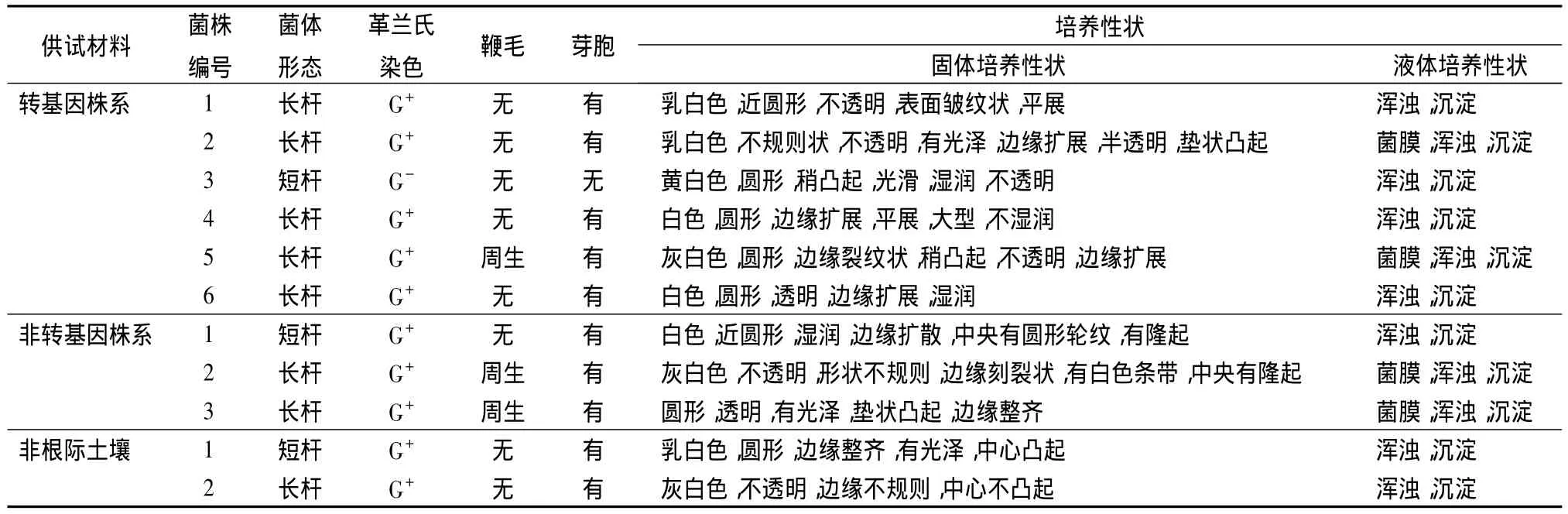
表2 土壤细菌的形态特征及培养性状
3.3.2 供试细菌菌株生理性状
将供试细菌菌株在不同温度、不同pH值和不同NaCl质量分数条件下,接种培养不同时间,观察生理性状(见表3)。从表3中可知:供试菌株在不同温度、不同pH值和不同NaCl质量分数下培养,转基因株系组中的1号和3号、非转基因株系组中的3号和对照组的2号,可在15℃下生长;所有菌株在30~37℃条件下、在pH值5~9条件下、在NaCl质量分数2% ~7%条件下,均生长良好。
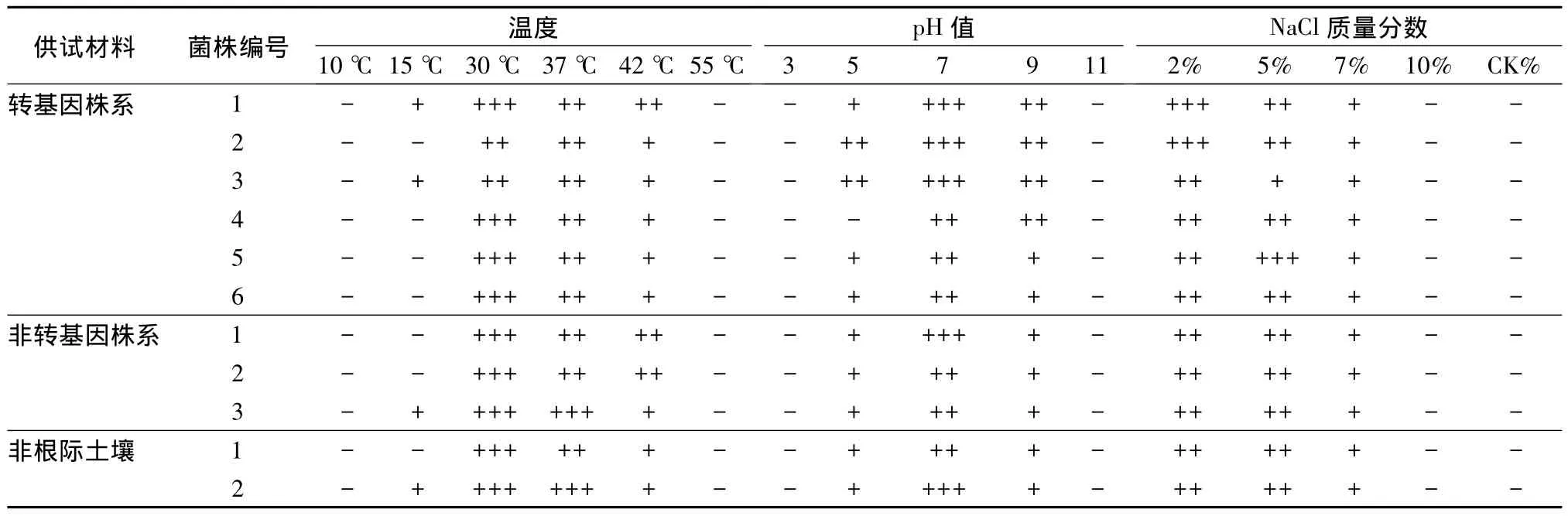
表3 土壤细菌的生理性状
3.3.3 供试菌株生化性状
对供试11个菌株生化性状测定:氧化酶等4种,6种氮素化合物和糖醇以及其他碳素化合物19种(见表4)。从表4可知:供试11个菌株,除赖氨酸脱羧酶非转基因株系组中的2号菌株阴性,其他菌株均为阳性;过氧化氢酶、吲哚和鸟氨酸脱羧酶为阳性;除转基因株系组中的1号菌株不能使明胶液化,其他菌株均可以;除转基因株系组中的1号菌株能利用麦芽糖和棉籽糖外,其他糖醇均不能利用;发现各组各菌株其他生化测定项目各异。

表4 土壤细菌生化测定结果
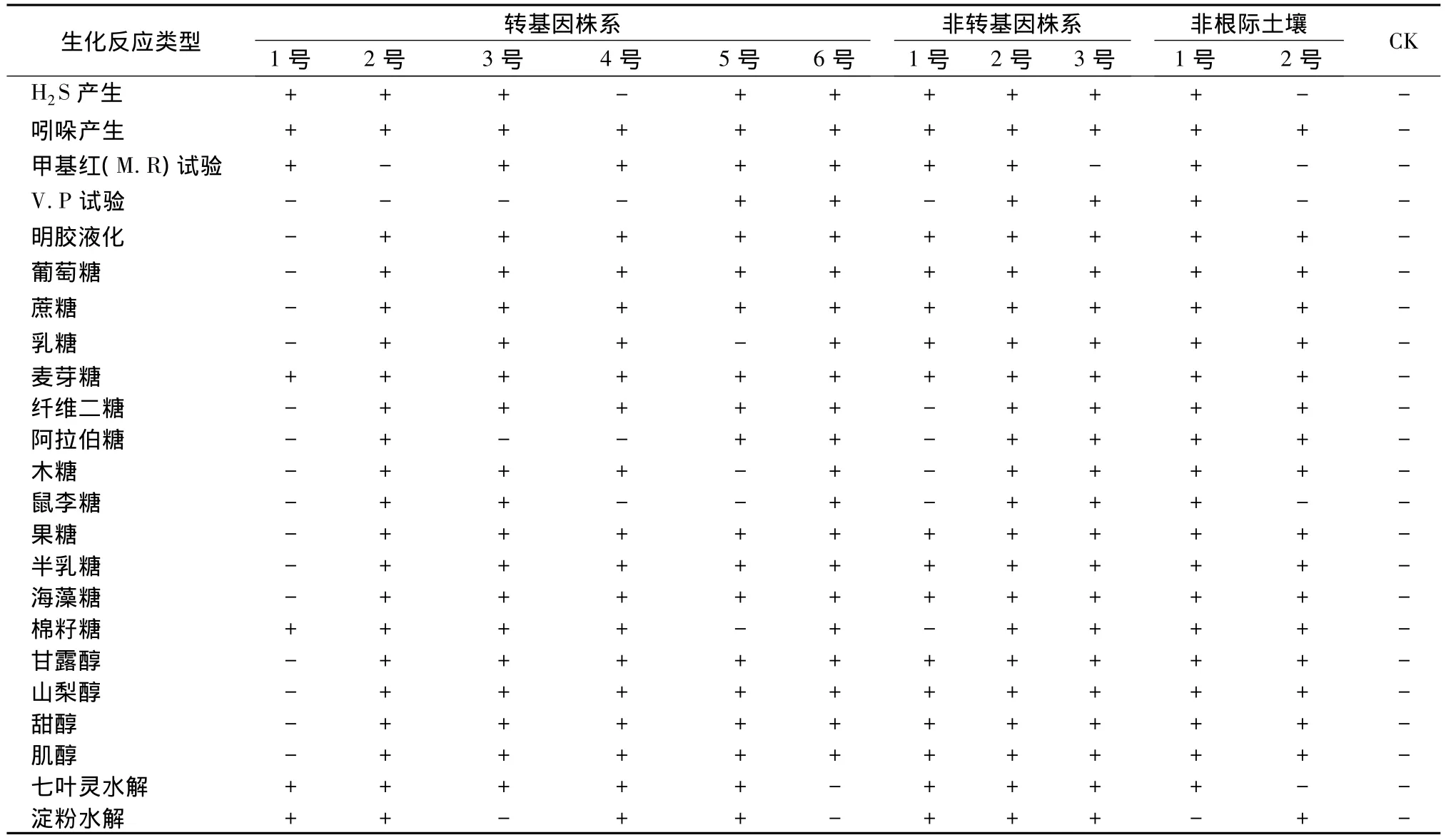
表4 (续)
3.3.4 细菌菌株鉴定及其存在数量状况
经对应和检查菌体形态、染色反应、培养性状、生理生化反应等各项指标,综合鉴定结果见表5。由表5可见,①转基因株系组的6个菌株及数量,分别为:嗜热脂肪芽孢杆菌(B.stearothermophilus)60×106个/mL、环状芽孢杆菌(B.circulans)30×106个/mL、柠檬酸杆菌属(Citrobacter sp.)15×106个/mL、坚强芽孢杆菌(B.firmus)3×106个/mL、蜡状芽孢杆菌(B.cereus)1×106个/mL、短小芽孢杆菌(B.pumilus)均为1×106个/mL。②非转基因株系组的6个菌株及数量,分别为:短小芽孢杆菌(B.pumilus)1×106个/mL、蜜蜂芽孢杆(B.bee)3×106个/mL、嗜热脂肪芽孢杆菌(B.stearothermophilus)1×106个/mL、球形芽孢杆菌(B.sphaericus)2×106个/mL、坚强芽孢杆菌(B.firmus)1×106个/mL、蜂房芽孢杆菌(B.hive)3×106个/mL。③对照组(非根际土壤)的6个菌株及数量,分别为:嗜热脂肪芽孢杆菌(B.stearothermophilus)5×105个/mL、球形芽孢杆菌(B.sphaericus)1×105个/mL、环状芽孢杆菌(B.circulans)4×105个/mL、蜂房芽孢杆菌(B.hive)2×105个/mL、短小芽孢杆菌(B.pumilus)为 1×105个/mL、浸麻芽孢杆菌(B.macerans)7×105个/mL。综合以上结果可见:转基因泡桐根际土壤与对照相比细菌种类及数量明显增多,真菌和放线菌种类和数量没有发生很大变化;真菌菌群中以毛霉属和根霉属为主,细菌菌群中以芽孢杆菌属为主,但对土壤微生物的多样性无影响。
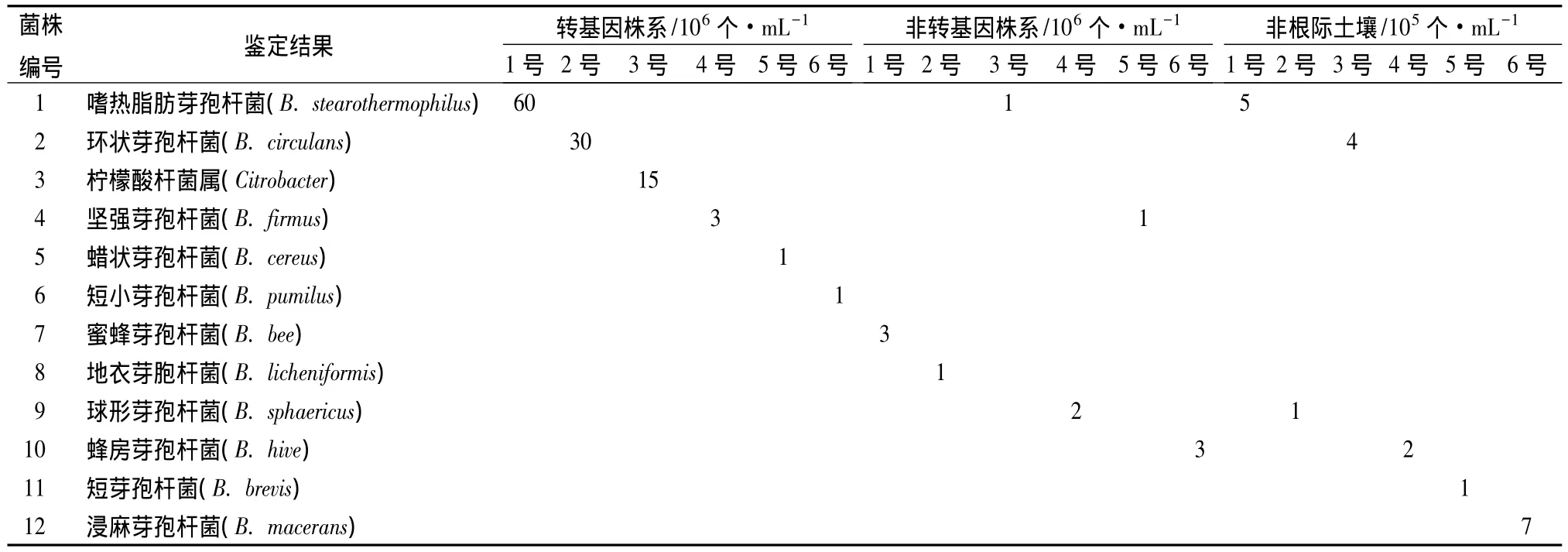
表5 土壤细菌鉴定结果、分布情况及数量
4 结论与讨论
在细菌种类上:除在转基因株系根际土壤中存在柠檬酸杆菌属外,其余菌株均属于芽孢杆菌属。其中嗜热脂肪芽孢杆菌在转基因株系、非转基因株系和非根际土壤中均分离得到;球形芽孢杆菌和蜂房芽孢杆菌,只在非转基因株系和非根际土壤中分离得到;环状芽孢杆菌,只在转基因株系和非根际土壤中分离得到;坚强芽孢杆菌,在非根际土壤中没有分离得到,在其他两个株系根际周围分离得到;球形芽孢杆菌和蜂房芽孢杆菌,在非转基因株系和非根际土壤中均分离得到,在转基因株系中均未分离到。
在细菌数量上:转基因株系根际土壤中的细菌数量为1.10×108个/mL,非转基因株系根际土壤中的细菌数量为1.1×107个/mL,非根际土壤中的细菌数量为2.0×106个/mL,表明转基因后细菌数量明显增加。
结果表明:转基因泡桐根围的土壤微生物数量都有变化,其中细菌菌群数量变化最大,但转基因泡桐根围土壤微生物的总体构成变化不大,仍以细菌数量最多,真菌和放线菌次之;在细菌菌群中,以芽孢杆菌属的细菌为主。说明转基因泡桐对土壤微生物的数量有一定影响,但对土壤微生物的多样性无影响。
本研究是通过稀释平板法进行土壤微生物的分离测定,现今把分子生物学技术运用于土壤微生物生态学,可以避开传统的分离培养过程,通过DNA水平上的研究,直接探讨土壤微生物的种群结构及其与环境的关系。而且可结合16S rDNA序列分析研究原核微生物群落多样性技术,更为精确地揭示土壤中微生物种群结构及其动态变化[27-29]。
另外,本文只对秋季落叶后转基因株系、非转基因株系根际土壤和非根际土壤微生物群落进行了研究,对于不同的季节的土壤微生物群落变化及相同季节的土壤微生物群落稳定性差异,有待进一步研究。
转抗病TCS基因泡桐可以有效减轻泡桐丛枝病的发生,降低泡桐经济和生态效益损失,有利于林业可持续生态系统的建立,对于其他林果木丛枝病(如枣疯病)的防治具有重大指导意义。因此,对于转抗病TCS基因泡桐的安全释放问题需进一步跟进和完善。
[1]Lal R,Lal S.Genetic Engineering of Plants for Crop Improvement[C]//Boca Raton F L:CRCPress Zambryske P EMBO,1983:21-43.
[2]王建武,冯远娇,骆世明.转基因作物对土壤生态系统的影响[J].应用生态学报,2002,13(4):491-494.
[3]李长林,张欣,吴建波,等.转基因棉花对根际土壤微生物多样性的影响[J].农业环境科学学报,2008,27(5):1857-1859.
[4]王振宇,蒋媛媛,马奇祥,等.转抗病基因棉花荒地生存竞争能力研究[J].河南农业科学,2010(10):51-52,120.
[5]叶飞,宋存江,陶剑,等.转基因棉花种植对根际土壤微生物群落功能多样性的影响[J].应用生态学报,2010,21(2):386-390.
[6]张美俊,杨武德.转Bt基因棉叶对土壤微生物多样性的影响[J].中国生态农业学报,2010,18(2):307-311.
[7]张金国,刘翔,崔金杰,等.转基因(Cry1Ac)抗虫棉对土壤微生物的影响[J].中国生物工程杂志,2006,26(5):78-80.
[8]张兴华,田绍仁,乔艳艳,等.转基因抗病棉花所转抗病基因(Chi+Glu)对棉花生物学特性的影响[J].中国农学通报,2011,27(3):116-123.
[9]崔金杰,雒瑜,李树红,等.转基因抗虫棉对土壤微生物影响的初步研究[J].河北农业大学学报,2005,28(6):73-75.
[10]李本金,李仁,胡奇勇,等,抗真菌转基因水稻对根际土壤微生物群落的影响[J].福建农林大学学报:自然科学版,2006,35(3):319-323.
[11]刘丽,鲁国东,唐乐尘,等.转抗菌肽D烟草对土壤微生物群落的影响[J].生态学报,2010,30(2):364-370.
[12]曲玲,甘晓燕,罗青,等.抗蚜虫转基因枸杞对土壤微生物影响的初步研究[J].安徽农业科学,2008,36(30):13283-13286.
[13]杨华,李惠敏,覃屏生,等.罗汉果转抗病基因NPR1的研究[J].广西植物,2011,31(2):250-254.
[14]胡建军,张蕴哲,卢孟柱,等.欧洲黑杨转基因稳定性及对土壤微生物的影响[J].林业科学,2004,40(5):105-109.
[15]唐影,李世东,缪作清.转基因作物对土壤微生物的影响[J].中国生物防治,2007,23(4):383-390.
[16]王振,赵廷昌,刘学敏,等.转基因作物对土壤微生物多样性影响[J].植物保护,2007,33(4):15-20.
[17]郑宇,李仁,胡奇勇,等.转基因作物和工程菌对土壤微生物群落影响的浅析[J].江西农业大学学报,2003,25(增刊1):67-70.
[18]周艳红,丁衬衬,史建荣.转基因作物对土壤微生物多样性影响研究技术的进展[J].江苏农业科学,2010(4):362-365.
[19]周晓罡,张绍松,李成云,等.转基因植物种植地土壤微生物区系生态变化及其外源基因的分子检测[J].西南农业学报,2005,18(6):734-738.
[20]李鑫鑫,李晓晖,李亮,等.转基因作物对于土壤微生物的影响[J].中国农业科技导报,2010,12(6):24-27.
[21]李栋海.泡桐丛枝病的鉴别与防治[J].安徽农业科学,2010,38(15):7904-7905.
[22]郑继法.区别格兰氏阴性和阳性菌的简易快速试验[J].山东农业大学学报,1984,15(1/2):1-2.
[23]戈登R E,海恩斯W C,帕格C H N.芽胞杆菌属[M].北京:农业出版社,1983:21-25.
[24]东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001:43-267.
[25]布坝南R E,吉本斯N E.伯杰氏细菌学鉴定手册[M].中国科学院微生物研究所,译.北京:科学出版社,1984:855-865.
[26]中国科学院微生物研究所细菌分类组.一般细菌常用鉴定方法[M].北京:科学出版社,1978:31-96.
[27]金海林,金东淳,李颖,等.土壤微生物3种DNA提取方法的比较[J].延边大学农学学报,2010,32(1):59-61.
[28]Lukow T,Dunfield P F,LiesackW.Use of the T-RFLP technique to assess spatialand temporal changes in the bacterial community structure within an agricultural soil planted with transgenic and non-transgenic potato plants[J].Federation of European,2000,21:126-131.
[29]Kirka J L,Beaudettea L A,Hartb M,et al.Methods of studying soil microbial diversity[J].J Microbiol Meth,2004,58:169 -188.

