鲍鱼腹足胶原蛋白的提取及性质研究
袁 起 新,朱 蓓 薇,董 秀 萍,周 大 勇,张 爽,刘 芳
(大连工业大学 食品学院,辽宁 大连 116034)
0 引言
鲍隶属软体动物门(Mollusca)腹足纲(Gastropoda),全世界各海区已命名的鲍鱼有216种,常见种类约30 种,在中国沿海分布主要有7种[1],其可食部分鲍鱼腹足中胶原蛋白含量较丰富且含量多少直接影响其嫩度[2]。胶原蛋白类型很多,Soderhall等[3]于2007 年报道了与人表皮特异性皮炎有关的XXIX 型胶原,至此,胶原蛋白家族已有29种。
目前,国内外在胶原蛋白研究方面以鱼类为主,无脊椎动物海参[4]、鱿鱼[5]、海胆[6]的研究也较为深入。有关鲍鱼胶原蛋白研究相对较少,KIMURA 等[7-8]对鲍鱼腹足酶促溶性胶原蛋白进行了提取纯化,并对其氨基酸组成以及一些物理性质进行了研究,通过电泳技术分析其胶原结构类型为[α]3。Olaechea等[2]报道鲍鱼腹足不同部位的胶原蛋白含量不同,且胶原蛋白的含量与其韧性成正比例关系。
本实验以皱纹盘鲍为原料,用胃蛋白酶提取其腹足酶促溶性胶原蛋白,通过圆二色谱鉴定所提取胶原的结构完整性,进一步考察其理化性质及功能特性,为鲍鱼精深加工提供理论依据,满足人们对高品质鲍鱼的消费需求。
1 材料与方法
1.1 材料和试剂
鲜活皱纹盘鲍(Haliotisdiscus),购于市场;氯化钠、氯化钾、氢氧化钠、乙酸等,国产分析纯;胃蛋白酶,分析纯,Sigma公司。
1.2 仪 器
UV2100型紫外可见分光光度计,上海尤尼柯仪器有限公司;pH 计,上海鹏顺科学仪器有限公司;T25数显匀浆机,德国IKA;Z-323K 冷冻离心机,德国Hermle;J810 圆二色谱仪,日本分光公司。
1.3 方 法
1.3.1 基本组成成分分析
水分测定采用常压干燥法(GB 5009.3—2010);粗蛋白测定采用凯氏定氮法(GB 5009.5—2010);总糖测定(GB/T 15038—2006);粗脂肪测定采用索氏抽提法(GB/T 14772—2008);灰分测定采用高温灼烧法(GB 5009.4—2010)。
1.3.2 鲍鱼腹足酶促溶性胶原蛋白的提取
参考文献[9]的方法并略加改进,新鲜鲍鱼去内脏,清洗并去除与壳肌连接的中间部分,匀浆后用10倍的冷去离子水洗,离心后弃上清。鲍鱼匀浆组织加入10倍体积的0.6mol/L KCl溶液搅拌24h,5 000g离心15min,重复洗3次;所得沉淀加10倍体积0.45mol/L NaCl溶液搅拌24h,5 000g离心15min,重复洗3次;所得沉淀加10倍体积0.1mol/L NaOH 溶液搅拌过夜,去离子水洗至中性,沉淀即为粗胶原纤维。再加10倍体积0.5mol/L乙酸搅拌48h,除去酸溶性胶原蛋白,10 000g离心30min;所得沉淀在0.5mol/L乙酸中用胃蛋白酶酶解72h,酶与底物质量比为3∶20;12 000g离心,上清液加入4 mol/L NaCl使其终浓度为0.8mol/L,冷冻离心,弃上清。沉淀复溶于0.5 mol/L 乙酸,所得溶液先用0.02mol/L Na2HPO4透析,再用0.1 mol/L 乙酸透析,冻干即得鲍鱼腹足酶促溶性胶原蛋白。以上所有操作除特殊注明外,均在4 ℃下进行。
1.3.3 鲍鱼腹足酶促溶性胶原蛋白提取率的计算

式中,m1为冻干胶原质量,g;m2为未经前处理的鲍鱼腹足原料干重,g。
1.3.4 鲍鱼腹足酶促溶性胶原蛋白的圆二色谱鉴定
准确称量一定量的冻干鲍鱼腹足酶促溶性胶原蛋白,用0.02 mol/L 乙酸配成质量浓度为0.2mg/mL的蛋白溶液。将其注入1mm 光径的石英池,采用JASCO J-810圆二色谱仪对样品在190~260nm 进行扫描,扫描速率为100nm/min,次数为3次。
1.3.5 鲍鱼腹足酶促溶性胶原蛋白的等电点测定
取0.01g 鲍鱼腹足酶促溶性胶原蛋白冻干品溶解在3mL 0.5mol/L 乙酸中;待澄清后,用1mol/L NaOH 溶液滴定直到出现浑浊沉淀,且沉淀不再溶解。用pH 计测定悬浊液的pH,平行测3组,取平均值即为该样品的等电点。
1.3.6 鲍鱼腹足酶促溶性胶原蛋白的起泡性和起泡稳定性
取0.03g鲍鱼腹足酶促溶性胶原蛋白溶解到100mL 0.5 mol/L乙酸溶液中(pH 3.0~3.5),然后用匀浆机以12 000r/min速度均质2min,记录均质停止时泡沫体积,起泡性计算如下:
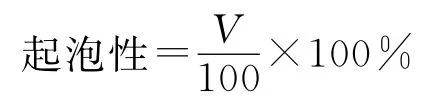
式中,V为均质停止时起泡体积,mL。
记录均质停止1、10、30、60、120 min后泡沫的体积,以此来衡量泡沫稳定性。
1.3.7 鲍鱼腹足酶促溶性胶原蛋白的乳化性和乳化稳定性
称取0.03g鲍鱼腹足酶促溶性胶原蛋白样品,将其溶解到50mL的0.5mol/L 的乙酸溶液中,加入50 mL 精炼油,该样液的pH 为3.0~3.5,用匀浆机以12 000r/min的速度均质2min,取20mL均匀样液,装在20mL的刻度试管中置于恒温水浴锅中,50 ℃水浴,在5h内每隔1h测一次乳状液的体积。乳化性及乳化稳定性计算如下:
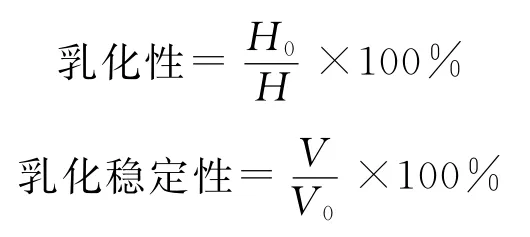
式中,H0为乳化层高度,cm;H为总高度,cm;V为最终乳状液的体积,mL;V0为最初乳状液的体积,mL。
1.3.8 鲍鱼腹足酶促溶性胶原蛋白的Fe2+螯合活性
参照Hsu等[10]方法,1mL 不同浓度鲍鱼腹足酶促溶性胶原蛋白溶液,与50μL 氯化亚铁(2mmol/L)和1mL 去离子水混合均匀后室温静置5min,再加入100μL 菲咯嗪(5mmol/L),均匀后室温静置5min,反应结束后,在2 000g条件下离心10 min,取上清液测其在562nm 下吸收值。亚铁离子螯合能力计算如下:
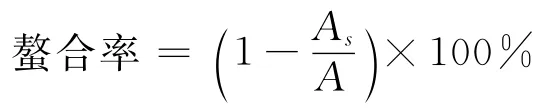
式中,As为样品测定值;A为用等体积去离子水取代样品后的测定值。
2 结果与讨论
2.1 鲍鱼腹足主要组成成分
经测定鲍鱼腹足原料含水分的质量分数为71.38%,粗蛋白为15.14%,总糖、粗脂肪、灰分质量分数见表1。鲍鱼腹足各个部分胶原蛋白质量分数差异较大[2],而且季节不同胶原质量分数也不同[11]。本实验以4月份鲍鱼为原料,根据方法“1.3.1”对其组分进行测定,结果如表1所示。

表1 鲍鱼腹足基本组成成分Tab.1 The main chemical composition of the foot of Haliotis discus
2.2 鲍鱼腹足酶促溶性胶原蛋白提取率
如图1所示,将鲍鱼腹足分为与闭壳肌相连的中间部分A 及过渡和边缘部分B,通过羟脯氨酸法对各部位胶原质量分数进行测定。结果显示,鲍鱼腹足B 部胶原质量分数最高,占干基的34.37%;而A 部分胶原的质量分数略低,仅为20%左右。Olaechea等[2]也报道了鲍鱼腹足不同部分胶原蛋白含量有所不同,只是部位的划分与本文有所不同。因此,本实验选取鲍鱼腹足边缘部分B,对其胶原蛋白进行提取及相关性质研究。
鲍鱼腹足酶促溶性胶原蛋白提取率为8.72%(以干基计),低于草鱼皮(46.6%)[12]、鱿鱼(16.4%)[13],本实验中采用胃蛋白酶促溶提取的胶原蛋白得率略低,主要是因为鲍鱼腹足胶原蛋白含量较鱼皮等低,且其PSC 分子间交联程度大。
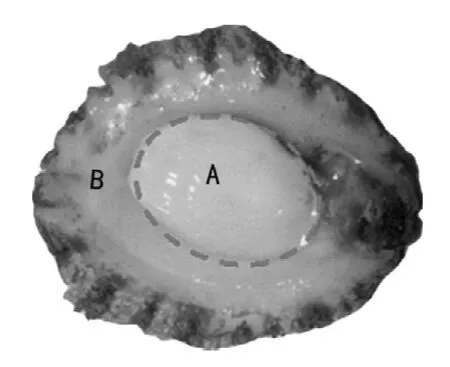
图1 鲍鱼腹足取样部位图Fig.1 Illustration of sampling locations
2.3 鲍鱼腹足酶促溶性胶原蛋白的圆二色谱鉴定
鲍鱼腹足酶促溶性胶原蛋白在远紫外区(190~260nm)的圆二色谱见图2。由图2可知,在221nm 处有一个正峰,在199nm 处存在一负槽,具有典型胶原蛋白三股螺旋结构的特征圆二色谱峰型[14],与其他来源胶原蛋白圆二色谱峰型相类似[15-16]。手性物质对右圆偏振光和左圆偏振光的吸收(振幅减小)不同,使左、右圆偏振光叠合成椭圆偏振光,称为圆二色性[17]。在蛋白质或多肽中主要的光活性基团是肽链骨架中的肽键、芳香氨基酸残基及二硫键。远紫外区圆二光谱在肽键吸收峰范围内,反映了主链构象。胶原蛋白由3条左手螺旋α肽链相互缠绕成右手螺旋结构,当螺旋结构破坏时,221nm 附近的正峰会随之消失。

图2 鲍鱼腹足酶促溶胶原蛋白圆二色谱图Fig.2 CD spectra of PSC solution from the foot of Haliotis discus
2.4 鲍鱼腹足酶促溶性胶原蛋白等电点的测定
用乙酸溶解的鲍鱼腹足酶促溶性胶原蛋白等电点为pH 5.17。蛋白质是一种两性电解质,在不同pH 下有不同的溶解度。在等电点时,蛋白质分子的酸性解离与碱性解离相等,即所带正负电荷相等,净电荷为零,因此其物理化学性质都发生较大变化,如溶解度、黏度、电导率等都达到最低值。
2.5 鲍鱼腹足酶促溶性胶原蛋白的起泡性和起泡稳定性
蛋白质的起泡性是指蛋白质在水中搅打起泡的能力,泡沫稳定性是指泡沫保持稳定的能力。起泡性和泡沫稳定性与蛋白质的浓度存在着一定关系,温度也对其有影响。在形成泡沫前,适当的热处理能改进蛋白质产品的起泡性,但是泡沫稳定性降低。蛋白质分子组成中疏水氨基酸含量越多,乳化能力就越强,越容易吸附在液滴表面形成泡沫。鲍鱼腹足酶促溶性胶原蛋白起泡性与起泡稳定性结果见表2。由表2可知鲍鱼腹足酶促溶性胶原蛋白质量浓度为0.3mg/mL时,其起泡性高达110%,略低于罗非鱼皮起泡性(128%)[17],泡沫稳定性一般。

表2 鲍鱼腹足酶促溶性胶原蛋白的起泡性与泡沫稳定性Tab.2 Foam-producing and foam stability of PSC from the foot of Haliotis discus
2.6 鲍鱼腹足酶促溶性胶原蛋白的乳化性和乳化稳定性
一般的乳化系统是由乳化剂(表面活性剂)将互不相溶的水相与油相经高速搅拌乳化而成的。蛋白质也是一种表面活性剂,具有乳化作用,因此蛋白质能使油水结合在一起并形成乳状液。胶原蛋白脯氨酸和羟脯氨酸等疏水性氨基酸含量较高,所以其乳化性较强。乳化稳定性是指油水乳状液保持稳定的能力,胶原蛋白所含的疏水性氨基酸以亚氨基酸为主,芳香族氨基酸含量较少,可能致使其乳化稳定性较差。鲍鱼腹足酶促溶性胶原蛋白在pH 3.0~3.5、室温条件下乳化性和乳化稳定性见表3。由表3 可知,质量浓度为0.3mg/mL鲍鱼腹足酶促溶性胶原蛋白有良好的乳化性,乳化能力达到100%;但乳化稳定性一般,放置5h后,仅保持在50%左右。

表3 鲍鱼腹足酶促溶性胶原蛋白的乳化性和乳化稳定性Tab.3 Emulsifiability and emulsion stability of PSC from the foot of Haliotis discus
2.7 鲍鱼腹足酶促溶性胶原蛋白Fe2+螯合能力
胶原是一种天然高分子配体,其分子结构中的氨基、羧基、羟基、胍基等侧基在不同条件下可与一些金属离子发生配位反应,生成金属胶原配位化合物。游离的二价铁离子对氧非常敏感,可以与其反应生成三价铁离子和过氧化氢。游离二价铁离子还会与过氧化氢反应生成羟自由基,而羟自由基是对机体伤害最大的活性氧基团之一。因此,Fe2+螯合能力可反映物质的抗氧化能力。
鲍鱼腹足酶促溶性胶原蛋白Fe2+螯合能力结果见图3。由图3可见,鲍鱼腹足酶促溶性胶原蛋白具有较强的Fe2+螯合能力,在0.2~1.2mg/mL内,螯合能力随质量浓度的上升而增加,其IC50值(螯合率为50%时样品的质量浓度)为0.348mg/mL,当质量浓度为1.2 mg/mL 时螯合能力可达91.62%。可见,鲍鱼腹足酶促溶性胶原蛋白可有效抑制不饱和脂肪酸氧化以及自由基氧化反应的发生。

图3 不同浓度鲍鱼腹足酶促溶性胶原蛋白对Fe2+螯合能力的影响Fig.3 Effect of different PSC concentrations on iron(Fe2+)-chelating activity
3 结论
(1)用胃蛋白酶提取的鲍鱼腹足酶促溶性胶原蛋白提取率为8.72%(以干基计),三螺旋结构完整。
(2)鲍鱼腹足酶促溶性胶原蛋白的等电点为pH 5.17,具有较好起泡性和乳化性,但稳定性均相对较差。
(3)鲍鱼腹足酶促溶性胶原蛋白具有较强Fe2+螯合能力,其IC50值为0.348mg/mL。

