腹主动脉-肠系膜上动脉夹角的MR血管成像测量及其与体重指数的关系
姜洪标 JIANG Hongbiao
崔 磊1 CUI Lei
崔海燕1 CUI Haiyan
陈海涛1 CHEN Haitao
李小龙1 LI Xiaolong
肖 静2 XIAO Jing
2.南通大学公共卫生学院统计教研室 江苏南通 226019
肠系膜上动脉综合征(SMAS)是由于十二指肠水平部被压迫于主动脉和肠系膜上动脉(SMA)之间所致,可能是解剖因素或后腹膜脂肪减少所致的机械因素[1]。后者导致腹主动脉与SMA夹角(AMA)变小[1],常与引起体重显著下降的各种消耗性疾病有关[2]。体重指数(BMI)可评估体重过轻、过重并反映腹部脂肪含量[3],国内BMI与AMA的关系鲜有文献报道。目前AMA测量主要通过CT和B超实现。CT血管成像直观、准确,但有辐射;B超方便,但不够直观,且受操作者主观因素影响较大。MR血管成像(MRA)对腹部动脉的显示直观,且无辐射。本研究拟通过MRA测量AMA,并探讨其与BMI的相关性。
1 资料与方法
1.1 研究对象 2009-07~2011-04在江苏省南通市第一人民医院行腹部MRI检查的605例患者,均无SMAS的临床症状,并排除3个月内有腹部手术史患者。605例患者中,男372例,年龄19~83岁,平均(53.78±19.23)岁;女233例,年龄17~83岁,平均(49.25±21.92)岁。计算每一例患者的BMI,根据WHO标准并按照性别各分成4个级别。Ⅰ级:BMI<18.5kg/m2;Ⅱ级:BMI 18.5~24.9kg/m2;Ⅲ级:BMI 25~ 29.9kg/m2;Ⅳ级:BMI≥ 30kg/m2。
1.2 仪器与方法 使用Siemens Magnetom Symphony 1.5T超导MR成像仪。体部相控阵表面线圈,先行腹部冠状面、横断面及矢状面的真性稳态进动二维采集True FISP序列扫描(TR 4.45ms,TE 2.23ms,扫描时间18s),获得腹部大血管及脏器的大体影像。MRA采用三维对比增强MRA(3D-CE-MRA),对比剂为钆喷替酸葡甲胺(Gd-DTPA),高压注射器经肘静脉注射,用量0.2mmol/kg,并用15ml生理盐水冲洗,注射流速2~3ml/s。注射后15s开始扫描。扫描范围从膈肌至肾门水平。扫描序列为三维高分辨超快速小角度激发梯度回波序列(3D FLASH),参数:TR 3.65ms,TE 1.28ms,翻转角(FA)25°,视野(FOV)30~40cm,矩阵256×256,1个3D块,共72层,层厚1.5mm,无间隔,一次屏气采集时间18~20s。增强前后各采集1次,将增强前图像作为蒙片减影后进行最大密度投影(MIP)重组。
1.3 AMA测量 在MIP矢状面图像上测量SMA和主动脉的夹角:在SMA与主动脉分叉水平,分别沿主动脉前壁和SMA下壁作切线,两者之间的夹角即为AMA(图1)。在PACS图像浏览系统上手工描绘切线,自动计算角度。由1位技术员和1位医师分别采用盲法测量2次(每次间隔1周),取平均值。
1.4 统计学方法 采用SPSS 13.0软件,计量资料数据以±s 表示,患者AMA与BMI之间的相关性行Pearson相关分析,对男女组AMA和BMI分级的相关性行Spearman相关分析,P<0.05表示差异有统计学意义。
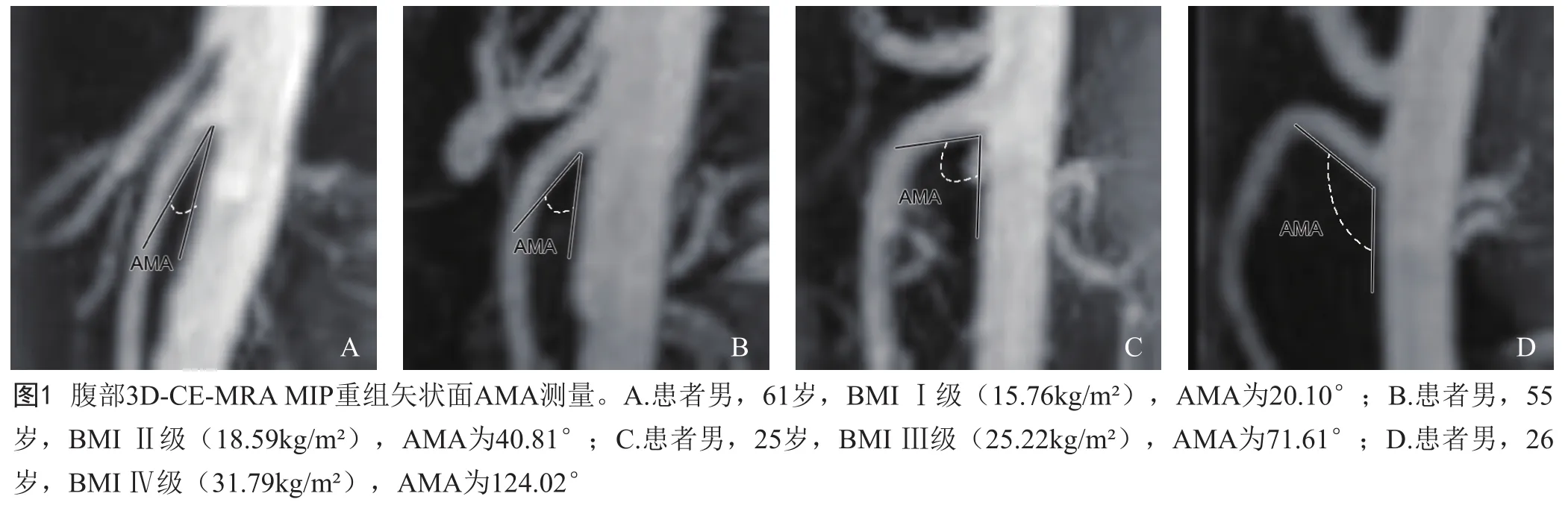
2 结果
男性患者AMA与BMI呈显著正相关(r=0.51,P<0.01),AMA与BMI级别呈中等相关(r=0.40,P<0.01);女性患者AMA与BMI呈显著正相关(r=0.54, P<0.01),AMA与 BMI级别呈中等相关(r=0.43, P<0.01)。随着BMI增加,AMA也增大(图1)。不同性别患者各BMI级别AMA见表1。
表1 不同性别患者各BMI级别AMA正常值范围(±s,95% CI)
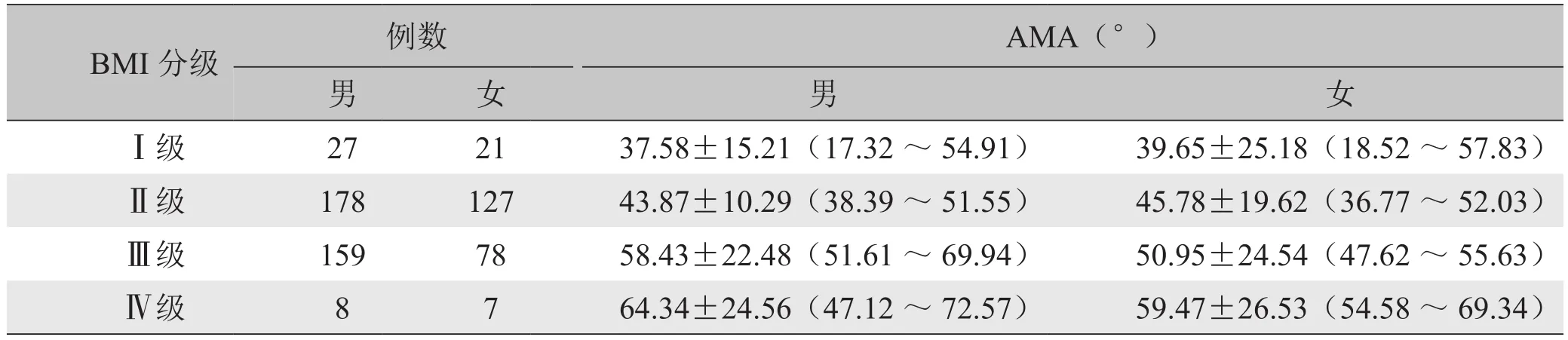
表1 不同性别患者各BMI级别AMA正常值范围(±s,95% CI)
BMI分级 例数 AMA(°)男 女 男 女Ⅰ级 27 21 37.58±15.21(17.32~54.91) 39.65±25.18(18.52~57.83)Ⅱ级 178 127 43.87±10.29(38.39~51.55) 45.78±19.62(36.77~52.03)Ⅲ级 159 78 58.43±22.48(51.61~69.94) 50.95±24.54(47.62~55.63)Ⅳ级 8 7 64.34±24.56(47.12~72.57) 59.47±26.53(54.58~69.34)
3 讨论
3.1 SMAS的发病机制及其与AMA的关系 正常情况下,SMA起始部为后腹膜和肠系膜脂肪、淋巴组织所包绕,这对于保持主动脉与SMA之间的夹角和距离非常重要。后腹膜脂肪的量可影响SMA与主动脉的夹角和距离[1,2],后腹膜脂肪垫的丢失将会导致AMA减小[1]。Unal等[4]发现SMAS患者的AMA较正常人显著减小,且AMA减小与SMAS的临床症状高度相关。Zadegan等[5]报道了1例与脊柱畸形相关的SMAS患者,提出年轻偏瘦人群易患此病,BMI可能是预测SMAS危险度的一个较好指标。
一些测量内脏脂肪堆积的指标如手腕-大腿周长比和腹部矢径简便易行,但并不准确[4]。BMI用于脂肪量的替代指标,不仅可以直接评估体重过重或过轻,而且可以评估成人腹部脂肪量[3]。Ozkurt等[6]通过对524名正常人腹部CTA的研究发现,男性和女性AMA与BMI均呈正相关(r=0.26、0.29, P<0.01);Ozbulbul等[7]通过对130名正常人腹部CTA的研究发现,女性AMA与BMI呈正相关(r=0.36, P<0.01),而男性AMA与BMI无显著相关。本研究结果显示,男性和女性AMA与BMI均呈正相关(r=0.51、0.54,P<0.01)。本研究中BMI Ⅰ~Ⅳ级患者分别占7.93%(48/605)、50.41%(305/605)、39.17%(237/605)和 2.48%(15/605),而Ozkurt等[6]的研究人群BMI Ⅰ~Ⅳ级分别占 2.29%(12/524)、36.64%(192/524)、41.98%(220/524)和19.08%(100/524),可能与国人及欧美人种的差异有关。
3.2 AMA测量和SMAS诊断 影像学SMAS罕见而难以诊断,常常在临床疑诊的基础上结合梗阻的影像学证据而确诊。但是临床症状和梗阻的影像学表现并非持续存在,在疾病发作间歇期容易漏诊。因此,AMA测量值作为诊断依据尤为重要。目前用于SMAS诊断的影像学手段有上消化道钡餐造影、CTA、MRA、超声、常规血管造影。
上消化道钡餐造影对于SMAS的诊断有重要作用,其表现包括十二指肠球部、降部扩张而水平部截然纵行狭窄,逆蠕动波,胃十二指肠排空延迟,体位改变则梗阻解除,然而这些表现并无特异性[8]。传统上,肠系膜动脉造影结合十二指肠低张造影,是最有效的诊断技术[4]。十二指肠低张造影使上述表现更易出现,但特异性更低[9]。随着多层螺旋CT的普及,有创性的肠系膜动脉造影很少用于单纯性诊断。
增强CT可以评估整个腹腔,包括胃肠道、SMA与主动脉夹角和距离以及后腹膜、肠系膜脂肪。近年来,多层螺旋CT血管成像结合多平面重组和CT血管成像,成为诊断SMAS的无创、有效技术[4],不仅直接显示十二指肠梗阻,而且可以准确测量SMA与主动脉的夹角和距离。作为对SMAS诊断的补充,CT还能显示其并发症,包括:气腹和门静脉积气、左肾静脉受压(可造成肾静脉血栓,即“胡桃夹”征)。超声也能无创显示AMA,且无电离辐射危害[10],但对胃和十二指肠扩张不敏感,且受操作者主观因素影响较大[4]。
3D-CE-MRA无X线辐射,所用对比剂肾毒性低,且用量少,对合并肾功能不全的SMAS患者尤为重要。3D-CE-MRA技术成熟,已广泛应用于腹部大血管的评估,如动脉瘤、肾动脉狭窄等。但目前应用于SMAS的诊断仅见个例报道[11],本研究可以为临床应用3D-CEMRA诊断SMAS提供正常值范围和诊断依据。
3.3 AMA正常值范围 阮骊韬等[12]采用超声测量15名正常人的AMA值为(36.31±8.55)°;王磊等[13]采用CTA测量32名正常儿童的AMA值为(68.4±22.6)°;刘江涛等[14]采用CTA测量123名正常对照组的AMA值为(60.9±19.4)°。国外研究结果为:AMA值平均为45°(38°~60°)[15]、20°~70°[8]、44.4°(28°~65°)[9]。上述研究结果提示AMA测量结果差异较大,且正常值范围较广,其临床价值有限。AMA与BMI相关[6,7],通过不同BMI分级确定AMA的正常值范围对诊断SMAS更有价值[6]。临床疑诊SMAS时,可以通过MRA测量AMA,并参照患者BMI分级,可以为诊断SMAS提供依据。
3.4 本研究的局限性 本研究根据BMI分级确定AMA的正常值范围,但BMI并不能真实反映腹腔脂肪的含量,AMA与腹腔脂肪面积的相关性高于BMI[7]。但是腹腔脂肪面积并没有公认的分级标准,而BMI简便实用,已有公认的分级标准,并在临床广泛应用。
总之,通过3D-CE-MRA测量发现非SMAS患者的AMA与BMI显著相关,根据BMI级别确定的AMA正常值范围有助于通过MRI诊断SMAS。
[1]Matheus CO, Waisberg J, Toledo Zewer MH, etal.Syndrome of duodenal compression by the superior mesenteric artery following restorative proctocolectomy: a case report and review of literature. Sao Paulo Med J, 2005,123(3): 151-153.
[2]Clapp B, Applebaum B. Superior mesenteric artery syndrome after Roux-en-y gastric bypass. JSLS, 2010,14(1): 143-146.
[3]Paula HA, Ribeiro RD, Rosado LE, etal. Classic anthropometric and body composition indicators can predict risk of metabolic syndrome in elderly. Ann Nutr Metab,2012, 60(4): 264-271.
[4]Unal B, Aktas A, Kemal G, etal. Superior mesenteric artery syndrome: CT and ultrasonography findings. Diagn Interv Radiol, 2005, 11(2): 90-95.
[5]Zadegan F, Lenoir T, Drain O, etal. Superior mesenteric artery syndrome following correction of spinal deformity:case report and review of the literature. Rev Chir Orthop,2007, 93(2): 181-185.
[6]Ozkurt H, Cenker MM, Bas N, etal. Measurement of the distance and angle between the aorta and superior mesenteric artery normal values in different BMI categories. Surg Radiol Anat, 2007, 29(7): 595-599.
[7]Ozbulbul NI, Yurdakul M, Dedeoglu H, etal. Evaluation of the effect of visceral fat area on the distance and angle between the superior mesenteric artery and the aorta. Surg Radiol Anat, 2009, 31(7): 545-549.
[8]Welsch T, Büchler MW, Kienle P. Recalling superior mesenteric artery syndrome. Dig Surg, 2007, 24(3): 149-156.
[9]Konen E, Amitai M, Apter S, etal. CT angiography of superior mesenteric artery syndrome. Am J Roentgenol,1998, 171(5): 1279-1281.
[10]谭石, 李敬府, 白志勇, 等. 彩色多普勒血流显像对肠系膜上动脉闭塞性疾病的诊断价值. 中国医学影像学杂志, 2011, 19(9): 659-662.
[11]Rosa-Jimenez F, Rodriguez Gonzalez FJ, Puente Gutierrez JJ, etal. Duodenal compression caused by superior mesenteric artery: study of 10 patients. Rev Esp Enferm Dig, 2003, 95(7): 485-489.
[12]阮骊韬, 段云友, 曹铁生, 等. 肠系膜上动脉夹角的测量在精索静脉曲张诊疗中的价值.中华超声影像学杂志,2004, 13(7): 525-527.
[13]王磊, 李欣, 王春祥, 等. 儿童肠系膜上动脉夹角的多层螺旋CT研究. 放射学实践, 2007, 22(11): 1225-1227.
[14]刘江涛, 杨立, 肖越勇. 胡桃夹综合征及其相关解剖的多层螺旋CT研究. 中国医学计算机成像杂志, 2006, 12(3):192-195.
[15]Baltazar U, Dunn J, Floresguerra C, etal. Superior mesenteric artery syndrome: an uncommon cause of intestinal obstruction. South Med J, 2000, 93(6): 606-608.

