动态增强磁共振成像结合扩散加权成像诊断乳腺病变的多参数分析
张 静 ZHANG Jing
安宁豫2 AN Ningyu
程流泉2 CHENG Liuquan
蔡幼铨2 CAI Youquan
郭 勇1 GUO Yong
2.解放军总医院放射科 北京 100853
动态增强磁共振成像(dynamic contrast-enhanced MR imaging, DCE-MRI)和扩散加权成像(DWI)在乳腺病变中的广泛应用,提供了关于形态学、血流动力学及表观扩散系数(ADC)等大量诊断信息。本研究旨在通过分析乳腺良、恶性病变的形态学、血流动力学表现,结合ADC值,采用单变量和多变量分析,分析有意义的恶性MR征象,制订乳腺癌的MR诊断策略,探讨DCE-MRI结合DWI对乳腺病变的诊断和鉴别诊断价值。
1 资料与方法
1.1 研究对象 纳入2005-03~2009-06行乳腺DCEMRI和DWI检查并经病理证实的223例乳腺病变患者,其中女性221例,男性2例;年龄18~75岁。排除标准:①MR检查前1周内行乳腺肿块穿刺者;②已行新辅助化疗者;③因脂肪抑制不均匀而影响病变观察者;④因金属异物或运动产生伪影者。
1.2 仪器与方法 采用GE 1.5T超导磁共振扫描仪(Signa Excite HD),梯度场40mT/m,梯度切换率150T/(m•s);4通道乳腺专用表面线圈。采用平面回波-扩散加权成像序列(EPI-DWI):b值=0、1000s/mm2。动态增强扫描采用VIBRANT序列,注射造影剂前及注射后0、1、2、3、4、5、6min各扫描一次,造影剂采用钆喷替酸葡甲胺(Gd-DTPA)0.1mmol/kg,高压注射器注射速度2ml/s。
1.3 图像后处理 应用ADW 4.3图像处理工作站,由2名有乳腺MR工作经验的放射科医师采用双盲法独立阅片,参照美国放射学会(ACR)2003年乳腺MR影像报告与数据系统(BI-RADS MRI)[1]将病变分为肿块性病变和非肿块性病变,分析其形态学表现和血流动力学表现,测量ADC值。形态学表现诊断要点包括:肿块的形状、边缘及内部增强特征,非肿块性病变的分布特征及内部增强特征。应用Functool软件,感兴趣区(ROI)置于病变增强最显著区,制作时间-信号强度曲线(TIC)。血流动力学表现诊断要点包括:TIC类型(持续上升型、平台型、廓清型)、早期增强率、平台型及廓清型曲线的最大增强率和达峰时间。早期增强率采用1min增强率计算。ADC值测量:应用Functool软件,参照MR增强扫描图像对病变进行准确定位,将ROI置于病变区,要求ROI略小于病变,并尽量避免病变坏死或囊变区,在ADC图上测量其平均ADC值;将ROI置于对侧正常乳腺腺体致密区,测量其平均ADC值作为正常对照。所有数据均测量3次取平均值。
1.4 病理检查 病理切片由病理科医师进行染色及免疫组化分析后作出病理诊断。
1.5 数据分析 根据接收者工作特征曲线(ROC)确定诊断界值。根据单变量Logistic回归分析的P值和风险比(OR)分析有意义的恶性MR征象。OR>1为危险因素,是恶性征象;而OR<1为保护性因素,是良性征象。建立Logistic回归模型,并以病理诊断为“金标准”计算诊断模型的敏感性、特异性、诊断准确性、阳性预测值及阴性预测值。
1.6 统计学方法 采用SPSS 15.0软件,计量资料数据以±s 表示,乳腺良、恶性病变的最大增强率、1min增强率、达峰时间行t检验;进行单变量及多变量Logistic回归分析,P<0.05表示差异有统计学意义。
2 结果
2.1 病理结果 236个乳腺病灶均经穿刺或手术病理证实,其中恶性155个,良性81个;肿块性病变159例(恶性103例,良性56例);非肿块性病变75例(恶性50例,良性25例),2例无法明确分组。
2.2 肿块性病变的MR征象的单变量和多变量分析 肿块边缘、毛刺征、内部增强特征、TIC类型在良、恶性病变中差异有统计学意义(P<0.05);边缘不光滑、有毛刺、内部增强不均匀、廓清型TIC曲线是有显著意义的恶性征象;形状不规则、平台型曲线有恶性倾向(OR=4.265、5.319),但未达到显著水平(P>0.05)。恶性肿块的1min增强率高于良性肿块,差异有统计学意义(P<0.05);根据ROC曲线确定界值为105%,即1min增强率>105%诊断为恶性。将肿块形状、边缘、毛刺征、内部增强特征、TIC类型、ADC值纳入多变量回归模型(表1),根据回归模型计算出每个病变的预测概率。以病理结果为“金标准”,根据ROC曲线确定预测概率的界值为0.6196,即当预测概率>0.6196时诊断为恶性,该诊断模型的敏感性为85.3%(87/102),特异性为84.6%(44/52),阳性预测值为91.6%(87/95),阴性预测值为74.6%(44/59),诊断准确性为85.1%(131/154)。
2.3 非肿块性病变的MR征象的单变量和多变量分析TIC类型在良、恶性病变中差异有统计学意义(P<0.05);廓清型TIC曲线为恶性征象;平台型曲线和节段性分布有恶性倾向(OR=14.778、56.833),但未达到显著水平(P>0.05)。恶性病变的1min增强率高于良性病变,差异有统计学意义(P<0.05)。根据ROC曲线确定界值为75%,即1min增强率>75%诊断为恶性。良、恶性病变最大增强率和达峰时间差异无统计学意义(P>0.05)。将TIC类型和ADC值纳入回归模型(表2),根据回归模型计算出每个病变的预测概率。以病理结果为“金标准”,根据ROC曲线确定预测概率的界值为0.6295,即当预测概率>0.6295时诊断为恶性,该诊断模型的敏感性为82.0%(41/50),特异性为83.3%(20/24),阳性预测值为91.1%(41/45),阴性预测值为69.0%(20/29),诊断准确性为82.4%(61/74)。
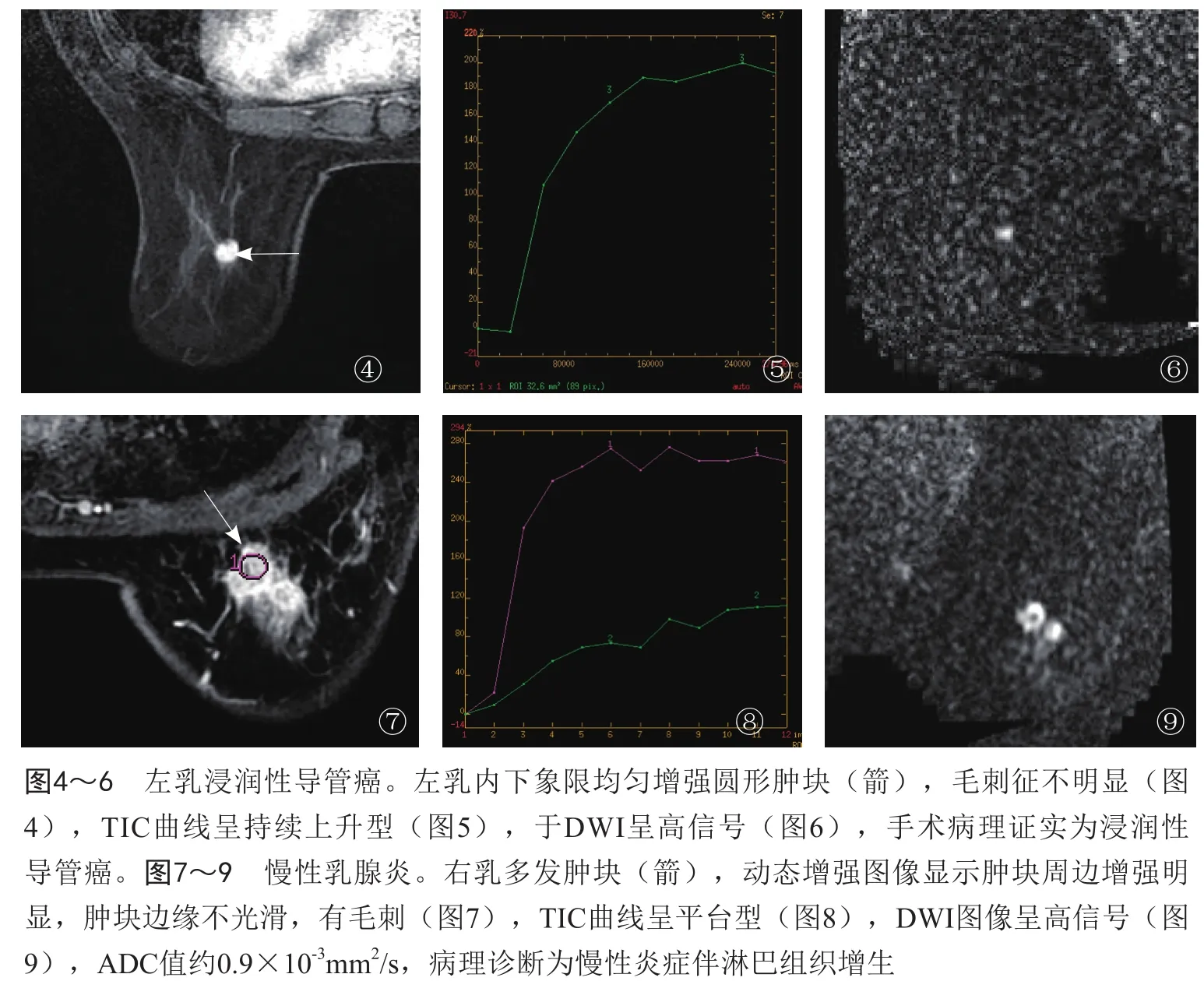
2.4 回归模型的验证与病理对照分析 真阳性病例如图1~3所示,左乳外上象限肿块,不规则形,边缘不光滑,毛刺征明显,TIC呈廓清型,ADC值约为0.8×10-3mm2/s,各个征象均提示为恶性,根据回归模型预测其恶性概率为98%,穿刺病理证实为乳腺癌。如图4~6所示,左乳内下象限均匀增强圆形肿块,边缘较光滑,毛刺征不明显,TIC为持续上升型,ADC值约为0.8×10-3mm2/s,凭主观判断其良恶性有一定困难,根据回归模型预测其恶性的概率为98%,手术病理证实为浸润性导管癌。假阳性病例如图7~9所示,右乳多发不规则肿块,周边增强明显,边缘不光滑,毛刺征明显,TIC呈平台型,DWI上肿块周边呈高信号,ADC值约为0.9×10-3mm2/s,评估为BI-RADS 4级,高度怀疑恶性;回归模型预测其恶性概率为90%,病理诊断为乳腺慢性炎症。

表1 肿块性病变的Logistic回归模型、参数估计及检验结果

表2 非肿块性病变的Logistic回归模型、参数估计及检验结果

3 讨论
3.1 肿块性病变的MR表现及诊断效能 本研究对159例肿块性病变进行单变量分析结果表明,毛刺征、边缘不光滑、内部增强不均匀是典型的恶性征象。毛刺征恶性风险最大(OR=23.1),边缘光滑、无毛刺、内部均匀增强是典型良性表现;Tozaki等[2]总结了171例乳腺肿块性病变,发现最常见的恶性征象为内部不均匀增强(96%),阳性预测值最高的恶性征象为毛刺征(100%)、中心延迟增强(100%)、内部间隔增强(97%)和形状不规则(97%),诊断准确率最高的恶性征象为毛刺征(100%),最常见的良性征象为边缘光滑(占80%~82%),可见肿块边缘和内部增强特征是鉴别其良恶性的关键。 但是良恶性肿块的形态学表现存在交叉重叠,本研究中少数恶性肿块表现为无毛刺(27.2%)、边缘光滑(17.5%)、内部均匀增强(11.7%),少数良性肿块有毛刺(10.7%)、边缘不光滑(19.6%)、内部增强不均匀(42.9%)。Lee等[3]报道毛刺征常见于恶性病变,但也见于放射状瘢痕。Szabo等[4]研究发现高级别的浸润性导管癌周边增强更显著,但脂肪坏死或伴有炎症反应的囊肿也常表现为环形增强[5]。本研究发现,TIC类型在良恶性肿块中有显著差异,其中廓清型曲线是典型恶性征象,平台型曲线在良恶性均可见,但多见于恶性;持续上升型曲线多见于良性肿块。恶性肿块的1min增强率高于良性肿块,根据ROC曲线确定界值,肿块的1min增强率>105%时诊断为恶性,但敏感性较低(56.7%),特异性较高(71%),诊断效能较低。
3.2 非肿块性病变的MR表现及诊断效能 本研究结果表明节段性分布明显多见于恶性(93.9%),节段性分布的恶性风险大(OR=56.833),是非肿块性病变的典型恶性征象。非肿块性病变的1min增强率>75%时诊断为恶性,敏感性和特异性分别为76.0%和77.3%。最大增强率和达峰时间在良恶性病变之间并无显著差异。非肿块性病变的定性诊断有一定困难。Liberman等[6]发现导管样分布或节段性分布多见于导管内癌、浸润性导管癌,但也可见于不典型导管增生、乳头状瘤或硬化性腺病。Sakamoto等[7]总结了102例非肿块性病变的MRI表现及BI-RADS分级,发现簇状环形增强的恶性肿瘤阳性预测值最高,为67%;分支导管样增强、簇状增强、线性导管样增强的阳性预测值分别为38%、20%、11%,并指出簇状环形增强、导管分支样增强及簇状增强的非肿块病变应评估为BIRADS 4级而行活检。因此,正确判断非肿块性病变的分布特点和内部增强特征对于鉴别其良恶性至关重要。Kuhl等[8]认为早期增强率的诊断价值相对较低,可以牺牲一定的时间分辨率来增加空间分辨率,有助于显示病变内部的细微结构及边缘形态特征,提高诊断信心和诊断准确率。本研究增强扫描序列中每时相采集时间为1min,可以同时兼顾时间分辨率和空间分辨率。
3.3 DCE-MRI与DWI联合应用诊断模型的建立及诊断效能 DCE-MRI和DWI联合应用可提供大量的诊断信息,而面对众多MR征象如何进行综合判断,是实际工作中面临的又一大难题。以往有研究采用Fischer评分法根据DCE-MRI预测病变的恶性概率[9],将圆形、类圆形、分叶形和边缘光滑定为0分,不规则形、毛刺或边界模糊定为1分,TIC流入型曲线为0分,平台型曲线为1分,流出型为2分;形态(0、1)+动态(0、1、2)计算总分,积分为2分诊断可疑恶性,积分为3分诊断恶性,以≥2分为动态增强扫描阳性诊断[10]。而本研究结果显示,各个征象在回归模型中对恶性评判所占权重不同,不能简单用1分或2分来评判,此外,Fischer评分法只是针对形态学和血流动力学表现,无法对DCE-MRI与DWI联合诊断进行分析。因此,本研究采用Logistic回归多变量分析,在形态学、血流动力学及ADC值等大量诊断信息中,提取有价值的诊断指标,并根据各自所占权重建立诊断模型,预测恶性发生概率,使联合诊断得到合理应用。
本研究多变量分析结果显示,肿块形状、边缘、毛刺征、内部增强特征、TIC类型和ADC值对肿块良恶性评判有意义,根据ROC曲线确定预测概率的界值为0.6196时,诊断模型的敏感性、特异性、阳性预测值、阴性预测值和准确性分别为85.3%、84.6%、91.6%、74.6%和85.1%。而对于非肿块性病变,只有TIC和ADC值对良恶性评判有意义,根据ROC曲线确定预测概率的界值为0.6295,诊断模型的敏感性、特异性、阳性预测值、阴性预测值和准确性分别为82.0%、83.3%、91.1%、69.0%和82.4%。Yabuuchi等[11]对192个乳腺肿块进行单变量和多变量分析认为,边缘不规则、内部不均匀增强、边缘增强、平台型和廓清型TIC、ADC值<1.1×10-3mm2/s是有意义的恶性指征,将这6个征象纳入回归模型,诊断的敏感性、特异性、阳性预测值、阴性预测值和准确性分别为92%、86%、97%、71%和91%,与本研究结果相似。但是对乳腺非肿块性病变的相关研究少见报道。
DCE-MRI与DWI联合应用诊断乳腺癌的敏感性、特异性和准确性都有了很大的提高,笔者建议将DCEMRI和DWI作为乳腺常规扫描方法,对于肿块和非肿块应当采用不同的诊断策略。对于典型病例术前MR诊断并不困难,但在实际工作中,并非所有病例都表现如此典型,凭主观判断其良恶性有一定困难,合理应用统计学方法建立诊断策略可以增强诊断信心,减少个体差异,提高乳腺癌的诊断准确率。
DCE-MRI与 DWI联合应用仍然存在假阳性和假阴性。少数乳腺癌术前MR也有可能漏诊,包括分化好的浸润性导管癌、特殊病理类型的乳腺癌如髓样癌、筛状癌、神经内分泌癌、黏液腺癌等,尤其当肿瘤直径<1cm时,其形态学常为良性表现,毛刺征常不明显,更容易漏诊。同样,少数良性病变如脂肪坏死、慢性乳腺炎、导管内乳头状瘤等容易诊断为恶性。由此可见,乳腺病变的影像学表现复杂多样,尚需进一步积累病例反复总结经验,深入认识各种MR征象,不断改进、完善诊断策略,减少主观偏移,从而提高乳腺癌的诊断准确性。
[1]American College of Radiology. Breast imaging reporting and data system atlas (BI-RADS atlas). Reston, VA:American College of Radiology, 2003: 8-62.
[2]Tozaki M, Igarashi T, Fukuda K. Positive and negative predictive values of BI-RADS-MRI descriptors for focal breast masses. Magn Reson Med Sci, 2006, 5(1): 7-15.
[3]Lee SH, Cho N, Kim SJ, etal. Correlation between high resolution dynamic MR features and prognostic factors in breast cancer. Korean J Radiol, 2008, 9(1): 10-18.
[4]Szabó BK, Aspelin P, Kristoffersen Wiberg M, etal. Invasive breast cancer: correlation of dynamic MR features with prognostic factors. Eur Radiol, 2003, 13(11): 2425-2435.
[5]Levrini G, Nicoli F, Borasi G, etal. MRI patterns of invasive lobular breast cancer. Eur J Radiol, 2006, 59(3): 472.
[6]Liberman L, Morris EA, Dershaw DD, etal. Ductal enhancement on MR imaging of the breast. Am J Roentgenol, 2003, 181(2): 519-525.
[7]Sakamoto N, Tozaki M, Higa K, etal. Categorization of non-mass-like breast lesions detected by MRI. Breast Cancer, 2008, 15(3): 241-246.
[8]Kuhl CK, Schild HH, Morakkabati N. Dynamic bilateral contrast-enhanced MR imaging of the breast: trade-off between spatial and temporal resolution. Radiology, 2005,236(3): 789-800.
[9]Fischer U, Kopka L, Grabbe E. Breast carcinoma: effect of preoperative contrast enhanced MR imaging on the therapeutic approach. Radiology, 1999, 213(3): 881-888.
[10]李洁, 张晓鹏, 曹崑, 等. 乳腺MR动态增强扫描联合扩散加权成像的临床应用评价. 中国医学影像技术, 2005,21(12): 1821-1825.
[11]Yabuuchi H, Matsuo Y, Okafuji T, etal. Enhanced mass on contrast-enhanced breast MR imaging lesion characterization using combination of dynamic contrast enhanced and diffusion weighted MR images. J Magn Reson Imaging, 2008, 28(5): 1157-1165.

