1-苯基-2-硫脲对斑马鱼胚胎发育与黑色素生成的影响
张利军,史慧勤,苑晓燕,余寿忠,赵 君,彭双清
(军事医学科学院疾病预防控制所毒理学评价研究中心,北京 100071)
1-苯基-2-硫脲对斑马鱼胚胎发育与黑色素生成的影响
张利军,史慧勤,苑晓燕,余寿忠,赵 君,彭双清
(军事医学科学院疾病预防控制所毒理学评价研究中心,北京 100071)
目的 1-苯基-2-硫脲(PTU)可抑制斑马鱼胚胎黑色素的产生,保持斑马鱼透明,便于形态观察和信号检测。本文研究了PTU对斑马鱼胚胎发育的影响和抑制斑马鱼胚胎黑色素生成,保持斑马鱼透明性的最佳浓度。方法 用不同浓度PTU处理23 hpf(受精后,hours post fertilization,hpf)斑马鱼胚胎,作用57 h后观察80 hpf斑马鱼的形态学、生理学改变,计算死亡率和孵化率,测量心率和静脉窦-动脉球之间的距离。结果 浓度为0.197mmol/L、0.296mmol/L PTU可以有效抑制黑色素生成,保持斑马鱼整体透明,对斑马鱼心血管系统结构和生理功能无影响,且不影响斑马鱼正常孵化过程。随着PTU浓度的增加,斑马鱼死亡率增加,孵化率下降,出现心包水肿,心脏畸形等改变,心率下降,静脉窦-动脉球之间的距离增大。结论 浓度不高于0.296mmol/L的PTU溶液能有效抑制斑马鱼黑色素生成,对斑马鱼心血管毒性研究无影响。
1-苯基-2-硫脲;斑马鱼;心率;孵化率
斑马鱼(Danio rerio)作为一种新型脊椎模式生物已被广泛应用于毒理学研究。斑马鱼易饲养,繁殖能力强,斑马鱼胚胎透明,生长发育快,施药方式简单[1]。斑马鱼胚胎在发育早期,即使心血管系统有缺陷,也可以依靠溶解氧继续发育。目前,斑马鱼已成为OECD和ISO毒性试验的推荐测试物种[2-4]。斑马鱼胚胎透明,发育到24 h左右则开始出现黑色素,黑色素细胞会影响基因表达信号、绿色荧光蛋白信号、整体原位杂交信号检测。因此,需要对斑马鱼胚胎进行处理,抑制黑色素生成,保持其透明性。研究表明在斑马鱼原肠胚期(5.5 hpf)后使用PTU溶液代替养鱼用水,能有效抑制黑色素生成,保持斑马鱼透明性,但PTU也具有毒性作用,高浓度PTU可影响斑马鱼孵化率,甚至产生致畸和致死效应[5]。本文研究不同浓度 PTU对斑马鱼胚胎发育的影响,为运用斑马鱼进行心血管毒性评价研究时选择合适浓度PTU提供参考资料。
1 材料和方法
1.1 实验动物
实验所用斑马鱼为AB系斑马鱼,由北京大学生命科学院惠赠,本实验室繁殖。斑马鱼的养殖和繁殖参照标准的方法[6]。雌雄斑马鱼成鱼分开饲养于爱生斑马鱼养殖系统中。水温保持在28.5±1℃,盐度为 450~500 mS/cm2,pH 为 7.5~8.5,光照周期为照明14 h/黑暗10 h交替进行,每日喂2次活丰年虾。采卵时,首日傍晚按雌雄1∶1的比例将健康斑马鱼成鱼放入交配缸内,次日清晨获得受精卵。对受精卵进行清洗后,移入斑马鱼胚胎培养用水(60 mg/mL海盐)中,28.5℃恒温培养箱中培养。
1.2 受试药物
1-苯基-2-硫脲(PTU)购自 sigma公司。将 PTU粉末溶于 0.3× Danieau(17mmol/L NaCl,2mmol/L KCl,0.12mmol/L MgSO4,1.8mmol/L Ca(NO3)2,1.5mmol/L HEPS,pH7.6)培养液中,配制成0.197mmol/L、0.296 mmol/L、0.742 mmol/L、1.48mmol/L、2.96mmol/L、7.39mmol/L 浓度的 PTU 试验液。
1.3 处理胚胎方法
在Olympus SZX10型体视显微镜下选择发育至23 hpf(28体节期)的野生型AB系斑马鱼胚胎,按照随机分配原则,每浓度30枚胚胎,加入相应浓度PTU。对照组为胚胎培养用水。随后加盖封闭,置于28.5℃恒温光照培养箱内,让胚胎继续发育。待斑马鱼发育至80 hpf进行观察、拍照。此刻,未暴露斑马鱼胚胎已都孵化成幼鱼[7]。试验过程中,每24 h更换1次PTU溶液。
1.4 死亡率与孵化率计算
每天观察1次斑马鱼胚胎死亡、存活情况,并详细记录,将死亡胚胎和幼鱼移去。斑马鱼发育至80 hpf,计算累积死亡率百分率,可根据艾博特(Abbott's)公式用对照组的死亡率进行校正[8]:
P=100- [(C-P')/C×100]
P——已校正的存活百分率,%;
P'——试验浓度组中所观察到的存活百分率,%;
C——对照组中的存活百分率,%。
斑马鱼胚胎从48 h开始孵化,胚胎躯体全部(从头到尾)从绒毛膜内出来,认为斑马鱼由胚胎孵化为幼鱼。斑马鱼发育到80 hpf,基本全部孵化[9]。因此,我们从48 hpf定时观察孵化情况,80 hpf统计各组斑马鱼孵化率。
1.5 形态观察
Olympus SZX10型体视显微镜下每日观察PTU对斑马鱼的影响,观察的毒性终点包括:心包和卵黄囊水肿、出血、畸形等。
1.6 心率测量
斑马鱼发育至80 hpf,从各处理组和对照组随机选择5条斑马鱼,在用显微摄像系统(340M-00-GE,DVC Co.,USA)对斑马鱼心跳摄像 30 s。使用Image J软件对斑马鱼心跳录像进行分析,统计心率[10]。
1.7 静脉窦(sinus venous)与动脉球(bulbus arteriosus)距离测量
斑马鱼心脏发育基本在最初2 d完成。30 hpf形成心室和心房,36 hpf心脏发生向右环化[11],使得心房、心室在侧面观上部分重叠,心室在心房的右前侧。心脏发育过程受到影响,心房和心室的位置将发生改变,静脉窦(血液进入斑马鱼心脏的部位)和动脉球(血液流出斑马鱼心脏的部位)之间的距离相应发生改变,两者之间的距离是评价心脏环化程度的指标,通过测量静脉窦与动脉球之间的距离可量化评价药物对斑马鱼心脏影响程度[12]。
1.8 统计分析
2 结果
2.1 PTU对斑马鱼死亡率的影响
斑马鱼发育至80 hpf,统计胚胎和幼鱼死亡数,结果如表1所示,对照组斑马鱼发育正常,无胚胎和幼鱼死亡,死亡率为0。2.96mmol/L PTU实验组斑马鱼出现死亡,死亡率为40.0±8.82%。7.39mmol/L PTU实验组斑马鱼全部死亡,死亡率达到100%。

表1 PTU对斑马鱼胚胎死亡率的影响Tab.1 Mortality of PTU on zebrafish embryos
2.2 PTU对斑马鱼孵化率的影响
结果如表2所示,斑马鱼发育至80 hpf,对照组斑马鱼胚胎已全部孵化成幼鱼。PTU可抑制斑马鱼孵化,随着PTU浓度的增加,孵化率逐渐下降,0.197mmol/L、0.296mmol/L PTU组斑马鱼胚胎全部孵化,0.742mmol/L组孵化率为 17.78±5.09%,1.48mmol/L PTU组斑马鱼胚胎孵化率为8.89±1.92%。2.96mmol/L PTU组斑马鱼无孵化,孵化率为0。

表2 PTU对斑马鱼孵化率的影响Tab.2 Hatching rates of PTU on zebrafish embryos
2.3 PTU对斑马鱼形态影响
结果如图1所示,斑马鱼胚胎发育至80 hpf,对照组斑马鱼胚胎孵化成幼鱼,形态正常,心血管系统等无畸形,有黑色素沉着。PTU实验组斑马鱼透明,无黑色素。0.197mmol/L、0.296mmol/L PTU实验组斑马鱼胚胎孵化成幼鱼,形态正常,心血管系统等无形态学改变,无黑色素沉着。0.742mmol/L PTU实验组的斑马鱼胚胎孵化延迟,1.48mmol/L、2.96mmol/L PTU实验组斑马鱼出现心包水肿,心脏畸形等形态学改变,畸形程度随着浓度的增加而严重。7.39mmol/L PTU实验组斑马鱼胚胎无孵化,全部死亡。

图1 不同浓度PTU处理后,80 hpf斑马鱼发育情况Fig.1 Normal and abnormal development of zebrafish embryos to PTU for different exposure concentration at 80hpf
2.4 PTU对斑马鱼心率影响
PTU作用57 h后,测量80 hpf斑马鱼心率。结果如图2所示,PTU实验组斑马鱼心率下降。与对照组相比较,0.197mmol/L,0.296mmol/L PTU实验组斑马鱼心率和对照组斑马鱼心率差异无统计学意义。0.742mmol/L,1.48mmol/L,2.96mmol/L PTU 实验组斑马鱼心率与对照组相比,差异具有统计学意义,随着PTU浓度增加而逐渐降低,呈剂量-反应关系。而7.39mmol/L PTU实验组斑马鱼全部死亡,无心率数据。
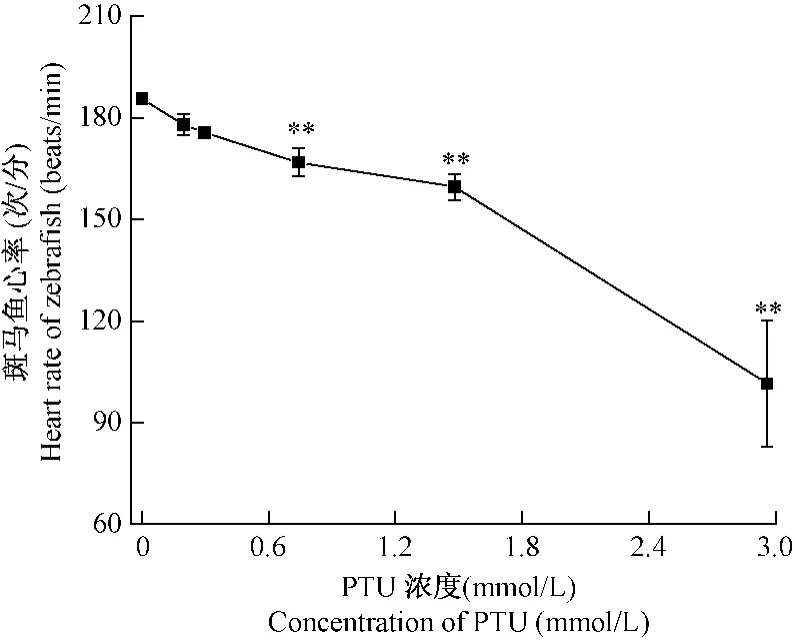
图2 PTU对80hpf斑马鱼心率的影响Fig.2 PTU effects on heart rate of zebrafish embryos at 80hpf
2.5 PTU对斑马鱼SV-BA距离的影响
PTU可影响斑马鱼心脏发育,造成斑马鱼心脏环化不全,SV-BA之间的距离发生改变。结果如图3所示,1.48mmol/L、2.96mmol/LPTU处理组斑马鱼SV-BA距离比对照组斑马鱼SV-BA间距增大,差异具有统计学意义。

图3 80 hpf斑马鱼静脉窦(SV)与动脉球(BA)之间的距离Fig.3 Distance between the sinus venosus(SV)and bulbus arterious(BA)in 80hpf zebrafish embryos
3 讨论
斑马鱼在发育初期通体透明,发育过程中逐渐出现色素。斑马鱼有3种色素细胞:黑色素细胞、黄色素细胞、虹色素细胞[13]。斑马鱼发育至 24 hpf,黑色素开始从视网膜上皮生成,几小时内黑色素细胞迅速布满胚胎。黑色素细胞的形成会对实验数据的采集和结果的判断产生干扰。为排除黑色素的影响,保证科学研究结果的准确性,需要保持斑马鱼胚胎透明。目前,最常用的方法是在试验过程中,加入PTU抑制黑色素的生成。PTU的作用原理是降低酪氨酸羟化酶活性,抑制酪氨酸向黑色素的转换,从而阻断黑色素合成途径[14]。本研究结果表明,从23 hpf(28体节期)添加0.197mmol/L~0.296mmol/L PTU能有效抑制发育至80 hpf斑马鱼黑色素形成,保持斑马鱼透明性。
对于毒理学试验而言,毒性终点的选择至关重要。生理功能的改变要早于形态学的改变,是最合适和最敏感的评价指标[15]。研究发现心率是评价心脏功能最灵敏的指标。斑马鱼心脏在22 hpf开始跳动,起初是一种蠕动波。36 hpf心房和心室协调收缩。48 hpf功能性瓣膜开始形成。本研究结果表明0.197mmol/L、0.296mmol/L PTU对斑马鱼心率不产生影响。0.742mmol/L、1.48mmol/L、2.96mmol/L PTU影响斑马鱼心脏功能,显著性减低斑马鱼心率,呈现剂量-反应关系。
孵化是斑马鱼生命过程中一个关键点,但不是个体发育点,不属于斑马鱼胚胎发育的一个具体阶段。孵化是一个生化和行为相结合的过程。首先,孵化岛合成消化绒毛膜的酶,这些酶是高绒毛膜裂解酶(HCE)和低绒毛膜裂解酶(LCE);然后这些酶裂解绒毛膜,斑马鱼胚胎躯体扭曲撕开绒毛膜,脱去绒毛膜,完成孵化过程,成为幼鱼。因此,化合物对这两环节中任一环节产生毒性作用都将影响其孵化,降低孵化率和延迟孵化[9]。孵化率是评价化合物对斑马鱼是否产生毒性作用的一个敏感指标。我们发现浓度高于0.742mmol/L的PTU可对斑马鱼胚胎产生毒性作用,降低其孵化率。
高浓度的PTU不仅影响斑马鱼心脏功能,还影响斑马鱼心脏发育过程,产生器质性损害,引起心包水肿等畸形,心脏环化不全,表现为SV与BA之间的距离明显增长。我们研究发现0.197mmol/L、0.296mmol/L PTU对斑马鱼心脏形态和功能不产生任何影响,不影响斑马鱼胚胎心脏发育过程和孵化过程,能很好抑制斑马鱼黑色素生成,保持斑马鱼透明性。Karlsson等[5]报道75mmol/L PTU可抑制黑色素生成,且对斑马鱼胚胎结构和孵化率无影响,但该浓度并未被其他研究人员接受。可能是该浓度只能完全抑制36 h前斑马鱼黑色素生成,并不能完全抑制36 h后斑马鱼黑色素生成[16]。我们从斑马鱼心血管系统的结构和功能两方面研究PTU的心血管毒性作用,发现使用的PTU浓度虽然比文献报道的浓度要高,但对斑马鱼的结构和生理功能没有影响,且能有效保持发育至80 hpf斑马鱼胚胎的透明性。所以,我们认为在斑马鱼心血管毒性试验中可以选择低于0.296mmol/L浓度的PTU抑制斑马鱼黑色素的生成,且对实验结果不会产生影响。因此,在保证PTU对斑马鱼心血管系统无毒性影响的前提下,可以选择合适的PTU浓度,以保证抑制黑色素生成的效果。
致谢:感谢中国医学科学院生物技术研究所张靖溥老师提供DVC显微摄像系统。
[1]Phelps HA,Neely MN.Evolution of the zebrafish model:from development to immunity and infectious disease[J].Zebrafish,2005,2(2):87-103.
[2]OECD.Fish,Early Life Stage Toxicity Test(Guideline 210).1992,1-18.
[3]OECD.Fish,Short-term Toxicity Test on Embryo and Sac-fry Stages (Guideline 212),1998,1-20.
[4]ISO. Water Quality-Determination of Toxicity to Embryos and Larvae of Freshwater Fish—Semi-Static Method,1999,12890,1-14.
[5]Karlsson J,von Hofsten J,Olsson PE. Generating transparent zebrafish: a refined method to improve detection of gene expression during embryonic development[J]. Mar Biotechnol(NY),2001,3(6): 522-527.
[6]Westerfield M. The Zebrafish Book[M]. Oregon: University of Oregon Press,2007.
[7]Hisaoka K. K,Battle HI. The normal developmental stages of the zebrafish,brachydanio rerio (hamilton-buchanan)[J]. Journal of Morphology,1958,102(2): 311-327.
[8]中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会. 化学品鱼类胚胎和卵黄囊仔鱼阶段的短期毒性试验[M],北京: 中国标准出版社,2008,1-13.
[9]Fraysse B,Mons R,Garric J. Development of a zebrafish 4-day embryo-larval bioassay to assess toxicity of chemicals[J].Ecotoxicol Environ Saf,2006,63(2): 253-267.
[10]佟军威,张靖溥,孟杰. 17α-乙炔雌二醇对斑马鱼胚胎发育的致畸作用及其基因靶位[J]. 药学学报,2011,46(1): 50-57.
[11]Stainier DY. Zebrafish genetics and vertebrate heart formation[J]. Nat Rev Genet,2001,2(1): 39-48.
[12]Lin CC,Hui MN,Cheng SH. Toxicity and cardiac effects of carbaryl in early developing zebrafish (Danio rerio)embryos[J].Toxicol Appl Pharmacol,2007,222(2): 159-168.
[13]Kelsh RN,Brand M,Jiang YJ,et al. Zebrafish pigmentation mutations and the processes of neural crest development[J].development,1996,123: 369-389.
[14]Whittaker JR. An analysis of melanogenesis in differentiating pigment cells of ascidian embryos[J]. Dev Biol,1966,14(1): 1-39.
[15]Contardo-Jara V,Pflugmacher S,Nutzmann G,et al. The betareceptor blocker metoprolol alters detoxification processes in the non-target organism Dreissena polymorpha[J]. Environ Pollut,2010,158(6): 2059-2066.
[16]孙桂金,潘杰,刘可春,等. 苯硫脲对斑马鱼黑色素生成及早期发育的影响[J]. 水产科学,2011,30(7): 387-390
Developmental and Melanogenesis Effects of 1-phenyl 2-thiourea(PTU)in Zebrafish Embryos
ZHANG Li-jun,SHI Hui-qin,YUAN Xiao-yan,YU Shou-zhong,ZHAO Jun,PENG Shuang-qing
(Research and Evaluation Center for Toxicology,Institute of Disease Control and Prevention,Academy of Military Medical Sciences,Beijing 100071,China)
Objective To generate transparent zebrafish,embryos may be treated with 1-phenyl 2-thiourea(PTU)to inhibit melanogenesis during embryogenesis.When working with techniques designed to study gene expression during embryogenesis,especially in teleosts,signal detection may be aggravated by pigmentation.Here we focus on the effects of PTU on embryo,and describes an optimized protocol for generating transparent zebrafish using PTU.Methods zebrafish embryos at the stage of 23 hpf(hours post fertilization)were treated with serial concentrations of PTU.Morphological and physiological endpoints were selected and quantified for unexposed and exposed embryos.Mortality,heart rate,hatching rate and SV-BA distance were detected until 80 hpf.Results Exposure to 0.197mmol/L and 0.296mmol/L PTU completely inhibited pigmentation while avoiding problems with embryo mortality,teratogenesis,reduced hatching frequency,and heart rate.The highest PTU concentration resulted in reduced hatching frequency and embryo mortality.We observed pericardial and yolk sac edema.Conclusion Optimized conditions can achieve complete inhibition of pigmentation for generating transparent zebrafish while avoiding toxic effects of PTU treatment.
1-phenyl-2-thiourea(PTU);Zebrafish;Heart rate;Hatching rate
R965.1 R332
A
1671-7856(2012)09-0021-05
10.3969.j.issn.1671.7856.2012.009.005
2012-08-25
国家“重大新药创制”科技重大专项(2009ZX09501-034);国家973计划(2011CB503803)。
张利军,男,博士生,研究方向:药物安全性评价。
彭双清,研究员,博士生导师,研究方向:药物安全性评价;Email:pengsq@hotmail.com。

