慢性低氧所致肺动脉高压对大鼠肺血管平滑肌细胞及成纤维细胞中蛋白激酶CβI的膜转位和蛋白表达量的影响
程振玲,于文燕,聂 欣,施熠炜,杜永成
(1.山西医科大学附属人民医院呼吸科,太原 030001;2.山西医科大学第一临床医学院呼吸科,太原 030001)
慢性低氧所致肺动脉高压对大鼠肺血管平滑肌细胞及成纤维细胞中蛋白激酶CβI的膜转位和蛋白表达量的影响
程振玲1,于文燕1,聂 欣1,施熠炜2,杜永成1
(1.山西医科大学附属人民医院呼吸科,太原 030001;2.山西医科大学第一临床医学院呼吸科,太原 030001)
目的 通过观察慢性低氧所致肺动脉高压对大鼠肺血管平滑肌细胞及成纤维细胞中蛋白激酶C βI(PKC βI)的膜转位和蛋白表达量的影响,初步探讨PKC βI在慢性低氧诱导大鼠肺动脉高压的发生、发展过程中所起的作用。方法 建立慢性常压低氧肺动脉高压大鼠模型,将雄性SD大鼠随机分为正常对照组、低氧1 d、3 d、7 d、14 d和21 d组,应用蛋白免疫印迹和免疫组化技术检测肺动脉高压形成过程中大鼠肺血管平滑肌细胞及成纤维细胞中PKC βI的膜转位和蛋白表达水平。结果(1)RVSP和 RV/(LV+S)比值较正常对照组明显增加(P<0.05),低氧后3 d、7 d、14 d和21 d后大鼠肺血管明显增厚;(2)大鼠肺血管平滑肌细胞和成纤维细胞均有 PKCβI的表达,且低氧14 d后 PKCβI的蛋白表达量较正常对照组相比降低(P<0.05)。结论 PKCβI蛋白表达量的下调可能参与了慢性低氧诱导的大鼠肺动脉高压肺血管重塑的发生、发展过程。
PKCβI;慢性低氧;肺动脉高压;膜转位;蛋白表达水平
肺动脉高压(pulmonary hypertension,PH)是一组由异源性疾病和不同发病机制引起的以肺血管阻力持续增加为特征的临床-病理生理综合征,临床表现为右心室后负荷增加,活动耐力下降,严重者可发生心脏衰竭而死亡,是最严重的具有潜在致命性的慢性肺循环疾病[1]。其基本病理生理特征是肺血管收缩和重塑。蛋白激酶C(protein kinase C,PKC)广泛分布于哺乳动物细胞中,属于丝/苏氨酸蛋白激酶家族,参与了细胞生长、分化和转化等多种生化过程,并且在激素、神经递质、生长因子和抗原等信号的传导中起到重要作用[2]。一些报道证实PKCβI表达在肺血管平滑肌和成纤维细胞中[3]。一些体外细胞实验研究也证实了 PKCβI作为细胞增殖信号转导通路的成员可能参与了肺动脉高压肺血管重塑的形成[4],但对参与 PH形成的PKCβI的慢性常压低氧大鼠的整体动物模型的研究尚无报道。本研究目的为通过观察大鼠肺血管平滑肌细胞及成纤维细胞中 PKCβI的膜转位和蛋白表达水平的变化,进而明确在动物整体模型中PKCβI是否参与慢性低氧诱导肺动脉高压的发生、发展过程。
1 材料和方法
1.1 主要试剂及仪器
鼠源性单克隆抗体(Anti-β-actin)(美国Sigma公司)、BCA蛋白定量试剂盒(BCA protein assay kit)(美国 Pierce 公司)、Gel-Doc 凝胶成像分析系统(美国 Bio-Rad公司)、Leica Qwin图像分析系统(德国 Leica公司)、蛋白/核酸分析仪(美国Barnstead公司)、高速离心机(美国 Barnstead公司)、超声波粉碎仪(美国 Cole-Parmer公司)、平推式石蜡切片机(德国 Leica公司)、高压氮氧混合气罐、氧浓度分析仪等。
1.2 动物模型的建立和分组
清洁级健康雄性成年SD大鼠60只,体重200~250 g,由山西医科大学实验动物部提供【SCXK(晋)2009-9991】,随机分成正常对照组、低氧1 d、3 d、7 d、14 d和21 d组,每组10只。正常对照组放置在空气中,其余低氧组放置在低氧舱中低氧相应的天数,向舱内输送氧气和氮气的混合气体。低氧舱内用氧浓度分析仪来检测氧气浓度,控制舱内氧浓度在(10±0.1)%,舱内放置钠石灰吸收 CO2,以无水CaCl2吸收水蒸气。每天打开舱门60min,用于清理低氧舱、补充饲料和饮水。
1.3 右心室收缩压(RVSP)和右心室肥大指数(RVHI)的测定
低氧各时相点结束后,分别从低氧各组和对照组中随机选择6只大鼠,10%水合氯醛(4mL/kg)腹腔注射麻醉后,经右颈总静脉插入微导管,通过压力传感器接上压力换能器和多导生理记录仪测大鼠右心室收缩压。测完后,取出心房,沿室间隔边缘分离出右心室(RV)和左心室+室间隔(LV+S),用滤纸吸干水分后称量 RV和 LV+S的重量,以RV/(LV+S)比值来反映右心室肥厚指数(RVHI)[5]。
1.4 肺组织苏木精-伊红(HE)染色
随机取6只大鼠右下肺相同部位组织,用10%中性福尔马林固定液(pH=7.4)固定,以梯度酒精顺序脱水,二甲苯透明,石蜡包埋,沿肺门水平横切,厚度约5 μm,进行HE染色。
1.5 PKC βI的膜转位和蛋白表达检测
1.5.1 肺血管的制备
低氧各时相点结束后,从低氧各组和对照组中随机选择6只大鼠,用10%水合氯醛腹腔注射麻醉后,剖胸取出肺脏,在手术显微镜下分离出肺动脉,放入Hanks液中漂洗,剪去镊夹过的中膜,将动脉纵行剪开,使内膜朝上,以圆钝的镊子或剪刀背轻轻刮去内皮细胞。制备后的血管先用滤纸将组织液尽量吸收干净,然后放入1.5mL的进口EP管中,立即放入液氮中冻存,备用[6]。
1.5.2 不同细胞组分的分离和提取
将冻存的肺动脉标本取出,加入组织裂解液Buffer A,手持式匀浆器匀浆、超声破碎,离心(4℃、30000×g)30 min,吸取上清,即得到胞浆蛋白成分。在移去上清的沉淀中,加等体积的 Buffer B后,匀浆、超声破碎,离心(4℃、30000×g)30 min,吸取上清,即得到膜相关蛋白成分。胞浆蛋白和膜相关蛋白用于PKCβI膜转位的分析。将标本取出后,待标本未完全融开时,将标本剪碎,按每1 mg组织10 μL的比例加入Buffer C,匀浆、超声破碎,使组织细胞溶解,即得到全细胞蛋白。全细胞蛋白用于PKCβI蛋白表达量的分析[7]。
1.6 蛋白免疫印迹(Western blot)
用BCA蛋白定量法对上述获得的蛋白组分进行蛋白定量,用凝胶加样缓冲液制备成电泳样品。取50 μg样品,用浓度为10%的凝胶进行电泳。电泳条件:4℃、恒流30 mA。电泳结束后将蛋白转移到聚偏二氟乙烯膜(polyvinylidene fluoride,PVDF)膜上。转膜条件:4℃、恒流 400 mA、3 h[8]。PVDF 膜用 TTBS缓冲液漂洗5 min,然后用10%脱脂牛奶将膜封闭1 h,用蒸馏水洗膜,再用 TTBS缓冲液洗膜3次,每次10 min。将膜放入浓度为1:500的兔源性单克隆抗体(Anti-cPKCβI)中,室温下孵育 3 h。蒸馏水洗膜,再用TTBS缓冲液洗膜3次。将膜放入1:5000的辣根过氧化物酶(HRP)标记的山羊抗兔或山羊抗小鼠IgG中,孵育1 h。弃二抗,蒸馏水洗膜,再用TTBS缓冲液洗膜3次。根据美国Pierce公司ECL试剂盒的步骤,得到特异蛋白条带的X光片[9]。
1.7 免疫组织化学染色(DAB)染色
将取出的肺组织固定4%的多聚甲醛中12~24 h,常规石蜡包埋、切片。二甲苯脱蜡,梯度酒精水化。室温下,3%H2O2-PBS溶液封闭内源性过氧化物酶10 min,PBS漂洗。96℃抗原热修复10 min。冷却后PBS洗涤。37℃ 5%羊血清孵育10 min,封闭非特异性抗原的结合位点。吸取多余血清,加入一抗(1∶200),室温下孵育3 h,4℃冰箱过夜。次日取出湿盒,37℃孵育40 min,用 PBS漂洗。加入生物素标记的羊抗兔免疫球蛋白(1∶300),37℃孵育30 min。弃二抗,PBS漂洗。加入辣根过氧化物酶标记的链霉卵白素(1∶300),37℃孵育 20 min。弃三抗,PBS漂洗。加 DAB避光显色,至显色满意后终止反应。苏木素复染数秒,梯度酒精、无水乙醇脱水。二甲苯透明、中性树胶封片。用Leica Qwin图像分析系统对切片进行观察和拍照。
1.8 数据处理和统计学分析
1.8.1 Western-blot数据处理和统计学分析
实验结果应用Gel Doc凝胶成像系统中的Quantity One图像分析软件进行定量分析。PKCβI膜转位水平的表示方法由Quantity One图像分析软件分析得出胞浆,膜相关和膜蛋白成分中,PKCβI在X-胶片上的密度值。然后,计算出 PKCβI在膜相关组份的密度值与PKCβI在胞浆,膜相关和膜蛋白成分总的密度值的比值。以正常对照组的比值作为100%,其余各组用百分数表示 PKCβI膜转位水平。实验数据用SPSS for Windows11.5统计软件进行单因素方差分析(One Way ANOVA),结果以均数±标准误(X±S.E.)表示,差异显著性水平 P<0.05,并用 Sigma-plot绘图软件作图。
PKCβI蛋白表达量的表示方法由 Quantity One图像分析软件分析得出胞浆,膜相关和膜蛋白成分中,PKCβI在X-胶片上的密度值。然后,计算出各组份PKCβI在 X-胶片上的密度值的总和。以正常对照组的比值作为100%,其余各组用各组份密度值的总和表示 PKCβI蛋白表达量。实验数据用SPSS for Windows11.5统计软件进行单因素方差分析(One Way ANOVA),结果以均数 ±标准误(X±S.E.)表示,差异显著性水平P<0.05。
1.8.2 免疫组化数据分析
PKCβI染色细胞计数方法 在高倍视野下对各组大鼠肺血管组织内染色阳性的细胞进行计数。每组选取5张切片,每张切片选取8个高倍视野,取平均值。计算出每0.01mm2面积中染色阳性的细胞数。实验数据用SPSS for Windows 11.5统计软件进行 T-检验(T-test),结果以均数 ± 标准误(X±S.E.)表示,P<0.05作为差异显著性水平。
2 结果
2.1 右心室收缩压(RVSP)和右心室肥厚指数(RVHI)的变化
如图1A随着低氧暴露时间的延长,与正常对照组比较,RVSP明显上升(与第0天比,P<0.05,23.76±0.82mmHg,n=6),并在低氧7d后达到顶峰。如图1B随着低氧暴露时间的延长,与正常对照组比较,RV/(LV+S)比明显增加(与第0天比,P<0.05,100%,n=6)。
2.2 肺血管苏木精-伊红(HE)染色结果
在低氧暴露3 d、7 d和21 d后大鼠的肺血管有明显的病理改变。如图2所示,和对照组相比(彩插2图2的A和E),肺动脉高压大鼠肺血管的远端(彩插2图2的 B,C和 D)和近端(彩插2图2的F)肺血管有明显的血管重塑,包括中膜肥大和外膜增生。这些结果表明长期暴露于低氧环境中可诱导大鼠形成肺动脉高压。

图1 右心室收缩压和右心室肥厚指数的变化Fig.1 Changs of RVSP and RVHI
2.3 在慢性低氧诱导的肺动脉高压大鼠肺血管平滑肌细胞及成纤维细胞中PKCβI特异性蛋白表达和膜转位
图3 的蛋白免疫印迹结果显示 PKCβI(79×103)存在于大鼠的肺血管平滑肌细胞及成纤维细胞中。如图4的A和B所示,和常氧对照组相比,在1-21d,PKCβI蛋白表达为(68.58±2.96%,47.39±7.40%,25.02±2.74%,38.52±2.69%和40.61±5.46%,P<0.05)。如图5所示,在肺动脉高压大鼠的肺血管平滑肌细胞及成纤维细胞中PKCβI的膜转位没有下降。
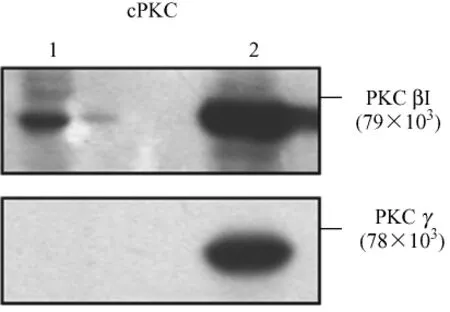
图3 PKCβI和 PKCγ在肺血管的表达Fig.3 Identification of PKCβI and PKCγ in pulmonary vasculars.
2.4 在慢性低氧诱导的肺动脉高压大鼠肺血管平滑肌细胞及成纤维细胞中PKCβI的蛋白表达水平

图4 肺血管中PKC βI的表达水平Fig.4 The PKCβI protein levels in pulmonary vasculars.
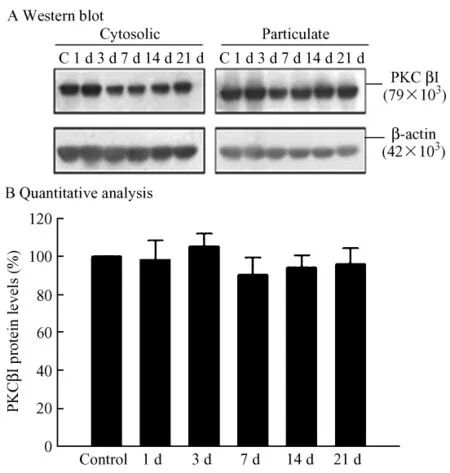
图5 肺血管中PKCβI的膜转位结果Fig.5 The results of PKC βI membrane translocation in pulmonary vasculars.
免疫组化的研究发现在慢性低氧14 d后PKCβI蛋白表达是下降的(彩插2图6B)。
3 讨论
肺动脉高压是最严重的具有潜在致命性的慢性肺循环疾病[1]。肺血管收缩和重塑都引起肺动脉高压形成。本实验结果表明:随着低氧暴露时间的延长,与正常对照组比较,低氧各组RVSP和RV/(LV+S)比值均明显增加,病理结果也显示肺动脉重塑,这些结果均提示肺动脉高压形成。肺动脉高压的发病机理目前还不是很清楚,但是,低氧是导致肺动脉高压的诱因之一。在低氧条件下,可以导致肺血管收缩和肺血管压力增加[10]。当低氧性肺动脉血管收缩持续存在时,血管细胞中的促增殖信号传导通路被激活,从而激活一系列增殖信号通路,导致了肺血管重塑,最终引起慢性低氧性肺动脉高压[11]。PKC属于丝/苏氨酸蛋白激酶家族,是一种重要的信号分子,在慢性低氧性肺动脉高压中起重要作用[12]。迄今为止,在哺乳动物中至少鉴定出10种PKC亚型,并根据它们的分子结构和对激活剂的敏感性分为3个亚组:经典型PKC(cPKCα、βI、βII和 γ),需要钙离子和 DAG 来激活;新奇型PKC(nPKCδ、ε、η 和 θ);和非典型性 PKC(aPKCλ/ι和 ζ)[13]。PKCs激活后可以发生移位,即从胞浆转移到胞膜、细胞骨架结构或细胞核内,称为膜转位或核转位,本实验中PKC亚型的激活通常以它们从胞浆成分转位到膜或膜相关成分上来衡量[14]。如膜或膜相关成分增多,说明PKC激活。LiaoDF等用免疫印迹方法发现在大鼠的主动脉血管平滑肌细胞中有 PKCβI的表达[15]。此外,在新生牛肺动脉外膜成纤维细胞和新生小牛肺动脉平滑肌细胞中都曾报道过有 PKCβI的表达[16]。与之相似,在我们的整体动物研究中应用免疫印迹和免疫组化的技术发现在大鼠肺动脉平滑肌细胞和成纤维细胞中均有 PKCβI的表达。
在体内研究中,低氧性肺动脉高压发生后肺动脉平滑肌细胞和成纤维细胞发生增殖反应[17]。PKC是一种重要的蛋白激酶,可以促进生长因子、激素和抗原等的细胞增殖反应。但是在体内模型中PKCβI是否参与了低氧诱导的肺血管重塑还不太清楚。尽管已有研究者报道低氧条件下经典型PKCβI是被激活的,但是,本研究却发现 PKCβI蛋白表达量的下调以及膜转位水平无变化。这些结果和以前在脑缺血和谷氨酸损伤的神经细胞原代培养中的结果是相似的[18]。本实验结果表明:PKCβI特异蛋白表达的下调可能和肺动脉平滑肌细胞增大的生长能力有关。
在本研究中我们还发现慢性低氧诱导的大鼠肺动脉高压的发生、发展与肺血管重塑结果不相一致,表明血管收缩也是导致肺动脉压增高的主要原因。PKC的激活参与了肺脏中肺泡低氧肺血管收缩反应的信号传导通路[19]。以往研究多认为 PKC的激活可以增强低氧条件下肺血管收缩,其机制可能是通过佛波酯导致PKC激活,从而使肺动脉中不依赖钙的血管平滑肌组织收缩。PKC通过磷酸化和激活 PKC赋予的肌球蛋白磷酸酶抑制剂(CPI-17)引起钙离子的敏化,进而抑制肌球蛋白轻链磷酸酯酶催化结构域。但是与激活相反,本实验发现在慢性低氧诱导的大鼠肺动脉高压中 PKCβI蛋白表达明显下降。Robertson等推测在持续性低氧诱导的肺动脉高压中观察到的钙敏感化是不依赖于大鼠肺动脉中 PKC的激活的[20],有着自己独立的激活路径。这些数据表明根据磷酸化不同的底物蛋白,这些PKC亚型可能有多种不同的功能,如细胞增殖和血管收缩。
总之,本研究系统地描述了慢性持续性常压低氧诱导的大鼠肺动脉高压整体动物模型样本中肺血管平滑肌细胞及成纤维细胞中PKCβI特异的膜转位和蛋白表达水平的变化情况。本实验的研究表明PKCβI蛋白表达的下调可能参与了慢性低氧诱导的大鼠肺动脉高压肺血管重塑的发生和发展过程。
[1]Hoette S,Jardim C,Souza RD.Diagnosis and treatment of pulmonary hypertension an update[J].Bras.Pneumol,2010,36(6):795-811.
[2]Nishizuka Y.Protein kinase C and lipid signaling for sustained cellular responses.[J].FASEB J,1995,9(7):484-496.
[3]Barman SA,Zhu S,White RE.Protein kinase C inhibits BKCa channel activity in pulmonary arterial smooth muscle[J].Am J Physiol Lung Cell Mol Physiol,2004,286(1):L149-L155.
[4]Dempsey EC,Das M,Frid MG,et al.Hypoxic growth of bovine pulmonary artery smooth muscle cells[J].Chest,1998,114:29S.
[5]Deten A,Millar H,Zimmer HG..Catheterization of pulmonary artery in rats with an ultraminiature catheter pressure transducer[J].Am J Physiol Heart Circ Physiol,2003,285(5):H2212-H2217.
[6]Christou H,Morita T,Hsieh CM,et al.Prevention of hypoxiainduced pulmonary hypertension by enhancement of endogenous heme oxygenase-1 in the rat[J].Circ Res,2000,86(12):1224-1229.
[7]Li J,Niu C,Han S,et al.Identification of protein kinase C isoforms involved in cerebral hypoxic preconditioning of mice[J].Brain Res,2005,1060(1-2):62-72.
[8]Wei Y,Wang N,Lu Q,et al.J.Enhanced protein expressions of sortilin and p75NTR in retina of rat following elevated intraocular pressure-induced retinal ischemia[J].Neurosci Lett,2007,429(2-3):169-174.
[9]Ding J,Ding N,Wang N,et al.Determination of conventional protein kinase C isoforms involved in high intraocular pressureinduced retinal ischemic preconditioning of rats[J].Vision Res,2009,49(3):315-321.
[10]Stenmark KR,Mecham RP.Cellular and molecular mechanisms of pulmonary vascular remodeling[J].Annu Rev Physiol,1997,59:89-144.
[11]Jeffery TK,Wanstall JC.Pulmonary vascular remodeling:a target for therapeutic intervention in pulmonary hypertension[J].Pharmacol Ther,2001,92(1):1-20.
[12]Littler CM,Wehling CA,Wick MJ,et al.Divergent contractile and structural responses of the murine PKC-epsilon null pulmonary circulation to chronic hypoxia[J].Am J Physiol Lung Cell Mol Physiol,2005,289(6):L1083-L1093.
[13]Barnett ME,Madgwick DK,Takemoto DJ.Protein kinase C as a stress sensor[J].Cell Signal,2007,19(9):1820-1829.
[14]Kurkinen K,Busto R,Goldsteins G,et al.Isoform-specific membrane translocation of protein kinase C afterischemic preconditioning[J].Neurochem Res,2001,26(10):1139-1144.
[15]Liao DF,Monia B,Dean N,et al.Protein kinase C-zeta mediates angiotensin II activation of ERK1/2 in vascular smooth muscle cells[J].J Biol Chem,1997,272(10):6146-6150.
[16]Das M,Stenmark KR,Ruff LJ,et al.Selected isozymes of PKC contribute to augmented growth of fet al and neonatal bovine PA adventitial fibroblasts[J].Am J Physiol,1997,273(6 Pt 1):L1276-L1284.
[17]Hayashida K,Fujita J,Miyake Y,et al.Bone marrow-derived cells contribute to pulmonary vascular remodeling in hypoxiainduced pulmonary hypertension.[J].Chest,2005,127(5):1793-1798.
[18]Chakravarthy BR,Wang J,Tremblay R,et al.Comparison of the changes in protein kinase C induced by glutamate in primary cortical neurons and by in vivo cerebral ischaemia[J].Cell Signal,1998,10(4):291-295.
[19]Weissmann N,Voswinckel R,Hardebusch T,et al.Evidence for a role of protein kinase C in hypoxic pulmonary vasoconstriction[J].Am J Physiol,1999,276(1 Pt 1):L90-L95.
[20]Robertson TP,Aaronson PI,Ward JP.Hypoxic vasoconstriction and intracellular Ca2+in pulmonary arteries:evidence for PKC-independent Ca2+sensitization[J].Am J Physiol,1995,268(1 Pt 2):H301-H307.
Determination of PKCβI Membrane Translocation and Protein Expression in Pulmonary Artery Smooth Muscle Cells and Fibroblasts of Rats with Chronic Hypoxia-induced Pulmonary Hypertension
CHENG Zhen-ling1,YU Wen-yan1,NIE Xin1,SHI Yi-wei2,DU Yong-cheng1
(1.Department of Respiratory Medicine,People's Hospitalof Shan Xi Medical University,Taiyuan 030001,China;2.Department of Respiratory Medicine,the First Hospital of Shan Xi Medical University,Taiyuan 030001,China)
Objective By observing the influence of PKCβI membrane translocation and protein expression level in pulmonary artery Smooth muscle cells and Fibroblasts of chronic hypoxia-induced rat pulmonary hypertension,discuss the function of PKCβI in process of chronic hypoxia-induced rat pulmonary hypertension preliminary.Methods Chronic atmospheric pressure hypoxic PH model rats were established.Male SD rats were randomLy divided into six groups,and exposed to normoxia control or to normoxia hypoxia for 1d,3d,7d,14d and 21d to induce pulmonary hypertension.Western blot and immunohistochemistry were used to detect the expression of PKCβI membrane translocation and protein expression level in pulmonary artery Smooth muscle cells and Fibroblasts of chronic hypoxia-induced rat pulmonary hypertension.Results(1)RVSP and RV/(LV+S)increased significantly than normal control groups(P <0.05),rats pulmonaryvascular obvious thickening after chronic hypoxia 3d,7d,14d and 21d.(2).PKCβI was expressed in rat pulmonary artery Smooth muscle cells and Fibroblasts,and its protein expressions decreased at 14d after chronic hypoxia than normal control groups(P < 0.05).Conclusions PKCβI protein expression is involved in the development of pulmonary vascular remodeling of chronic hypoxia-induced rat PH.
Protein kinase C βI(PKC βI);Chronic hypoxia;Pulmonary hypertension(PH);Membrane translocation;Protein expression
R332
A
1671-7856(2012)09-0026-05
10.3969.j.issn.1671.7856.2012.009.006
2012-08-25
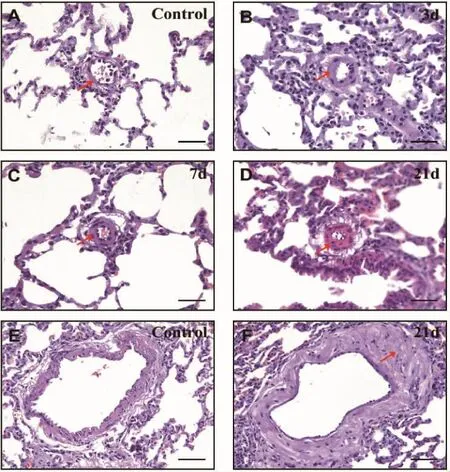
图2 大鼠HE染色病理学观察(缺血后2 d)
Fig.2 Histopathological changes of the brain tissue at 2 days post-occlusion (HE staining)
注:A:假手术组-CA1区 B:假手术组-CA3区 C:假手术组-皮层D:模型组-CA1区 E:模型组-CA3 F:模型组-皮层
Note: A: Sham group - CA1; B: Sham group - CA3; C: Sham group - cortex;D: pMCAO group - CA1; E: pMCAO group - CA3; F: pMCAO group - cortex

图6 肺血管PKC I的蛋白表达水平
Fig.6 The PKC I protein levels in pulmonary vasculars
注:图中红箭头所指为平滑肌细胞层,黑箭头所指为成纤维细胞层
Note: The red arroW for smooth muscle cells, The black arroW for fibroblasts
程振玲(1986-),硕士生,研究方向:低氧与肺动脉高压基础及临床研究。E-mail:zhenlingch@yahoo.com.cn。
杜永成(1955-),博士生导师。Email:hxkdyc@yahoo.com.cn。

