大鼠肢端缺血预处理对脑缺血后炎症反应的影响
于新迪,王震宇,丁 雷,莫 茜,朱德明,王 伟
(上海交通大学医学院附属上海儿童医学中心 心胸外科体外循环科 儿科转化医学研究所,上海 200127)
大鼠肢端缺血预处理对脑缺血后炎症反应的影响
于新迪,王震宇,丁 雷,莫 茜,朱德明,王 伟
(上海交通大学医学院附属上海儿童医学中心 心胸外科体外循环科 儿科转化医学研究所,上海 200127)
目的 通过观察肢端缺血预处理(limb ischemic preconditioning,LIP)对大鼠脑缺血性损伤后重要炎症因子表达的影响,探讨LIP诱导的脑缺血耐受与炎症反应之间的关系。方法 选取72只SD大鼠,实验组(LIP组)30只、缺血组30只和对照组12只。实验组和缺血组设立5个时间点:6 h、12 h、24 h、48 h和72 h,每点6只。通过线栓法建立大鼠大脑中动脉阻塞(middle cerebral artery occlusion,MCAO)的局灶性脑缺血模型及LIP法建立脑缺血耐受模型,采用HE观察每组大鼠的脑组织形态学改变、QRT-PCR和ELISA方法检测脑组织中炎症因子IL-17及IL-6的表达变化。结果 实验组脑组织学病理改变明显轻于缺血组。与缺血组相比:实验组的IL-17和IL-6的基因和蛋白表达在整体水平均呈下降趋势;mRNA水平提示实验组在缺血12 h、24 h和48 h后脑组织中IL-17、IL-6的表达量显著减少(P<0.01);蛋白水平提示实验组在缺血24 h和48 h后脑组织中的IL-6以及在缺血12 h、24 h和48 h后脑组织中IL-17的表达量均降低(P<0.05)。结论 LIP诱导脑缺血耐受,可以减轻脑缺血后的炎症反应,对缺血性脑损伤有一定的保护作用。
炎症反应;神经系统;脑损伤;肢端缺血预处理;缺血耐受
脑缺血损伤主要是由免疫系统介导的复杂的病理过程,其中炎症因子的分泌和炎性细胞的浸润在这一损伤过程中发挥极为重要的作用。缺血耐受(ischemic tolerance,IT)是指组织经过一次或多次短暂性缺血复灌后所诱导产生的内源性保护机制,能对以后较长时间的缺血损伤产生显著的耐受作用,在一定程度上减轻再次缺血所引起的损伤,该现象称为缺血预处理,其具体机制目前尚不明确[1]。IT的保护作用也存在于不同的器官之间,如肢体、小肠和肾脏等器官的缺血预处理也可对随后缺血的心、肝等器官产生保护作用[2],这种现象已经在心肌缺血损伤中得到了证实[3],但由于血脑屏障的存在,该方法是否对脑缺血性损伤有保护作用尚未被广泛证实。因此,本研究探讨肢端缺血预处理(limb ischemic preconditioning,LIP)和脑缺血损伤的关系,以了解LIP在脑损伤中能否发挥保护作用以及LIP对炎症反应的影响。
1 材料和方法
1.1 材料
1.1.1 实验动物:选用清洁级健康雄性 Sprague Dawley(SD)大鼠72只(体重200士20 g),由上海斯莱克实验动物有限责任公司提供。实验动物许可证号:SCXK(沪)2007-0005,使用许可证号:SYXK(沪)2003-0026。实验过程中对动物的处置符合实验动物伦理学标准。
1.1.2 实验试剂:Trizol(Invitrogen),RNA Later液(Ambion),逆转录试剂盒(A3500,Promega),PCR 试剂盒 (DRR041A,TAKARA),白细胞介素 17(interleukin-17,IL-17)ELISA 试剂盒(MRK0016),白细胞介素6(interleukin-6,IL-6)ELISA试剂盒(MRK0004),ProteaseInhibitorCocktail(P8340,Sigma Aldrich),DEPC(Sigma Aldrich),10% 水合氯醛[0.035mL/(kg体重)·次],10%中性福尔马林缓冲液。其他试剂均为国产分析纯。
1.1.3 仪器:A4级栓线(北京沙东生物有限公司),7000实时荧光定量 PCR仪(ABI,美国),高速冷冻离心机(德国),酶标仪,恒温箱,冷藏冷冻箱等。
1.2 方法
1.2.1 大脑中动脉阻塞(middle cerebral artery occlusion,MCAO)和 LIP模型
采用改良的 Longa[4]线栓法制备大鼠右侧MCAO模型,即分离大鼠右侧颈总动脉和颈内动脉,结扎颈总动脉近心端,同时用无菌线栓栓塞其颈内动脉约18mm。将动物分为实验组、缺血组和假手术对照组,实验组和缺血组均设立5个时间点:6 h、12 h、24 h、48 h和72 h,每个时间点6只。实验组采用LIP使肢体右侧股动脉缺血6 min/再灌注6 min 3个循环,24 h后建立MCAO模型。缺血组仅将右侧股动脉暴露相同时间,24 h后行MCAO。两组的假手术对照组仅暴露相同部位的解剖结构,但不进行颈部线栓或肢端股动脉夹闭,每组6只。对照组于术后即刻、实验组和缺血组于术后缺血对应时间点给予水合氯醛麻醉断颅取脑,用于苏木素-伊红(hematoxylin and eosin,H&E)染色、实时荧光定量PCR 技术(real-time quantitative PCR,QRT-PCR)和酶联免疫吸附法 (enzyme-linked immunosorbent assay,ELISA)检测主要炎症因子的表达。
1.2.2 HE染色
取实验组、缺血组和对照组脑组织的石蜡切片,丙酮固定1~2 min后蒸馏水洗,再逐次经过苏木素染色5~10 min,1%盐酸乙醇分化30s,5%淡氨水返蓝2 min,伊红乙醇浸染3 min,以上各步操作后均经过水洗。脱水透明封片后在光镜下观察脑组织的病理学改变。
1.2.3 QRT-PCR
按照Trizol试剂盒提供的方法提取每组脑组织细胞总 RNA,每个样品加入1mL Trizol后研磨,经氯仿、异丙醇和乙醇纯化后的 RNA用 DEPC水溶解。分别取1 uLRNA和随机引物,用反转录试剂盒(20 uL体系)反转录成 cDNA。取2 uL cDNA用SYBR GREEN PCR试剂盒(50 uL体系),按照两步法PCR扩增标准程序在ABI prism 7000 Sequence Detection System上扩增,首先50℃反应10 s;阶段1是预变性阶段,95℃反应30 s,1个循环;阶段2是PCR 反应阶段,95℃ 反应5 s,然后60℃ 反应31 s,重复40个循环。引物按照Genebank所提供的基因序列采用Primer-5程序设计引物后由上海生工公司合成:

得到的 CT 值通过 2-ΔΔCT公式计算不同组中 IL-17和 IL-6的相对表达量。
1.2.4 ELISA
所有脑组织经匀浆后离心取上清按照ELISA试剂盒的说明书进行操作。利用标准品建立 IL-17和IL-6的标准曲线,酶标板中加入待测样品后在37℃孵育120 min;对应的加第一抗体工作液后在37℃孵育60 min;加酶标抗体工作液后在37℃孵育30 min;以上各步操作后酶标板均经过充分洗涤6次。加底物工作液后37℃暗处孵育15 min;加终止液后30 min内用酶标仪在450 nm处测量吸光值。
1.2.5 统计学分析
采用SPSS(13.0版)统计软件包进行统计学分析。所有数据均用均数士标准差(±s)的形式表示。计量资料的组间统计学差异采用独立样本t检验。P<0.05为具有显著性差异,P<0.01为具有非常显著性差异。
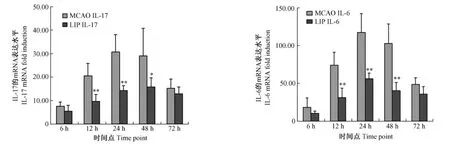
图2 缺血组和实验组不同时间点脑组织中IL-17和IL-6 mRNA的表达水平(±s)Fig.2 IL-17 and IL-6 mRNA expressions of the cortex in ischemic group and experimental group after ischemia at different time points(±s)
2 结果
2.1 病理学改变
肉眼观察缺血组大鼠缺血侧脑半球明显肿胀,实验组较缺血组肿胀程度略有减轻,对照组脑组织形态均正常。光镜下观察HE染色的脑组织切片,对照组均未见明显病理改变(彩插1图1A,G)。缺血组梗死灶位于右侧额顶背外侧皮质和纹状体等区域,呈片状分布,病理改变最明显:缺血组在缺血6 h及12 h后,可见皮层和基底核外侧区脑组织呈现明显水肿、血管周围腔隙增宽(彩插1图1B,C);缺血24 h及48 h后可见皮质和基底核区液化坏死灶和液化空泡增多、组织间隙严重水肿,同时伴有大量炎性细胞浸润、神经细胞数量明显减少(彩插1图1D,E);缺血72 h后可见海马区损伤严重,神经细胞丧失正常结构、呈现细胞脱失、层次减少等表型(彩插1图1F)。相比,实验组在相应时间点较缺血组脑实质内的坏死灶数量有下降趋势,梗死灶周围固缩浓染的细胞数量明显减少,间隙水肿程度也明显减轻(彩插1图1H-L),提示LIP预处理可以明显减轻缺血引起的脑组织损伤。
2.2 QRT-PCR检测不同时间点缺血组、实验组脑组织中炎症因子的表达
从图2看出实验组和缺血组相比,IL-17和IL-6的整体水平呈下降趋势。实验组中12 h、24 h和48 h脑组织中 IL-17的表达明显低于缺血组(P<0.05),其中 12 h和 24 h中 IL-17的降低更明显。实验组中12 h、24 h和48 h脑组织中IL-6的表达显著低于缺血组(P <0.01)。而 IL-17、IL-6 在 6 h 和72 h点均无统计学差异(P>0.05)。
2.3 ELISA检测不同时间点缺血组、实验组脑组织炎症因子的表达
从图3看出缺血组和实验组的 IL-17和 IL-6的表达量在12 h、24 h、48 h和72 h均明显高于对照组。实验组和缺血组相比,IL-17和 IL-6的表达在整体水平都有所降低。实验组中IL-17的表达量在12 h、24 h和 48 h明显低于缺血组(P<0.05),而IL-6的表达量仅在24h和48h显著低于缺血组(P<0.05)。
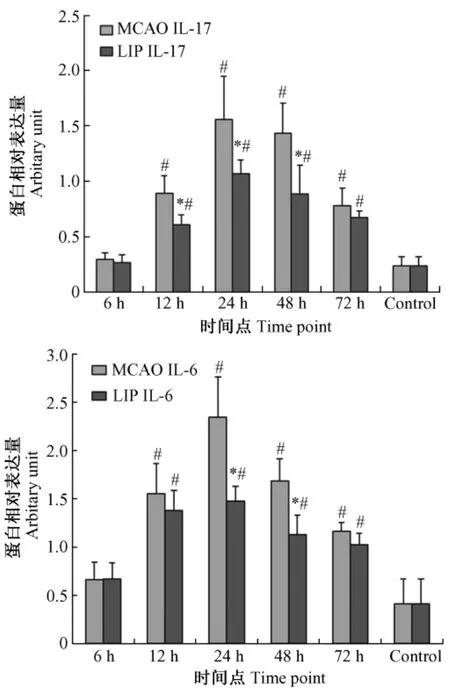
图3 对照组、缺血组和实验组不同时间点脑组织中IL-17和IL-6蛋白的表达水平(±s)Fig.3 IL-17 and IL-6 protein levels of the cortex in control group,ischemic group and experimental group after ischemia at different time points(±s)
3 讨论
缺血性脑损伤是神经系统常见病和多发病,其致残率和致死率均较高[5],引起众多学者的关注以寻求治疗的新方法。1990年 Kitagawa[6]等发现全脑一次短暂缺血即缺血预处理并未引起明显的脑神经损伤,且对再次致死性缺血损伤产生了明显的保护作用,这种保护作用即为 IT,这一现象立即引起了广泛关注。随着研究的进展,发现通过其它方法如:轻度低氧[7]、低温、高压氧和肢端缺血等也可以诱导脑IT,虽其确切机制仍不清楚,但炎症、细胞因子及凋亡的上调被认为在缺血导致的脑损伤中起重要作用[8],目前推测非致死性预处理诱导的脑缺血耐受通过减轻上述反应而减少损伤,然而缺血预处理对某些细胞因子表达的具体效应尚不清楚。因此,本实验将在LIP模型上研究缺血预处理对脑缺血后炎症反应的影响。
IL-17作为一种新近发现的致炎性细胞因子,能够诱导多种细胞分泌IL-6、IL-8、单核细胞趋化蛋白-1和细胞间黏附分子1等炎性介质[9]。IL-6是一种多效的细胞因子,是全身炎症反应和免疫反应的重要调节因子。几乎所有的自身免疫性疾病、炎性疾病、外伤和肿瘤的发生发展过程中,都有 IL-6和IL-17的参与[10-12]。而星形胶质细胞是中枢损伤和炎症情况下中枢神经系统最主要的 IL-6的来源,IL-6不仅可以促进Th17的分化,还是IL-17重要的靶基因之一,且星形胶质细胞内也存在IL-6正反馈调控通路[13]。现在越来越多的研究报道了IL-17在脑组织中的表达,提示 IL-17可能在脑缺血的发生发展过程中发挥某种作用。有结果表明在动物MCAO模型中,IL-17在脑缺血后1h就轻度增高,在缺血后第 6 d 达高峰[14]。Li等[15]采用原位杂交和免疫组化方法检测大鼠脑缺血后 IL-17在脑中的表达,发现IL-17在脑缺血后脑内表达从第1h到第6天逐渐增加,同时伴T细胞浸润,并且与脑损伤面积呈正相关,表明IL-17和 T细胞参与脑损伤过程。本实验中缺血组结果与上述结果相似,表明 IL-17在缺血后6h即有表达,随着缺血时间的延长至24h逐渐增多,尤其是在12 h至24 h表达增多的更明显,随后逐渐降低;IL-6表达的规律与IL-17基本相似,证实了IL-17及IL-6参与大鼠脑组织缺血后的损伤过程,介导相关的炎症连锁反应。
本研究发现LIP能够诱导脑组织 IT,从而减轻脑部的炎症反应,而IT对其后脑缺血起到明显的保护作用也许与IL-17和IL-6的表达减少有关。因此本实验采用QRT-PCR和ELISA两种方法从基因和蛋白层面来检测 IL-17及 IL-6表达量的变化。mRNA水平显示 IL-17及 IL-6的表达均随缺血时间的延长而增多,在24h达到高峰后逐渐降低,而IL-6的增多更加显著;实验组和缺血组与对照组相比IL-17及 IL-6的表达量均增加;实验组与缺血组相比IL-17 及 IL-6 在 12 h、24 h 和 48 h 的表达量均明显减少。蛋白水平表明实验组与缺血组相比,IL-17在缺血后12 h、24 h和48 h的表达量有所减少且差异具有显著性,而IL-6蛋白表达的减少在缺血后24 h和48 h更为明显。本实验缺血后 IL-17和 IL-6的表达均有不同程度的增加,提示炎症因子表达的增多加重神经系统的损害,从而加重缺血局部的炎症反应。LIP后IL-17及IL-6的表达有所减少,提示缺血耐受激活了内源性保护机制使IL-17以及其诱导的其他因子如 IL-6的表达相应减少,从而使 IL-6等对脑组织的损伤作用减轻,也表明 IL-17参与脑缺血损伤的同时也通过改变其他因素间接发挥了生物学效应。
总之,本研究证实了LIP能够诱导脑组织产生IT,通过减轻炎症反应介导的脑损伤程度从而对脑缺血有保护作用。脑 IT使 IL-17及 IL-6的表达均减少,提示IL-17及 IL-6可能在缺血性脑损伤中发挥重要作用。因此,寻找新方法抑制 IL-17的表达或阻断信号通路控制 IL-17的表达,减少其诱导的其他因子如IL-6从而达到减轻缺血后脑损伤的目的,可能会成为理论研究的新方向。
[1]Takaaki Kirino.Ischemic tolerance[J].Journal of cerebral blood flow metabolism,2002,22:1283-1296.
[2]Kharbanda RK,Mortensen UM,White PA,et al.Transient limb ischemia induces remote ischemic preconditioning in vivo[J].Circulation,2002,106(23):2881-2883.
[3]Przykenk K,Bauer B,Ovize M,et al.Regional ischemic“preconditioning” protects remote virgin myocardium from subsequent sustained coronary occlusion[J].Circulation,1993,87(3):893-899.
[4]Longa EZ,Weinstein PR,Carlson S,et al.Reversible middle cerebral artery occlusion without craniectomy in rats[J].Stroke,1989,20(1):84-91.
[5]Bowen KK,Naylor M,Vemuganti R.Prevention of inflammation is a mechanism of preconditioning-induced neuroprotection against focal cerebral ischemia[J].Neurochem Int,2006,49(2):127-135.
[6]Kitagawa K,Matsumoto M,Tagaya M,et al.Ischemic tolerance'phenomenon found in the brain[J].Brain Res,1990,528(1):21-24.
[7]Miller BA,Perez RS,Shah AR,et al.Cerebral protection by hypoxic pro-conditioning in a murine model of focal ischemiareperfusion[J].Neuroreport,2001,12(8):1663-1669.
[8]van Exel E,Gussekloo J,de Craen AJ,et al.Inflammation and stroke:the leiden 85-Plus study[J].Stroke,2002,33(4):1135-1138.
[9]Takashi Inozume, Ken-ichi Hanada, Qiong J, et al.IL-17 secreted by tumor reactive T cells induces IL-8 release by human renal cancer cells[J].J Immunother,2009,32(2):109-117.
[10]Yamaguch iY,Fujio K,Shoda H,et al.IL-17B and IL-17C are associated with TNF-alpha production and contribute to the exacerbation of in flammatory arthritis[J].Immuno,2007,179(10):7128-7136.
[11]Swaidani S,Bulek K,Kang Z,et al.The critical role of epithelial-deprived Act1 in IL-17 and IL-25 mediated pulmonary inflammation[J].Immuno,2009,182(3):1631-1640.
[12]Inozume T,Hanada K,Wang QJ,et al.IL-17 secreted by tumor reactive T cells induces IL-8 release by human renal cancer cells[J].Immunother,2009,32(2):109-117.
[13]Ma X,Reynolds SL,Baker BJ,et al.IL-17 enhancement of the IL-6 signaling cascade in astrocytes[J].J Immunol,2010,184(9):4898-906.
[14]Li HL,Kostulas N,Huang YM,et al.IL-17 and IFN-gamma mRNA expression is increased in the brain and systemically after permanent middle cerebral artery occlusion in the rat[J].J Neuroimmunol,2001,116(1):5-14.
[15]Li GZ,Zhong D,Yang LM,et al.Expression of interleukin-17 in ischemic brain tissue[J].Scand J Immunol,2005,62(5):481-486.
The Effects of Limb Ischemic Preconditioning Pretreatment on the Inflammatory Response Induced by Cerebral Ischemia in Rats
YU Xin-di,WANG Zhen-yu,DING Lei,MO Xi,ZHU De-ming,WANG Wei
(Department of Thoracic and Cardiovascular Surgery,Shanghai Children's Medical Center,Shanghai Jiao Tong University,School of Medicine,Shanghai 200127,China)
Objective To investigate whether limb ischemic preconditioning(LIP)pretreatment has protective effects to the brain after cerebral ischemic injury by investigating the effects of LIP pretreatment on anti-inflammatory response in rats.Methods Seventy-two Sprague Dawley rats were divided into 3 groups:experimental group(n=30),ischemic group(n=30)and control group(n=12).Six samples from five timepoints(6 h,12 h,24 h,48 h and 72 h after surgical manipulation)were collected for the experimental and ischemic groups,while other twelve animals were untreated and used as controls.The models with middle cerebral artery occlusion(MCAO)were obtained by thread blocking and the models with cerebral ischemic tolerance(IT)were obtained by LIP pretreatment.The determination of histopathological changes,real-time quantitative PCR(QTR-PCR)and enzyme-linked immunosorbent assay(ELISA)were used to observe the expression of interleukin-17(IL-17)and interleukin-6(IL-6).Results The pathological change in experimental group was not as obvious as ischemia group.The results of QRT-PCR demonstrated that the expression of IL-17 and IL-6 were reduced significantly in experimental group.Significant different in the expression of IL-17 and IL-6 were found between ischemia and experimental groups at 12 h、24 h and 48 h time points(P < 0.01).The data of ELISA suggested that the expression of IL-17 and IL-6 were reduced obviously in experimental group.Significant different in the expression of IL-17 were found between ischemia and experimental groups at 12 h、24 h and 48h time points(P < 0.05),while significant different in the expression of IL-6 were at 24 h and 48 h time points(P < 0.05).Conclusion LIP pretreatment could induce ischemic tolerance,probably by providing obviously anti-inflammatory effects and protective function for the followed ischemic injury.
Inflammatory response;Cerebral injury;Limb ischemic preconditioning;Ischemic tolerance
R332
A
1671-7856(2012)09-0008-05
10.3969.j.issn.1671.7856.2012.001.002
2012-07-25
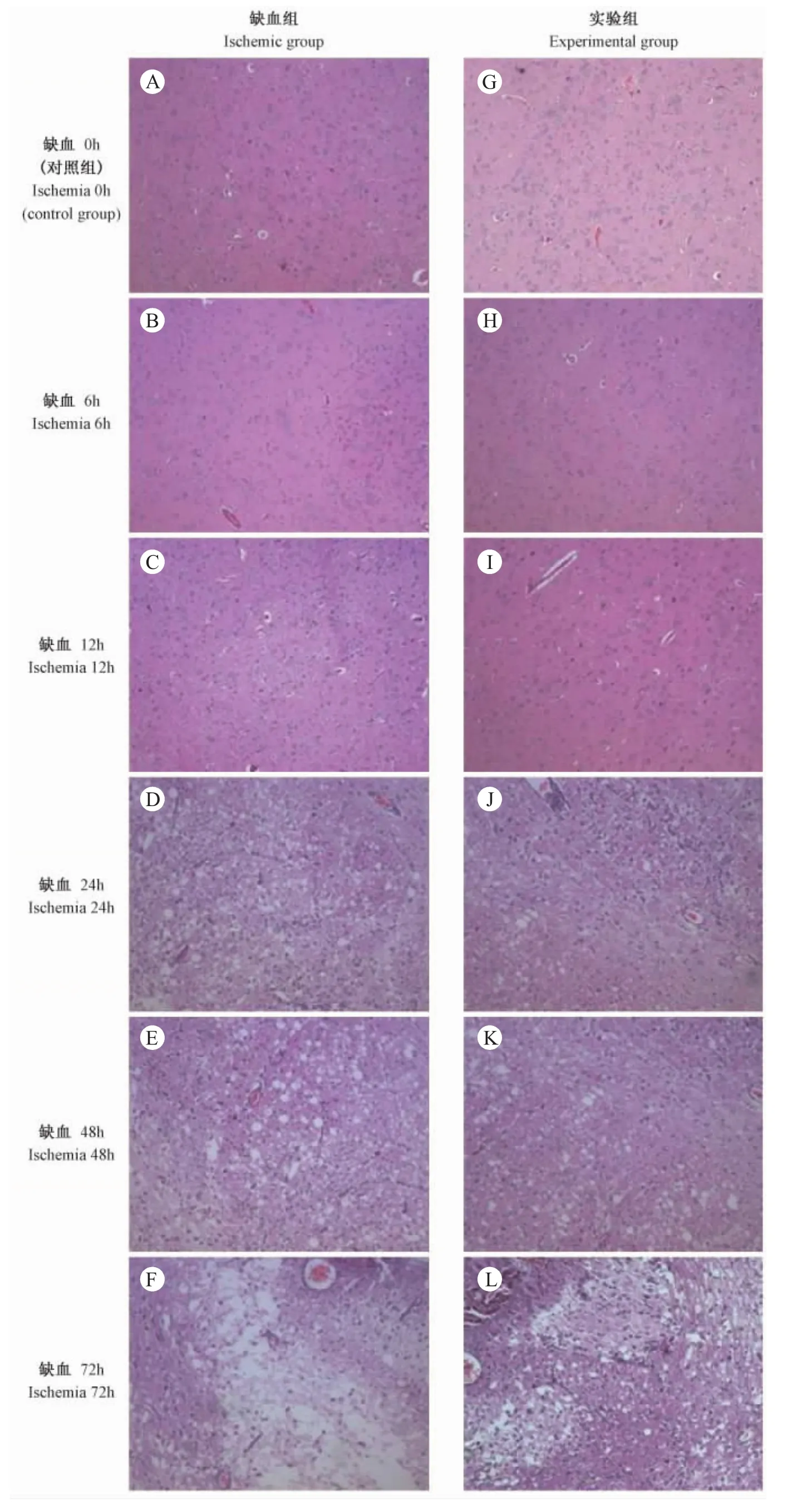
图1 缺血组和实验组不同时间点的脑组织切片HE染色(×100)
Fig.1 HE staining of brain tissues from ischemic group and experimental group after ischemia at different time points (×100)
上海市科委项目资助(09411965200)。
于新迪,女(1985-),住院医师,研究生,研究方向:先心病围术期脏器功能的保护。
王伟,Email:wangweicpb@gmail.com。

