过敏性哮喘动物模型在致敏、哮喘发作和气道高反应性等方面的应用研究
张星东
(卫生部人类疾病比较医学重点实验室,国家中医药管理局人类疾病动物模型三级实验室,中国医学科学院医学实验动物研究所,北京协和医学院比较医学中心,北京 100021)
过敏性哮喘动物模型在致敏、哮喘发作和气道高反应性等方面的应用研究
张星东
(卫生部人类疾病比较医学重点实验室,国家中医药管理局人类疾病动物模型三级实验室,中国医学科学院医学实验动物研究所,北京协和医学院比较医学中心,北京 100021)
过敏性哮喘的发病率呈上升趋势。使用了几十年的主要治疗药物肾上腺糖皮质激素副作用较大,因此发现好的预防和治疗方法成为迫切要解决的问题。动物模型是研究人类疾病的重要手段,但不少疑难病的发病机理不明确,因而制备的动物模型和人类疾病的相似度有差异。但Ⅰ型变态反应作为过敏性哮喘的发病机理是比较明确的,据此制备的动物模型和人类的哮喘就有很高的相近度,结果的可信度就较高。本文回顾了哮喘动物模型制备的基本方法和某些重要的细节。着重讨论了当今最常用的气道高反应性模型的优劣。如果综合运用不同特点的模型尤其是能观察记录哮喘发作全过程包括速发和迟发反应的模型,将可以更直接地探索哮喘发病过程和治疗药物。对气道重塑及基因敲除和转基因技术在动物模型中的研究和使用也做了一般性论述。动物模型将是一个有力的工具为最后有效地预防和治疗过敏性哮喘找到突破口。
模型,动物;过敏;变态反应;哮喘;致敏;气道激发;气道高反应性
过敏性哮喘是国际范围内的重要疾病之一,给患者的生活造成了极大的影响。发病率呈上升的趋势。根据联合国世界卫生组织的估算,世界范围内哮喘患者达三亿之多,很少有这样一种病以这样高的发病率发生在各个国家,波及到各个层次包括不同年龄或不同经济状况的人群中,缺乏理想的治疗手段[1]。几十年来肾上腺糖皮质激素仍然是比较有效的治疗和预防过敏性哮喘发作的药物,但其较大的副作用同时也限制了临床的应用。因此深入研究发病过程发现有效的预防和治疗方法成为当今要迫切解决的问题。
动物模型可以对于人类自身疾病的研究提供很有益的帮助。遗憾的是很多重要的疑难病如原发性高血压、红斑性狼疮等,因为病因和发病机制不甚明了,因此这类动物模型和人类同名疾病在多大程度上相类似是不清楚的。幸运的是,与很多其他一些疑难病相比,过敏性哮喘的病因和发病机制相对清楚,即外部抗原进入机体后引起的I型变态反应。因此,根据外来抗原进入机体导致I型变态反应这个基本原理而制备的动物模型可能更贴近人类的过敏性哮喘,也就更有可能去认识该病的发病机制。近二、三十年的研究也正是主要借助动物模型在发病的细节方面对该病了解的更深入了,取得了很多的进展,使我们对该病的认识大大提高了。我们知道了特异性IgE的产生是Th2途径,细胞因子,转录因子。本文拟根据该病的基本发生过程来综述和探讨目前利用动物模型研究过敏性哮喘的历史、现状和展望。
致敏过程 (sensitization)
致敏即将抗原采用某种方式导入体内,机体的免疫系统经过一系列反应和处理,最后由B淋巴细胞产生针对此种抗原的特异性抗体并结合到肥大细胞、嗜碱性粒细胞表面受体的过程。
抗原是多种多样的,理论上说凡是可以导致过敏性哮喘的蛋白或小分子化合物半抗原等都可用于动物模型研究。除了实验中最常用的卵蛋白(ovalbumin),其他可能接触到的如生活环境中花粉、尘螨、霉菌、动物皮屑;生产环境中的粮食、化工产品如有机酸酐、异氰酸酯类化合物、农药、蛋白酶、动物皮屑及排泄物、乳胶等,都可用来进行实验研究[2,3,4]。
抗原导入体内的方式可以是注射,也可以是气道吸入。某些抗原也可经皮肤接触而进入体内。免疫佐剂(adjuvant)的使用是为了非特异地刺激免疫系统以增加特异性抗体的产生,但佐剂并不是抗原在致敏动物时必需要用的。
(1)蛋白类抗原
例如卵蛋白的使用方法目前最常用的是腹腔注射,也可以雾化吸入。因为蛋白是全抗原,比较容易致敏。
(2)半抗原
半抗原用于致敏动物时是需要掌握基本技术和基础知识的。半抗原一般为小分子化合物,自身不能被免疫系统识别来启动致敏过程。以有机酸酐为例,这是一组化合物包括邻苯二甲酸酐(phthalic anhydride,简称苯酐或 PA)、偏苯三酸酐(trimellitic anhydride,简称 TMA)、六氢邻苯二甲酸酐(cis-hexahydrophthalic anhydride)等,基本结构是由6碳环和两个羧基去掉一个水分子形成,是化工生产中重要的原料。工作人员在生产环境中反复接触了某种酸酐后可能出现哮喘发病,引起国际上中、美、英、德、意、日等国家的重视。近年的研究基本认定酸酐是作为半抗原进入机体产生特异性IgE而引起哮喘,属于I型变态反应。在探讨酸酐哮喘的发病机制过程中,大量使用了动物模型,为我们提供了很多有益的启示。
抗原是经过何种途径进入机体的?通常认为,比较有可能的是经呼吸道吸入后和免疫系统接触。是否有其他可能例如皮肤粘膜也作为一种途径将抗原导入体内?研究人员在给动物用抗原致敏的时候,一方面是不管抗原天然进入体内的方式,一律采取注射的方式将抗原导入体内,另一种方式是意图模拟自然条件下抗原进入机体的方式来制备动物模型进而为预防抗原进入机体内引起致敏的发生提供预防措施。
利用吸入的方法制备动物模型:早期的学者是给豚鼠吸入半抗原(异氰酸酯类),致敏成功即测出特异性抗体后,用全抗原即结合了蛋白形成复合物的溶液雾化吸入来激发哮喘[5]。但也有学者用酸酐气溶胶干粉(TMA)给豚鼠吸入,致敏成功测出了抗体,但没能用全抗原成功激发出哮喘[6]。近年的研究证实,用TMA半抗原气溶胶干粉给挪威褐鼠吸入致敏成功,然后仍用同样的TMA半抗原气溶胶给动物吸入激发也成功地导致了哮喘发作[7]。
利用非吸入的方法制备动物模型:早期(廿世纪七、八十年代)研究人员在用酸酐致敏动物时是将酸酐加入蛋白溶液中反应形成酸酐蛋白结合物(conjugate),即得到酸酐的全抗原,然后给动物注射,动物产生了特异的 IgE,致敏成功[8]。但这和人在生产环境中接触酸酐的方式是不同的,人接触的是半抗原形式的酸酐,进入体内以后和体内的蛋白结合形成全抗原。
到上世纪80年代末90年代,研究人员发现用多种有机酸酐以半抗原的形式和植物油或液体石蜡配制成悬浮液给豚鼠或挪威褐鼠皮内注射也可产生特异的抗体使动物致敏并激发哮喘[9-12]。这个方法的成功使得研究人员知道仅仅用半抗原也是可以用注射的方式使动物致敏的。说明半抗原在皮肤内与机体的某种蛋白结合形成了全抗原。研究还发现皮下注射的效果不如皮内注射,皮内注射可以产生更高滴度的特异性抗体。这种差异的产生推测是因为皮下含有更多的脂肪,而皮内含有更多比例的蛋白,血液循环丰富,淋巴管盲端的开口也位于皮内,这些条件利于半抗原和蛋白结合并经血液和淋巴管运输和免疫细胞接触产生反应。
在上述工作的基础上,研究人员 Zhang,Siegel等试验将有机酸酐TMA的干粉直接放置在麻醉的挪威褐鼠的背部皮肤上,4 h后用水洗掉。这种非创伤性的实验方法也获得成功,动物产生的抗体滴度和背部皮肤使用的抗原 TMA剂量正相关[13]。致敏的动物用TMA干粉吸入激发出现了哮喘发作[14]。这个研究的成功说明抗原进入机体不仅仅限于呼吸道的吸入,即使正常完整的皮肤也可被某些抗原穿过进入体内产生致敏进而在吸入抗原时发生哮喘。这个研究的意义是重大的,给生产者、医务人员和政府决策部门提供了这样的信息:预防哮喘尤其是职业相关的哮喘甚至其他和化合物接触所患疾病的防护政策时,仅仅呼吸道的防护是不够的,皮肤粘膜等的全身性防护也是必要的。
通过模拟实际生活中人自然接触半抗原而致敏的方式,即吸入或皮肤直接接触有机酸酐半抗原致敏动物并成功用半抗原激发动物产生哮喘,都说明半抗原进入机体后可自行与体内的蛋白结合形成全抗原而启动致敏过程。需要指出的是,酸酐遇水形成酸则不能和蛋白结合而失去过敏原的效能[13,15]。因此体外配制酸酐类半抗原试剂只能用不含水的液体如油或液体石蜡,若配置全抗原试剂必须用事先溶有蛋白的水溶液,不可以先将酸酐加入水中以后再加蛋白。
致敏过程是哮喘发生前期的一个很重要的步骤。对抗原种类和性能的了解,对于致敏过程形成机制的研究,有助于预防致敏的发生,对哮喘的预防可起到未雨绸缪的作用。自然条件下抗原进入机体后并不是所有的人都会出现Th2型免疫反应。正常情况下,呼吸道粘膜中的树突细胞负责调控对吸入的抗原的反应,通过调节性(regulatory)T细胞抑制Th2型记忆淋巴细胞的激活,从而终止特异性IgE的合成,这种免疫耐受是一种对外来抗原入侵的保护性免疫[16]。如果能从动物模型的角度研究这种保护性免疫现象的机制,就会对哮喘的预防从致敏的层次水平加以阻断。目前治疗哮喘的思路主要集中在哮喘发生后的药物控制和脱敏,从致敏阶段着手研究也是很有意义的途径。
特异性气道激发(airway challenge)
也称支气管激发试验(bronchial provocation test-BPT),即给抗原致敏的动物再吸入同样抗原模拟或展示哮喘发作的过程。哮喘发作主要表现在气道阻力的增加。因此在观测动物的哮喘发作时除了观察症状,更重要的是记录气道阻力的变化。经典的较常用的测量气道阻力的一种方法是应用或部分应用吸气末阻断法(end-inspiratory airway occlusion method)来进行的[17-19]。基本原理是将动物深度麻醉使之失去自主呼吸而经气管插管由呼吸机代替。气道平滑肌中有肺牵张反射的感受器,在吸气末阻断气流,使气道压维持在平台压从而抑制肺牵张反射,这样测出的压力反映了呼吸系统弹性回缩压,测定的数值直接而准确,被用于哮喘发作的研究[20,21]。Johnson等也建立了一套气流阻断技术(flow-interruption technique)即用吸气末和呼气末阻断测量的数据来测定气道阻力的方法[22,23]。这类方法均由于动物处于深度麻醉状态,各种正常的生理反应发生变化,一般在气道激发后只能观察较短的时间,例如用于观察哮喘的速发反应 (图1)。
上述方法如果要连续观察数小时、十几小时甚至更长时间的哮喘发作的整个自然过程包括速发和迟发反应直至消退,进而研究发病机制和对药物的治疗反应就不是理想的方法了。
临床上一般出于诊断的目的对某些患者也要在有急救准备的条件下吸入特异性抗原做支气管激发试验,在清醒状态下定期测定肺功能24h后分析发现人类经典的哮喘发作包括速发(early-phase airway response-EAR)和迟发(late-phaseairway response-LAR)双相反应(biphasic asthmatic response)。速发反应在吸入抗原后数分钟内出现,约一个小时内消退。再过一个小时之后渐渐出现迟发反应,一般可以持续数小时、十几小时甚至更长[24-26]。
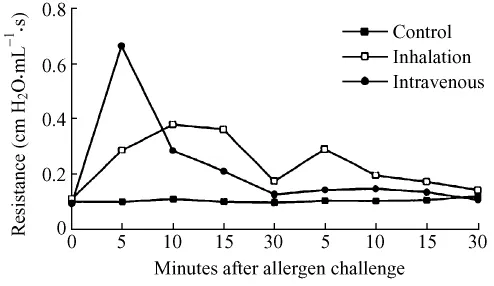
图1 用气道阻力指标观察豚鼠哮喘发作速发反应阶段。横坐标为时间(min),纵坐标为气道阻力的数值。
据此,能够制备成像人类这样出现速发和迟发双向哮喘反应的动物模型是评定模型质量的重要指标。推测某些动物也会像人那样在哮喘发作后出现双相反应,关键是如何连续动态地记录下来。深度麻醉的动物反应性不好,也不适合进行数小时甚至更长的连续实验,一般只是在激发后记录1小时以内的数据,相当于哮喘发作的速发阶段。有学者用大动物羊在头部仰位固定、局部麻醉下将球囊导管(balloon catheter)经鼻孔置放在食道下端,经另一个鼻孔将带管头的气管内导管(cuffed endotracheal tube)插入气管。这样通过跨肺压和气流即可计算直接得到气道阻力并记录到了迟发反应[27]。从文献记录的情况看,实验人员在激发后每隔一小时记一次数据,可以记录24 h以上。动物处于强制体位,故而推测是每次记录完毕需要将食道和气管里的导管取出,给羊解除固定,令动物休息进食等。然后再次固定、局麻、插管。这种方法有其优点,但也有缺点例如每隔一小时记录一次可能会错过很多有用的数据;同时操作复杂;动物较大,因此样本的数量受限制。
1997年,Hamelmann等报告了一种新的气压全身体积描记法(whole body plethysmography)用于记录实验动物小鼠呼吸道反应[28]。和此前经典方法不同的是动物一直处于清醒状态,无创伤性操作,动物在透明有机玻璃制成的容器内,有进出空气的管道,可随意进食饮水。经传感器测量气压的变化来计算得出间接反映气道阻力变化的数据称为enhanced pause(Penh)。经比较,Penh的增加和经典方法得来的气道阻力增加有很好的相关性。由于这种方法可以长时间动态、连续记录,为研究观察哮喘发作速发和迟发全过程提供了可能。
2004年,Zhang等首次发表了用上述全身体积描记法成功记录到了哮喘速发和迟发全过程的报告(图2)。该实验所用动物为大鼠,用偏苯酸酐经皮肤直接接触致敏,直接吸入该酸酐的干粉激发10 min后每30 s录一次数据,观察到动物立即出现哮喘速发反应,持续约数分钟至数十分钟,一小时内消退。约两小时后渐渐出现迟发反应,达到峰值后再渐渐消退。迟发反应相时间较长,从3、4h到十几小时不等,反映气道阻力的Penh的峰值也较速发反应相的峰值更高。同时发现哮喘是否发作、是仅仅出现速发相还是速发相迟发相都出现是和激发哮喘时所用的抗原浓度有关的[14]。
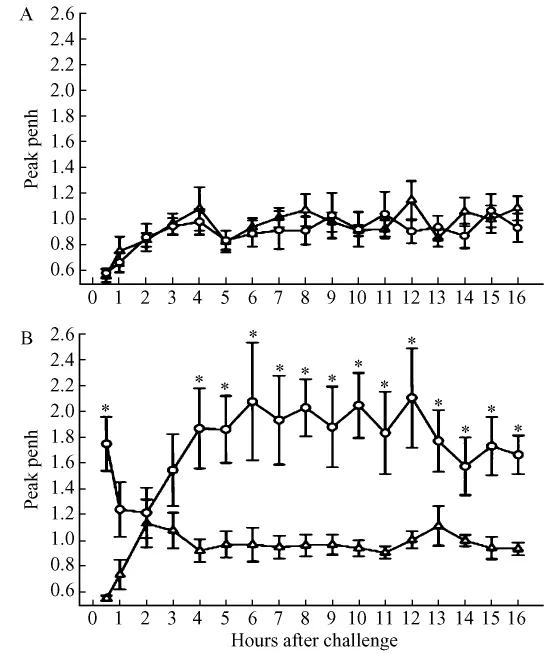
图2 用Penh指标观察挪威褐鼠哮喘发作速发和迟发反应全过程。圆形为致敏组,三角形为非致敏组。
气道高反应性(airway hyperresponsiveness)
即非特异性气道激发试验得出的结果。近30年来,研究发现过敏性哮喘在发作之后气道在形态和功能上仍没有恢复正常,表现为一种炎症过程,因此就有了一种较普遍的认识即把哮喘看成一种慢性炎症性疾病。对这种炎症进行的气道敏感性试验或者说是非特异性的气道激发试验,如果阳性,就称其为气道高反应性,炎症经治疗后高反应性也随之降低[29,30]。这被认为是诊断哮喘的重要指标,是哮喘研究历史上一种里程碑性的进步[31]。气道高反应性发生的机制还不是很清楚[29]。检验这种高反应性的方法目前最多用的是乙酰胆碱试验(methocholine test),广泛用于人,也在动物模型上用的很多。基本原理就是用不同浓度的乙酰甲胆碱吸入后观察气道的反应。如果某一浓度对正常气道没有作用,但却可以使已经有了炎症的气道出现反应(阻力增加),这就是气道高反应性试验阳性。气道高反应性的出现实质上被认为仅仅代表气道有炎症,不是过敏性哮喘特有的,阳性虽有助于诊断哮喘但不能确定一定是哮喘;阴性也不能排除哮喘[32,33]。也不能用此试验取代对哮喘迟发反应相的观察,后者是哮喘发作的一个特有的过程。气道高反应很重要是因为很多哮喘患者都呈阳性,但只有参考意义,要正确认识哮喘和炎症的关系,避免把哮喘等同于炎症而使研究偏离方向。目前在研究领域小鼠模型是用的较多的,而且很多是用小鼠做乙酰胆碱试验来验证药物作用或某些靶点阻断后的效果,研究者应该明确这是在观察对炎症的影响,可能和哮喘本身有关,也可能无关。
气道重塑(airway remodeling)
也称气道重构或气道重建,过敏性哮喘从临床的角度看是一种以发作性、可逆性支气管痉挛为特征的疾病。从病理学的角度看,是粘膜层和粘膜下层的炎症性变化。上皮细胞剥离,支气管粘膜水肿,上皮层中的杯状细胞肥大增生,粘液腺增生,平滑肌细胞肥大、增生。内有嗜酸性粒细胞、单核细胞、淋巴细胞和浆细胞浸润。针对这种炎症,机体在自身修复的过程中发生了气道的重新构建,其本身是一种机体的自我保护机制。但重塑可能出现三种变化又影响了正常的肺功能:气道弹性降低、平滑肌细胞的肥大增生使得哮喘发作平滑肌收缩更加重了气道狭窄以及胶原在基底膜下的沉积导致的气道壁增厚[34,35]。早期糖皮质激素抗炎治疗可能有助于防止再构建,而支气管扩张剂类的药物对重组的效果还没有定论[34]。目前对于气道重塑的理解很多是过去十几年通过动物模型实现的。例如实验中发现在成年动物即使抗原刺激停止后相当长的一段时间内上皮下的纤维化以及嗜酸细胞仍持续发生[36]。目前的研究热点之一是上皮细胞和哮喘的关系,因此人们也开始关注上皮细胞和气道重塑的关系,动物模型也必将在这个领域为我们的研究提供便利[37]。
基因敲除和转基因技术(geneknock-out,transgenesis)
基因敲除是上世纪80年代末以来发展起来的一种分子生物学技术。是通过一定手段使机体特定的基因失活或缺失的技术。一般说来,基因敲除主要是应用DNA同源重组原理,用设计的同源片段替代靶基因片段,从而达到基因敲除的目的。
过敏性哮喘的基本发病原理早已知道,发病机制的完全阐明虽然还有很长的路要走,但很多细节近年也在动物模型的帮助下了解了很多。特异性抗体曾经广泛用于动物模型来阻断某个位点或靶点例如转录因子、细胞因子、受体或抗体等来验证哮喘发作的必需环节例如抗 GATA-3、抗 IL-5、抗IgE等的应用。如果使用基因敲除技术或转基因技术则可以避免应用抗体的某些弊端,如这种抗体的特异性、反复使用可能动物会产生对抗此抗体的抗体等。采用这类新技术制备的动物模型可以从不同的角度例如使某种转录因子、细胞因子、抗体甚至细胞的缺失来研究观察哮喘的发病机制进而为治疗手段或药物的开发提供方向[38-40]。
机制和治疗研究
上面的讨论顺便提到了机制和治疗的研究。这里需要重点阐述的是,上述动物模型建立起来之后,可以根据需要进行过敏性哮喘的发病机制和治疗研究。目前国际上的很多研究主要是用气道高反应性的模型来进行的[41]。这可能是由于研究手段的限制造成的一个不完善的策略。随着手段的改进和发展,随着新的动物模型的建立,正确的方法应该是根据需要,从致敏、哮喘发作、发作后的预防治疗包括脱敏等不同角度来多层次进行。值得指出的是,除了气道高反应的模型用本文讨论过的其他动物模型或者将来再开发的更新的动物模型,机制研究和治疗研究必须用可以记录整个哮喘发作过程的包括哮喘速发和迟发反应的动物模型。在此基础上,除了免疫学和生理学外,还要结合其他学科如药理学、药物学、病理学、分子生物学等理论和技术来发现有效的、副作用小的药物或手段。
结语
过敏性哮喘的基本发病原理属I型变态反应。根据这个原则制备的动物模型使其和别的很多疑难病相比,更可能接近人类的哮喘。因此根据这类动物模型所取得的数据对于我们理解人类的哮喘更有启发性。目前已经开发成功的一些动物模型主要有:用于观察哮喘速发反应相的模型(主要是麻醉动物)、可以观察速发和迟发双相反应的清醒模型(主要是清醒动物)、用来研究哮喘炎症过程的气道高反应性模型以及基因敲除模型。这些不同的动物模型可根据需要单独或结合使用来从不同角度探索哮喘的发病过程,使我们可以从致敏、疾病发作、发作后的进程等环节从不同层次和深度来认识哮喘的全过程。下一步的首要任务将是从预防和治疗的角度进行研究,利用动物模型这个有力的工具,为最后有效地治疗过敏性哮喘找到突破口。
致谢:文中很多研究经验是笔者20年来自己用动物模型研究哮喘的总结。这些工作在北京大学医学部、瑞典隆德大学及哥德堡大学、美国国家科学院、美国疾病控制中心和肯塔基大学完成。其中刘镜愉教授(北京)、Welinder教授(瑞典隆德)、Skerfving教授(瑞典隆德)、Lotval教授(瑞典哥德堡)、Siegel教授(美国科学院和疾病控制中心)、Fedan教授(美国疾病控制中心)和 Shi教授(美国肯塔基)等很多学者给予了全力培养和支持。中国医学科学院医学实验动物研究所所长秦川教授盛情约稿促成本文的最后完成。
[1]WHO. Global surveillance, prevention and control of chronic respiratory diseases: a comprehensive approach. 2007; Editors:WHO. Page: 15.
[2]Treudler. Update on in vitro allergy diagnostics. J Dtsch Dermatol Ges. 2012; 10: 89-97.
[3]Peden D,Reed CE. Environmental and occupational allergies. J Allergy Clin Immunol. 2010 ; 125(2 Suppl 2): S150-160.
[4]Malo JL,Chan-Yeung M. Agents causing occupational asthma. J Allergy Clin Immunol. 2009; 123: 545-50.
[5]Karol MH, Dixon C, Brady M, Alarie Y. Immunologic sensitization and pulmonary hypersensitivity by repeated inhalation of aromatic isocyanates. Toxicol Appl Pharmacol 1980;53: 260-270.
[6]Botham PA,Hext PM,Rattray NJ,Walsh ST,Woodcock DR.Sensitisation of guinea pigs by inhalation exposure to low molecular weight chemicals. Toxicol Lett 1988; 41: 159-173.
[7]Zhang XD, Andrew ME, Hubbs AF, Siegel PD. Airway responses in Brown Norway rats following inhalation sensitization and challenge with trimellitic anhydride. Toxicol Sci 2006; 94:322-329.
[8]Wei BY, Holford-Strevens V, Carter BG, Sehon AH.Suppression of the anti-trimellityl (TM)IgE response in mice by conjugates of TM with polyvinyl alcohol. Immunology 1984; 51:687-696.
[9]Botham PA,Rattray NJ,Woodcock DR,Walsh ST,Hext PM.The induction of respiratory allergy in guinea-pigs following intradermal injection of trimellitic anhydride: a comparison with the response to 2,4-dinitrochlorobenzene. Toxicol Lett 1989; 47:25-39.
[10]Hayes JP,Daniel R,Tee RD,Barnes PJ,Chung KF,Newman Taylor AJ. Specific immunological and bronchopulmonary responses following intradermal sensitization to free trimellitic anhydride in guinea pigs. Clin Exp Allergy 1992; 22: 694-700.
[11]Welinder H,Zhang X,Gustavsson C,Björk B,Skerfving S.Structure-activity relationships of organic acid anhydrides as antigens in an animal model. Toxicology 1995; 103: 127-136.
[12]Zhang XD,Welinder H,J? nsson BA,Skerfving S. Antibody responses of rats after immunization with organic acid anhydrides as a model of predictive testing. Scand J Work Environ Health 1998; 24: 220-227.
[13]Zhang XD,Murray DK,Lewis DM,Siegel PD. Dose-response and time course of specific IgE and IgG after single and repeated topical skin exposure to dry trimellitic anhydride powder in a Brown Norway rat model. Allergy 2002; 57: 620-626.
[14]Zhang XD, Fedan JS, Lewis DM, Siegel PD. Asthmalike biphasic airway responses in Brown Norway rats sensitized by dermal exposure to dry trimellitic anhydride powder. J Allergy Clin Immunol 2004 ; 113: 320-326.
[15]Baur X, Czuppon A. Diagnostic validation of specific IgE antibody concentrations,skin prick testing,and challenge tests in chemical workers with symptoms of sensitivity to different anhydrides. J Allergy Clin Immunol. 1995; 96: 489-94.
[16]Holt PG, Strickland DH. Interactions between innate and adaptive immunity in asthma pathogenesis: new perspectives from studies on acute exacerbations. J Allergy Clin Immunol 2010;125: 963-972.
[17]von Neergaard K,Wirz K über eine methode zur messung der lungenelastizität am lebenden menschen, insbesondere beim emphysem. Z. Klin. Med 1927; 105: 35-50.
[18]von Neergaard K, Wirz K. Die messung der strömungswiederstande in der atemwege des menschen,insbesondere bei asthma und emphysem. Z. Klin. Med 1927;105: 51-82.
[19]Kaditis AG, Venkataraman ST, Zin WA, Motoyama EK.Partitioning of respiratory system resistance in children with respiratory insufficiency. Am J Respir Crit Care Med 1999; 159:389-396.
[20]Zhang XD, Lötvall J, Skerfving S, H Welinder. Antibody specificity to the chemical structures of organic acid anhydrides studied by in-vitro and in-vivo methods. Toxicology 1997; 118:223-232.
[21]Cui ZH,Rådinger M, Sj? strand M, L? tvall J. Repeated allergen exposure reduce early phase airway response and leukotriene release despite upregulation of 5-lipoxygenase pathways. Clin Transl Allergy 2012; 2: 7.
[22]Jonson B,Beydon L,Brauer K,M? nsson C,Valind S,Grytzell H. Mechanics of respiratory system in healthy anesthetized humans with emphasis on viscoelastic properties. J Appl Physiol.1993 ; 75: 132-140.
[23]Zhao H, Zhang XD, Welinder H, Jonson B. Anaphylactic bronchoconstriction in immunized guinea pigs provoked by inhalation and intravenous administration of hexahydrophthalic anhydride and methyltetrahydrophthalic anhydride. Allergy 1997;52: 18-26.
[24]Sigsgaard T,Schlunssen V. Occupational asthma diagnosis in workers exposed to organic dust. Ann Agric Environ Med. 2004;11: 1-7.
[25]Anees W,Moore VC, Croft JS, Robertson AS, Burge PS.Occupational asthma caused by heated triglycidyl isocyanurate.Occup Med (Lond)2011; 61: 65-67.
[26]Fawcett IW, Taylor AJ, Pepys J. Asthma due to inhaled chemical agents-epoxy resin systems containing phthalic acid anhydride,trimellitic acid anhydride and triethylene tetramine.Clin Allergy 1977 ; 7: 1-14.
[27]Abraham WM,Sielczak MW,Ahmed A,Cortes A,Lauredo IT,Kim J,Pepinsky B,Benjamin CD,Leone DR,Lobb RR,et al.Alpha 4-integrins mediate antigen-induced late bronchial responses and prolonged airway hyperresponsiveness in sheep. J Clin Invest 1994; 93: 776-787.
[28]Hamelmann E,Schwarze J,Takeda K,Oshiba A,Larsen GL,Irvin CG, Gelfand EW. Noninvasive measurement of airway responsiveness in allergic mice using barometric plethysmography. Am J Respir Crit Care Med 1997; 156 (3 Pt 1): 766-75.
[29]Meurs H,Gosens R,Zaagsma J. Airway hyperresponsiveness in asthma: lessons from in vitro model systems and animal models.Eur Respir J 2008; 32: 487-502.
[30]Busse WW. The relationship of airway hyperresponsiveness and airway inflammation: Airway hyperresponsiveness in asthma: its measurement and clinical significance. Chest 2010; 138 (2 Suppl): 4S-10S.
[31]Diamant Z,Boot JD,Virchow JC. Summing up 100 years of asthma. Respir Med 2007; 101: 378-88.
[32]Anderson SD. Provocative challenges to help diagnose and monitor asthma: exercise, methacholine, adenosine, and mannitol. Curr Opin Pulm Med 2008; 14: 39-45.
[33]Anderson SD,Brannan JD. Bronchial provocation testing: the future. Curr Opin Allergy Clin Immunol 2011; 11: 46-52.
[34]Carter PM,Heinly TL,Yates SW,Lieberman PL. Asthma: the irreversible airways disease. J Investig Allergol Clin Immunol 1997; 7: 566-571.
[35]McAnulty RJ. Models and approaches to understand the role of airway remodelling in disease. Pulm Pharmacol Ther 2011; 24:478-486.
[36]McMillan SJ,Lloyd CM. Prolonged allergen challenge in mice leads to persistent airway remodeling. Clin Exp Allergy 2004; 34:497-507.
[37]Wang Q,Li H,Yao Y,Xia D,Zhou J. The overexpression of heparin-binding epidermal growth factor is responsible for Th17-induced airway remodeling in an experimental asthma model. J Immunol 2010; 185: 834-841.
[38]Vasquez YR, Spina D. What have transgenic and knockout animals taught us about respiratory disease? Respir Res 2000; 1:82-86.
[39]Moffatt JD. What targets have knockouts revealed in asthma?Pharmacol Ther 2005; 107: 343-357.
[40]Hausding M, Sauer K,Maxeiner JH, Finotto S. Transgenic models in allergic responses. Curr Drug Targets 2008; 9: 503-510.
[41]Louten J,Mattson JD,Malinao MC,et al. Biomarkers of disease and treatment in murine and cynomolgus models of chronic asthma. Biomark Insights 2012; 7: 87-104.
Sensitization,Airway Challenge and Airway Hyperresponsiveness in Animal Models of Allergic Asthma
ZHANG Xing-dong
(Key Laboratory of Human Disease Comparative Medicine,Ministry of Health;Key Laboratory of Human Diseases Animal Model,State Administration of Traditional Chinese Medicine;Institute of Laboratory Animal Science,Chinese Academy of Medical Science(CAMS)& Comparative Medical Center,Peking Union Medical College(PUMC))
Allergic asthma is an important disease.The interflow of asthma between animal models and human is that the former is also established on type I hypersensitivity.Sensitization is the first step for animal models of asthma.The characteristics and reactivity of complete allergens and haptens may lead to different outcomes.Airway challenge is a useful tool to study asthmatic responses.The new methods enabled successful observation of early-phase and late-phase asthmatic responses.Work on the pathogenesis and therapy of asthma should be conducted with different models besides the one of airway hyperresponsiveness used popularly nowadays.Other applications using animal models including airway remodeling,gene knock-out,transgenesis and therapeutic drugs were also reviewed briefly.
Model,animal;Allergy;Asthma;Sensitization;Airway challenge;Airway hyperresponsiveness
R332
A
1671-7856(2012)09-0001-07
10.3969/j.issn.1671.7856.2012.09.001
2012-09-05

