蛋白酶体抑制剂MG-132改善大鼠心肌梗死后心肌肥厚
陈章荣,吴新华*,罗开良,何 泉,向玉鸾
(1.大理学院附属医院心内科,云南大理6710000;2.重庆医科大学第二附属医院心内科,重庆410010;3.重庆医科大学第一附属医院心内科,重庆410016)
心肌梗死后非梗死区心肌细胞肥大是心肌梗死后心肌重塑的重要特征之一,参与心衰的发生发展过程,防治病理性心肌细胞肥大对防治心肌重塑及心衰的发生发展有重要意义。近年来的研究表明,蛋白酶体系统的活性增加与心肌肥厚有明显关系,应用蛋白酶体抑制剂能改善压力负荷过重的心肌肥厚[1-2]。研究表明蛋白酶体抑制剂PS-519通过抑制NF-κB的活性,抑制炎性因子表达而减轻小鼠心肌肥厚[3]。用MG-132可以使肥大心肌细胞的体积缩小[4]。另外的研究表明蛋白酶体抑制剂MG-132通过抑制NF-κB活性,减轻炎症因子表达而减轻减轻大鼠心肌缺血再灌注的损伤[5]。因此,推测MG-132可以通过抑制NF-κB活性改善心肌梗死后心肌肥厚,本研究对此进行探讨。
1 方法
1.1 动物心肌梗死模型的建立及给药方法
健康清洁级体质量相近的SD大鼠,雌雄各半,购于重庆医科大学动物中心(合格证号:SCXK[渝]2007-0001),体质量250±50 g。心肌梗死模型制作参照文献[6]进行。胸骨左缘第2~4肋开胸,以左冠脉主干为标志,在左心耳下方2 mm处进针,6/0号丝线结扎左前降支,当结扎区域变白,心电图多于两个肢导联出现ST段上抬至少0.2 mV,则判断为造模成功。将造模成功且术后24 h仍存活的大鼠随机分为MI组和MG组。另设假手术(SH)组,SH组在相同冠脉部位只穿线不结扎。每组动物均为6只。MG组于术后24 h腹腔内注射MG-132(Calbiochem公司)0.1 mg/(kg·d)[7],连续给药28 d,MI 组及SH组给0.9%氯化钠注射液对照。
1.2 超声心动图、左室质量指数及标本采集
大鼠在处死前均行超声心动图(HP/SONOS 5500多普勒超声仪,探头频率4~10 MHz),测定左室后壁厚度。处死动物,摘取心脏,剔除血管组织及右心室,称取左心室湿重,除以体质量获得左室质量指数(mg/g)。然后沿左心室长轴分为3份,心底部及心尖部置于液氮速冻后置-70℃保存用于反转录-聚合酶链反应(RT-PCR)检测。中间部分切成3 mm的薄片,4%多甲醛溶液固定24 h后,石蜡包埋,切成5 μm厚的切片。
1.3 非梗死区心肌细胞表面积、周长及平均直径
每个标本选2张天狼猩红染色切片,用北航CM-2000B型生物医学图像分析系统,测量天狼猩红染色切片中心心肌细胞各种形态参数。每张切片选择5个视野,计算机自动计算出各视野中心肌细胞形态参数值:心肌细胞面积、周长及平均直径。
1.4 半定量RT-PCR检测NF-κB及IL-1β表达
随机取各组大鼠心肌组织,按Trizol法提取心肌组织总RNA,经1%琼脂糖凝胶电泳证实RNA的完整性后,采用紫外分光光度计测定其浓度。取2 μg总RNA,以AMV反转录酶(Toyobo公司,日本)合成cDNA,取反转录产物进行PCR反应。反转录反应体系为:Oligo 5 μL,总 RNA 7 μL,L.5 ×RT 缓冲液4 μL,10 mmol/L dNTP 2 μL,RNAase 抑制剂1 μL,ReverTraAce 1 μL。反转录反应条件:30 ℃10 min,42℃ 60 min,85℃ 5 min。引物由上海博尚生物公司合成,NF-κB P65:上游5'-CAGCACATC CAGACAGACACCA-3',下游 5'-GCTGCTAAAAGAA TCCTCAAAACC-3',产物长度480 bp;IL-1β:上游 5'-CACCTTCTTTTCCTTCATCTTTG-3',下游 5'-AAGAC AAACCGCTTTTCCATC-3',产物长度381 bp;β-actin:上游 5'-CAGCTTCTTCTAGTGCCGTTCC-3',下游 5'-GGAGTCAGGTGTTTCTGGTGGAG-3', 产 物 长 度219 bp。反应体系:灭菌蒸馏水35 μL,10×PCR 缓冲液5 μL,上 游 引 物 1.5 μL,下 游 引 物 1.5 μL,10 mmol/L dNTPs 4 μL,Taq 酶1 μL,cDNA 2 μL。NF-κB P65的PCR反应条件:94℃预变性5 min后,94 ℃变性10 s,54 ℃退火30 s,72 ℃延伸30 s,30个循环后,72℃延伸5 min;IL-1β及β-actin的退火温度分别为50℃、58℃,其余反应条件与NF-κB P65反应条件相同。PCR产物经含Goldview的1.5%琼脂糖凝胶电泳,经凝胶成像系统拍照、扫描。QuantityOne4.6软件进行图像分析计算 NF-κB P65及IL-1β产物相对量。吸光面积积分比值表示DNA含量,以NF-κB P65及IL-1β与β-actin扩增条带的吸光面积积分比值评定mRNA表达水平。
1.5 免疫组化检测NF-κB、IL-1β蛋白质表达
用免疫组织化学SP法(SP试剂盒购于北京中杉金桥生物技术有限公司;兔抗大鼠 NF-κB P65 IgG、兔抗大鼠IL-1β IgG为Santa Cruz)观察心肌细胞NF-κB P65和IL-1β蛋白表达情况。石蜡包埋切片脱蜡,梯度乙醇浸泡,PBS冲洗,5%山羊血清封闭后,兔抗大鼠NF-κB P65 IgG和兔抗大鼠IL-1β(抗体浓度1∶100)孵育4℃过夜。次日分别滴加生物素标记山羊抗兔IgG(二抗)和辣根酶标记链霉卵白素,DAB显色,苏木精复染,封片,拍照。高倍镜下观察核因子P65蛋白表达情况,半定量分析方法参照文献[8]所述,以心肌细胞核中出现棕色颗粒为阳性细胞,计算阳性指数(PI),PI=(阳性细胞数/视野内总细胞数)×100%。每片观察5个非重叠高倍视野,取平均值。IL-1β以心肌细胞胞质出现现棕色颗粒为阳性细胞,每片随机观察5个非重叠高倍视野,用计算机图像分析系统(Image proplus 5.1,Media Cybernetics,USA)计算积分吸光度值(IA)作为半定量参数。
1.6 统计学分析
所有资料采用SPSS12.0软件统计包进行分析,计量资料以均数±标准差(±s)表示,两组之间的比较采用t检验。
2 结果
2.1 左室后壁厚度、左室质量指数
与SH组比较,MI组和MG组左室后壁厚度、左室质量指数增加(P<0.01),而MG组大鼠的上述指标均得到明显改善(P<0.01)(表1)。
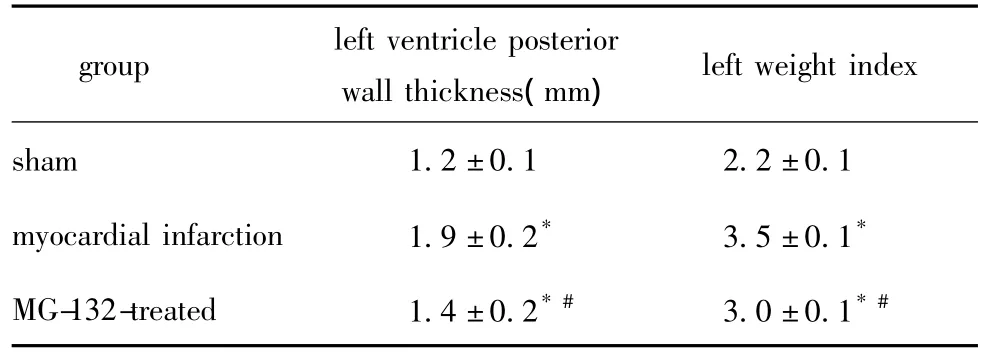
表1 各组的左室后壁厚度、左室质量指数Table 1 The values of left ventricle posterior wall thickness and left weight index in all groups(x ± s,n=6)
2.2 非梗死区心肌细胞形态学参数
与SH组比较,MI组和MG组心肌细胞表面积、周长、平均直径显著增加 (P<0.01),而MG组大鼠的上述指标均得到明显改善 (P<0.01)(图1,表2)。
2.3 NF-κB和IL-1β的mRNA表达
与SH 组相比,MI组和 MG 组 NF-κB、IL-1β 的mRNA表达量明显增加(P<0.01),与MI组相比,MG组的mRNA表达明显降低(P<0.01)(图2,表3)。
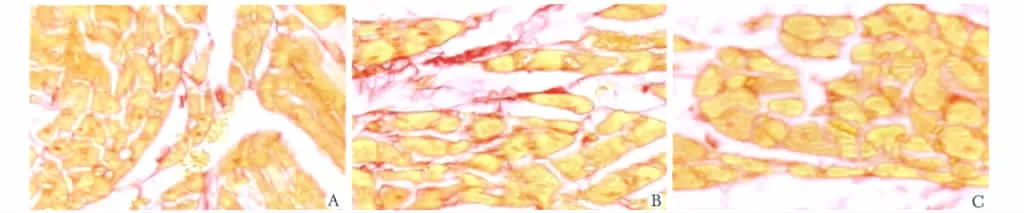
图1 各组的细胞表面积、周长及直径Fig 1 The myocardial cell surface area,perimeter and direct in all groups(×200)
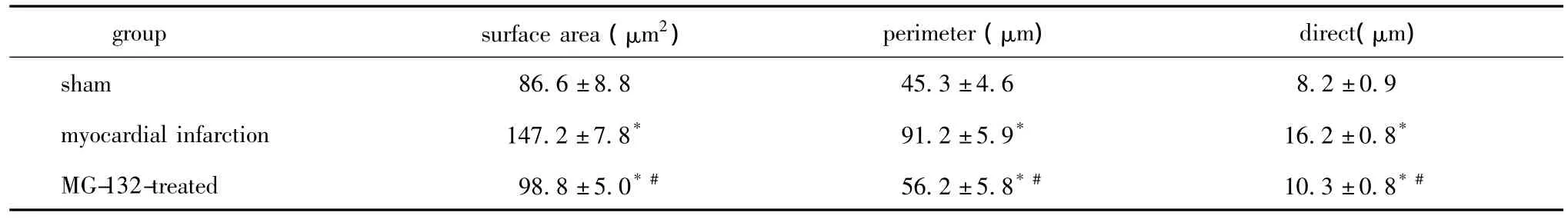
表2 各组的细胞表面积、周长、直径Table 2 The myocardial cell surface area,perimeter and direct in all groups(x ± s,n=6)
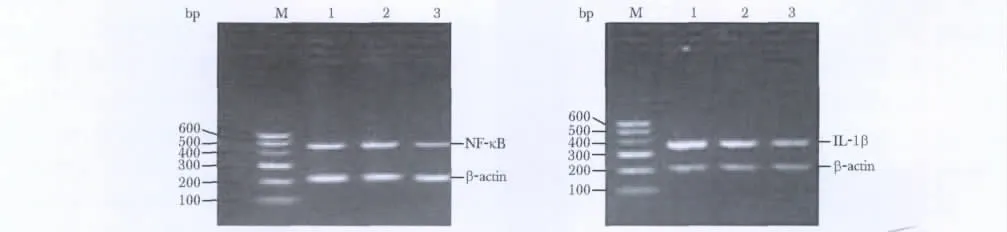
图2 大鼠心肌NF-κB、IL-1β的RT-PCR结果Fig 2 The mRNA levels of NF-kappaB P65 and IL-1β in all groups

表3 NF-κB、IL-1β的 mRNA 表达量Table 3 The mRNA levels of NF-kappaB P65 and IL-1β in all groups(x ± s,n=6)
2.4 NF-κB、IL-1β的蛋白质表达
结果见,MI组和MG组NF-κB、IL-1β的蛋白质表达量相对于SH组明显增加(P<0.01),MG组与MI组相比,其蛋白质表达量明显降低(P<0.01)(图3,表 4)。
3 讨论
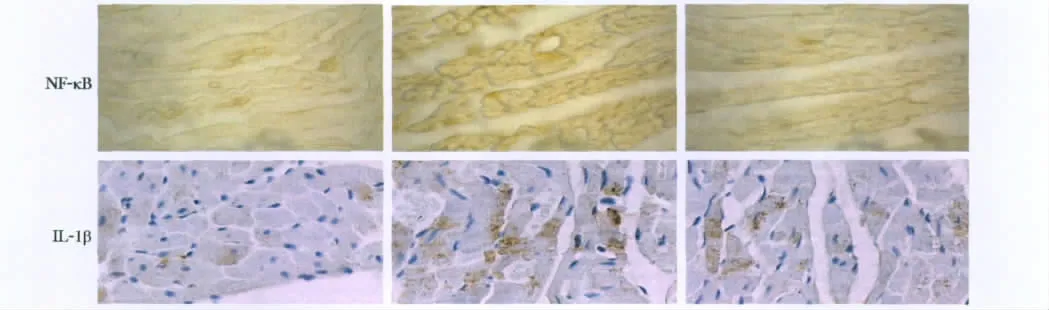
图3 免疫组化法检测NF-κB和IL-1β蛋白质表达Fig 3 The myocardial cell surface area,perimeter and direct in all groups(×200)

表4 NF-κB、IL-1β的蛋白质表达量Table 4 The protein levels of NF-kappaB P65 and IL-1βin all groups(x ± s,n=6)
泛素-蛋白酶体系统在心肌细胞的生长、发育中扮演重要角色[9],其功能失调与心肌缺血、肥厚、纤维化以及心肌细胞凋亡有关[10]。心肌肥厚模型中心内膜下心肌的蛋白酶体亚基表达增加,活性增强,应用蛋白酶体抑制剂改善心肌肥厚成为可能[1]。体外实验表明应用MG-132可以使肥大心肌细胞的体积缩小[4],体内实验表明,MG-132可改善压力负荷过重导致的心肌肥厚[2]。然而,尚未见MG-132改善心肌梗死后心肌肥厚的研究报道,鉴于此,本研究进行探讨。
本研究制作大鼠心肌梗死模型,测量左室后壁厚度及计算左室质量指数,计算非梗死区的心肌细胞的形态学参数如心肌细胞的直径、周长和表面积。结果显示MI组的上述指标较sham组增加,说明心肌梗死后发生了非梗死区肥厚。而MG组的上述指标较MI组明显降低,说明MG-132干预能改善梗死后非梗死区的心肌肥厚。心肌梗死后心肌处于缺血状态,出现大量损伤蛋白,泛素蛋白酶体活性代偿性增加。当泛素蛋白酶体的活性过高时,一方面促进心肌肥厚抑制物如环磷酸腺苷受体降解,导致心肌肥厚[9];另一方面,泛素蛋白酶体活性过高促进NF-κB激活,NF-κB 激活与心肌肥厚有密切关系[11]。蛋白酶体抑制剂通过抑制蛋白酶体活性,能减轻心肌肥厚[1]。本研究的结果表明,小剂量MG-132可以改善心肌梗死大鼠非梗死区的心肌肥厚。
本研究在基因和蛋白质水平对NF-κB、IL-1β在心肌细胞中的表达进行检测。结果显示MI组的NF-κB蛋白质和mRNA表达增加,证明NF-κB在心肌梗死后存在持续激活,最近的研究也证明了心肌梗死后存在 NF-κB 的激活[12]。激活的 NF-κB 通过增加炎性细胞因子的表达,这些因子通过一系列的信号通路参与心肌细胞肥大过程。本研究中,MI组的IL-1β在基因和蛋白质水平呈现高表达,说明了心肌梗死后心肌肥厚过程中存在炎性细胞因子的表达增加,这与文献[13]报道相符。IL-1β可通过活化C-JUN氨基端激酶/应激活化蛋白激酶以及促分裂原活化蛋白激酶级联反应信号通路导致心肌肥厚[14],使用 MG-132后 NF-κB 及其下游的炎性细胞因子(如IL-1β)降低,IL-1β的表达与NF-κB成一致变化,证实MG-132通过抑制NF-κB激活,降低炎性细胞因子如IL-1β的表达水平使非梗死区心肌肥厚得到改善。
虽然本实验证实了MG-132能改善大鼠心肌梗死后心肌肥厚,为心肌梗死的治疗提供了一种新的思路和方法。然而,由于心肌肥厚的机制较为复杂,MG-132是否通过其他机制改善心肌肥厚以及其抑制NF-κB激活的具体机制尚有待进一步的研究。
[1]Depre C,Wang Q,Yan L,et al.Activation of the cardiac proteasome during pressure overload promotes ventricular hypertrophy[J].Circulation,2006,114:1821 -1828.
[2]Chen B,Ma Y,Meng R,et al.MG132,a proteasome inhibitor,attenuates pressure-overload-induced cardiac hypertrophy in rats by modulation of mitogen-activated protein kinase signals[J].Cardiovasc Res,2010,85:367 - 375.
[3]Stansfield WE,Tang RH,Moss NC,et al.Proteasome inhibition promotes regression of left ventricular hypertrophy[J].Am J Physiol Heart Circ Physiol,2008,294:H645 -650.
[4]Meiners S,Dreger H,Fechner M,et al.Suppression of cardiomyocyte hypertrophy by inhibition of the ubiquitin-proteasome system[J].Hypertension,2008,51:302 -308.
[5]戴翠莲,罗开良.蛋白酶体抑制剂MG-132下调炎性细胞因子表达抑制大鼠心肌再灌注伤[J].第三军医大学学报,2007,29:129 -133.
[6]刘元生,陈运贞.慢性心肌梗死大鼠实验模型[J].重庆医科大学学报,2002,27:153 -155.
[7]Meiners S,Hocher B,Weller A,et al.Downregulation of matrix metalloproteinases and collagens and suppression of cardiac fibrosis by inhibition of the proteasome[J].Hypertension,2004,44:471 -477.
[8]Wang S,Kotamraju S,Konorev E,et al.Activation of nuclear factor-κB during doxorubiocin-induced apoptosis in endothelial cell and myocytes is pro-apoptotic:the role of hydrogen peroxide[J].Biochem J,2002,367:729 -740.
[9]Hedhli N,Depre C.Proteasome inhibitors and cardiac cell growth[J].Cardiovasc Res,2010,85:321 -329.
[10]Li YF,Wang X.The role of the proteasome in heart disease[J].Biochim Biophys Acta,2011,1809:141 - 149.
[11]Zelarayan L,Renger A,Noack C,et al.NF-kappaB activation is required for adaptive cardiac hypertrophy[J].Cardiovasc Res,2009,84:416 -424.
[12]Gu Y,Wang X,Wang X,et al.Artemisinin attenuates post-infarct myocardial remodeling by down-regulating the NF-κB pathway[J].2012,227:161 -170.
[13]Bujak M,Frangogiannis NG.The role of IL-1 in the pathogenesis of heart disease[J].Arch Immunol Ther Exp(Warsz).2009,57:165 -176.
[14]Saklatvala J,Davis W,Guesdon F.Interleukin 1(IL1)and tumour necrosis factor(TNF)signal transduction[J].Philos Trans R Soc Lond B BioL Sci,1996,351:151 -157.

