利福平对鱼藤酮诱导大鼠的抗多巴胺神经元凋亡作用
张国华 徐杰 吴达荣 陶恩祥
研究表明,散发性帕金森病(Parkinson’s disease,PD)可能与遗传因素和环境因素共同作用有关[1-2],其中环境因素占了十分重要的地位。 鱼藤酮作为一种环境毒素,和1-甲基-4-苯基-1,2,3,6-四 氢 吡 啶(1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine,MPTP)一样能诱导大鼠黑质多巴胺神经元(dopamine,DA)受损、缺失,十分适合用于 PD 动物模型的制作[3]。
在PD治疗方面,近年来被广泛开展的外科治疗近期疗效不错[4],但只是治标不治本,远期疗效尚不确切。然而,如何阻止DA神经元凋亡则被看作是根治PD的新方向。据报道,利福平除具有抗结核等作用外,还具有抗氧化应激及抗神经元凋亡的作用,从而提示利福平可能具有治疗PD的作用[5]。我们之前的研究已证实,利福平在体外和体内均具有保护DA神经元的作用[6-7],但利福平在体内保护神经元的作用是否通过对抗细胞凋亡而实现却还没明确。
本实验是在上述的研究结果基础上,通过鱼藤酮诱导 Sprague-Dawley(SD)大鼠出现 DA神经元的凋亡,从而观察利福平在活体内的抗神经元凋亡作用。
1 材料与方法
1.1 动物与分组 雄性SD大鼠72只(清洁级,中山大学实验动物中心提供),体质量250~300 g。将大鼠随机分成五组,正常对照组及利福平(MD公司)对照组各12只,鱼藤酮(Sigma公司)组、利福平治疗组及利福平预防组各16只。正常对照组、利福平对照组及鱼藤酮组分别每天给予背部皮下注射葵花油(Sigma 公司)1 mL/(kg·d)、利福平灌胃及背部皮下注射鱼藤酮葵花油乳化液;利福平治疗组在给予鱼藤酮1周后开始同时给予鱼藤酮和利福平;利福平预防组在给予鱼藤酮的前3 d每天先给予利福平灌胃,然后每天同时给予鱼藤酮和利福平。以上各组总的处理时间均为3周;鱼藤酮在葵花油乳化液中的浓度为1.5 mg/mL,给药剂量为1.5 mg/(kg·d); 利福平在生理盐水中的浓度为 5 mg/mL,给药剂量为 30 mg/(kg·d)。
1.2 方法
1.2.1 大鼠处死及标本采集 于第3周末分别处死各组大鼠,用10%水合氯醛腹腔注射麻醉后暴露心脏,经左心室快速灌注冰盐水100 mL,持续灌注冰4%多聚甲醛-PBS100 mL,断头取脑,4%多聚甲醛-PBS固定过夜,冠状切断包含黑质的脑组织(前囟尾侧4.6~6.2 mm),石蜡包埋,5 μm连续切片。
1.2.2 原位末端标记法(Tunel)(R&D 公司)检测凋亡 中脑石蜡切片脱蜡回水,NeuroPore室温处理后去DNA酶水漂洗,阳性对照组用TACS核酸酶孵育30 min,室温下抑制5 min,末端脱氧核苷酸转移酶(TdT)标记缓冲液5 min,标记反应混和液37℃孵育1 h,TdT终止缓冲液室温下5 min,磷酸盐缓冲液(PBS)漂洗,链霉亲和素-辣根过氧化物(DAB)酶室温下10 min复染,脱色,封片,光镜下观察黑质区凋亡情况。
1.2.3 黑质 Bax、Bcl-2 和 Caspase3 免疫组化检测切片脱蜡回水后微波热修复抗原,辣根过氧化物酶(HRP)阻断剂阻断30 min,分别4℃孵育兔抗鼠Caspase-3 多克隆抗体(Chemicon 公司)(1∶100)、兔抗鼠 Bax 多克隆抗体(Santa Cruz公司)(1∶100)、兔抗鼠 Bcl-2 多克隆抗体(Santa Cruz 公司)(1∶100)过夜,HRP 标记羊抗兔二抗(Boster公司)(1∶100)室温孵育2 h,DAB显色,复染,脱水、透明、烘干,中性树胶封片后镜下观察。
1.2.4 图像分析 经 Tunel及 Bax、Bcl-2和 Caspase-3免疫组化染色后的切片(每组中5个大鼠同一层面的中脑黑质切片)在Imagepro-Plus5.1系统下,每张切片取3个不同的视野进行Tunel及Bax、Bcl-2和Caspase-3阳性细胞数的计算,每一张Tunel染色切片放大400倍进行观察和分析,每一张免疫组化染色切片放大200倍进行观察和分析,阳性细胞计数的单位是个/mm2。
1.3 统计学方法 Tunel及 Bax、Bcl-2和 Caspase-3阳性细胞数均采用(x±s)表示,应用SPSS 13.0统计软件进行统计分析,5组大鼠以上4种阳性细胞数均数的比较均采用单因素方差分析,处理组之间的两两比较采用SNK-q检验,检验水准α=0.05。
2 结果
2.1 大鼠中脑黑质凋亡细胞数目的比较 如表1、图1所示,Tunel检测结果显示,两对照组的大鼠黑质凋亡细胞数在统计学上无统计学差异(P>0.05);与两对照组相比,其余3组的大鼠黑质凋亡细胞数均明显增多,且有统计学差异(P<0.01),而黑质凋亡细胞数在其余3组间的两两比较也均有统计学差异(P<0.01)。
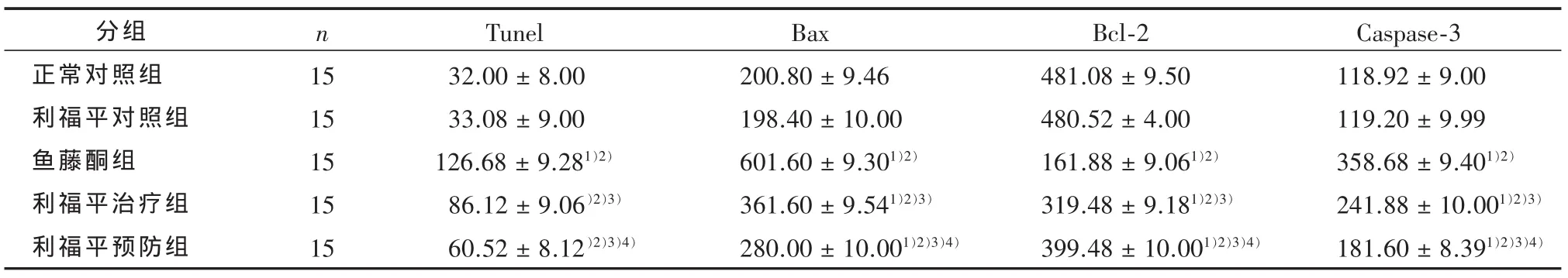
表1 Tunel及 Bax、Bcl-2、Caspase3 阳性细胞数(400 ×,200 × )(个 /mm2)
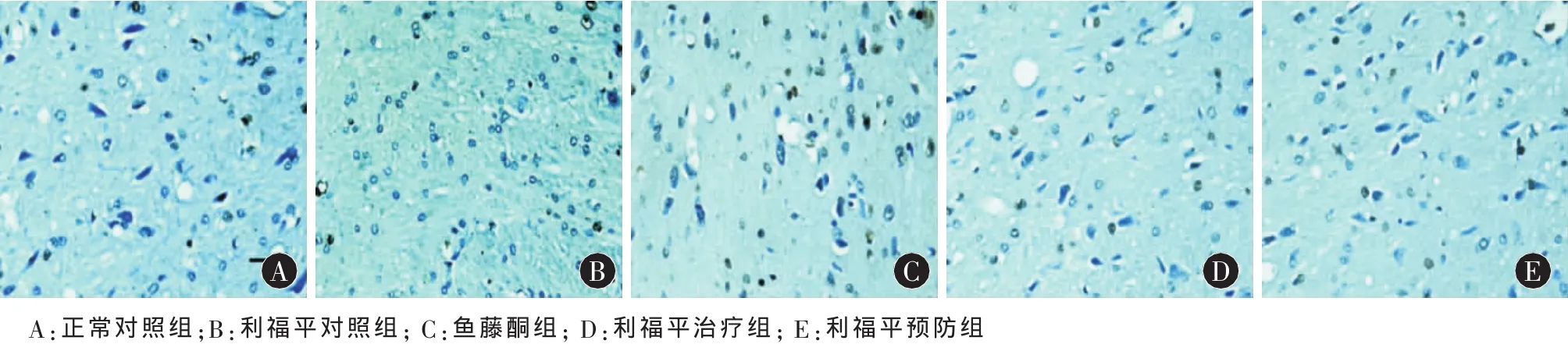
图1 大鼠中脑黑质凋亡细胞(Tunel,胞质呈棕褐色为阳性)(400×)
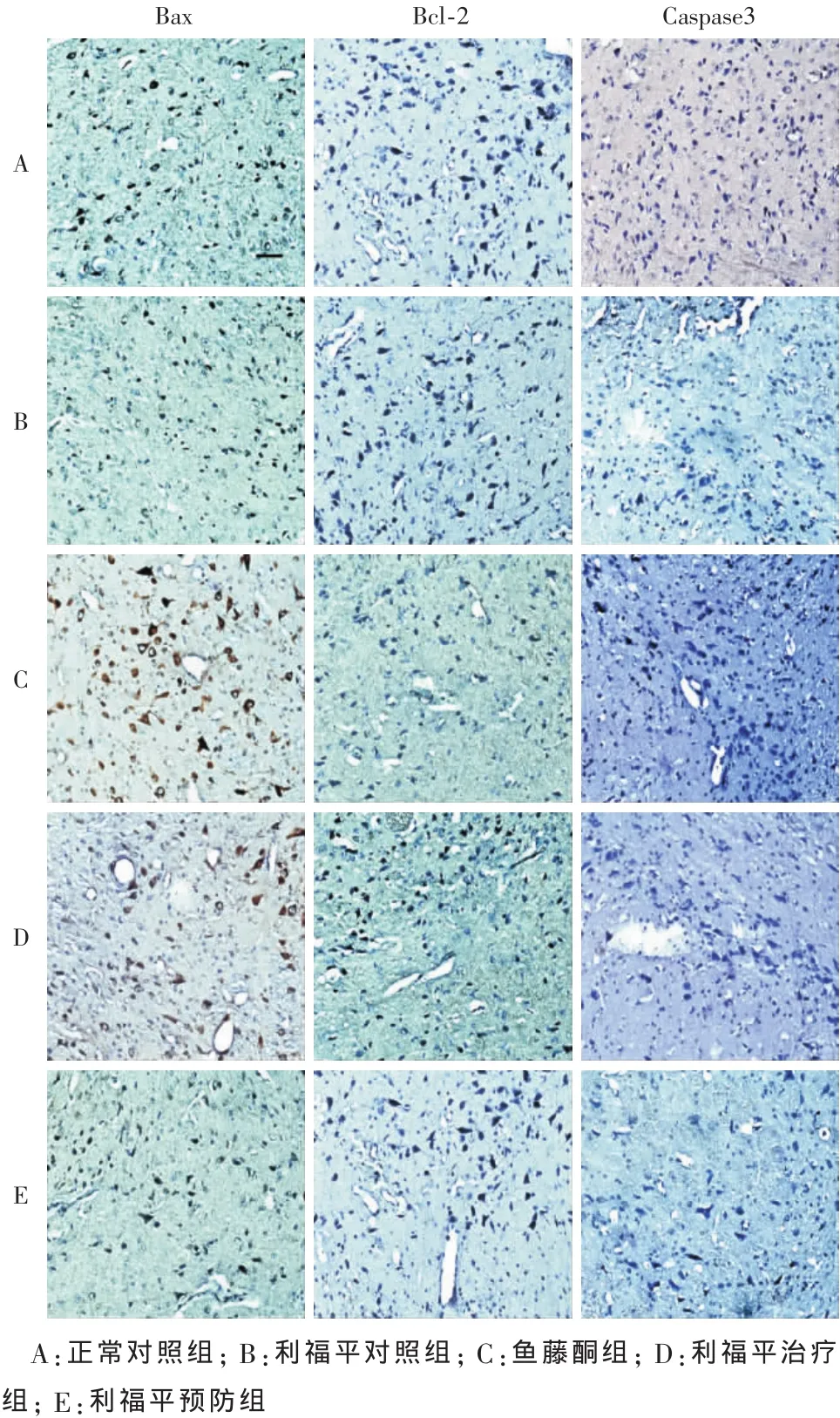
图2 大鼠中脑黑质Bax、Bcl-2和Caspase3阳性细胞(DAB染色,胞质呈棕褐色为阳性)(200×)
2.2 大鼠中脑黑质 Bax、Bcl-2和 Caspase-3的阳性细胞数的比较 如表1、图2所示,两对照组的大鼠黑质的Bax、Bcl-2和Caspase-3阳性细胞数在统计学上无统计学差异(P>0.05);与两对照组相比,其余3组的大鼠黑质Bax及Caspase-3阳性细胞数均明显增多而Bcl-2阳性细胞数均明显减少,且3组中的这3个指标均与两对照组间有统计学差异(P<0.01),而这3个指标在其余3组中的两两比较也均有统计学差异(P<0.01)。
3 讨论
近年来,随着神经生化技术的发展,人们发现PD的发生与细胞凋亡存在密切关系。研究表明,各种因素导致的PD最终都经过黑质DA神经元大量凋亡这一共同通路[8]。线粒体、氧化应激及α-synuclein是整个凋亡过程中的关键因素。在PD患者黑质DA神经元内,线粒体功能异常和氧化应激可使α-synuclein发生异常聚集,而α-synuclein的异常聚集反过来影响线粒体的功能,从而形成恶性循环,最终导致细胞凋亡和PD的发生[9]。
在蛋白水平上,与PD细胞凋亡关系最为密切的是Bcl-2蛋白家族的Bcl-2(抑细胞凋亡)和Bax(促细胞凋亡)两种蛋白。研究发现,细胞内Bcl-2和Bax的比值对凋亡的发生起到重要调节作用[10]。同时,在PD患者黑质细胞发生凋亡的过程中caspase级联反应是必不可少的环节[11]。上述发现提示,黑质DA神经元凋亡的核心环节可能是各种因素的作用下导致Bcl-2和Bax的比例下降及Caspase-3的激活并最终引起细胞凋亡。
鱼藤酮是一种人类容易少量长期接触的环境毒素,其可直接通过血脑屏障抑制脑组织的线粒体呼吸链复合体Ⅰ的活性[12]。由于DA神经元对能量障碍特别敏感,因此低剂量的鱼藤酮在不影响其他部位细胞线粒体功能的情况下却可引起DA神经元的凋亡[13]。另有研究显示,鱼藤酮最终通过调节Bcl-2和Bax的比例并激活caspase来诱导细胞凋亡[14]。
有学者提出,利福平之所以同时具有透过血脑屏障抑制氧化应激和神经细胞凋亡的作用,是由于其结构式中有一个连有脂肪链的萘氢醌环[5]。利福平经口服后在大鼠脑中浓度可达到血药浓度的 13%[15],能有效作用于大鼠中枢神经系统[16]。 而本课题组已通过实验发现,利福平可在体外对抗MPP+诱导的PC12细胞凋亡[6],但此作用在活体身上却还没得到证实。
在本研究中,我们选择了鱼藤酮来诱导SD大鼠出现中脑黑质DA神经元的大量凋亡,并同时应用利福平经胃给药以抗凋亡,通过检测凋亡细胞数及Bax、Bcl-2和Caspase-3的免疫活性变化以观察利福平是否具有抑制鱼藤酮诱导的细胞凋亡的作用。实验结果发现:①低剂量慢性暴露于鱼藤酮后,大鼠黑质的凋亡细胞明显增多,而同时给予利福平灌胃的大鼠黑质凋亡细胞比仅给予鱼藤酮的大鼠明显减少;②低剂量慢性暴露于鱼藤酮后,大鼠黑质部位Bax、Caspase-3表达增多而Bcl-2表达减少,而同时给予利福平灌胃的大鼠黑质的上述变化均有所减轻;③预防性使用利福平所起的抗凋亡作用较治疗性使用利福平更显著。因此,我们得出以下结论:①鱼藤酮在活体内是通过诱发细胞凋亡途径来引起DA神经元的大量丢失的,而利福平则在活体内具有对抗鱼藤酮诱导的细胞凋亡的作用;②鱼藤酮在活体内通过下调Bcl-2和Bax的比值、激活caspase通路来诱导DA神经元凋亡发生的,而利福平在活体内可通过上调Bcl-2和Bax的比值、抑制caspase通路来实现抗鱼藤酮诱导的细胞凋亡的作用;③应用利福平的起始时间越早、持续时间越长,对抗细胞凋亡的作用越明显。
总的来说,本研究不但成功地模拟了环境毒素(线粒体呼吸链复合体Ⅰ)在活体内诱发大量DA神经元发生凋亡的过程,验证了这类毒素引起细胞凋亡发生的通路,而且进一步证实了利福平具有抑制环境毒素诱导的多巴胺神经元凋亡的作用,阐明了其抗凋亡作用的实现途径。这些重要发现使利福平应用于治疗人类PD的想法由空想变成可能,为在PD的治疗上获得重大突破迈出了坚实的一步。
[1]Bohlen und Halbach Ov,Schober A,Krieglstein Genes.Proteins,and neurotoxins involved in Parkinson’s disease [J].Progress in Neurobiology,2004,73(3):151-77.
[2]Fearnley JM,Lees AJ.Ageing and Parkinson’s disease: substantia nigra regional selectivity[J].Brain,1991,114(5):2283-2301.
[3]陈忻,张楠,赵晖,等.鱼藤酮致帕金森病大鼠行为学与黑质病理损伤的关系[J]. 中国神经精神疾病杂志,2008,34(4):232-234.
[4]刘金龙,陈玲,柯春龙,等.脑深部电刺激治疗帕金森病近期疗效的初步探讨[J]. 中国神经精神疾病杂志,2009,35(4):208-211.
[5]Tomiyama T,Shoji A,Kataoka K.Inhibition of amyloid β protein aggregation and neurotoxicity by rifampicin [J]. J. Biol.Chem,1996,271(12):6839-6845.
[6]Xu J,Wei C,Xu C,et al.Rifampicin protects PC12 cells against MPP+-induced apoptosis and inhibits the expression of an α-Synuclein multimer[J].Brain Res,2007,1139(3):220-225.
[7]陶恩祥,张国华,徐杰,等.利福平对鱼藤酮处理的大鼠多巴胺神经元的保护作用[J].中国病理生理杂志,2008,24(9):1751-1756.
[8]Ziv I,Melamed E,Nardi N,et al.Dopamine induces apoptosislike cell death in cultured chick sympathetic neurons-a possible novel pathogenetic mechanism in Parkinson’s disease[J].Neurosci Lett,1994,170(1):136-140.
[9]Volles MJ,Lansbury PT Jr.Zeroing in on the pathogenic form of alpha-synuclein and its mechanism of neurotoxicity in Parkinson's disease[J].Biochemistry,2003,42(26):7871-7878.
[10]Marzo I,Brenner C,Zamzami N,et al.Bax and adenine nucleotide translocator cooperate in the mitochondrial control of apoptosis[J].Science,1998,281(5385):2027-2031.
[11]Hartmann A,Hunot S,Michel PP,et al.Caspase-3:A vulnerability factor and final effector in apoptotic death of dopaminergic neurons in Parkinson’s disease[J].Proc Natl Acad Sci USA,2000,97(6):2875-2880.
[12]Sherer TB,Richardson JR,Testa CM,et al.Mechanism of toxicity of pesticides acting at complex I:relevance to environmental etiologies of Parkinson’s disease[J].J.Neurochem,2007,100(6):1469-1479.
[13]Betarbet R,Sherer TB,MacKenzie G,et al.Chronic systemic pesticide exposure reproduces features of Parkinson’s disease[J].Nat Neurosci,2000,3(12):1301-1306.
[15]Junn E,Mouradian MM.Apoptotic signaling in dopamine-induced cell death: the role of oxidative stress,p38 mitogen-activated protein kinase,cytochromec and caspases[J].J.Neurochem,2001,78(2):374-383.
[16]Mindermann T,Landolt H,Zimmerli W,et al.Penetration of rifampicin into the brain tissue and cerebral extracellular space of rats[J].J.Antimicrob.Chemother,1993,31(5):731-737.
[17]Oida Y,Kitaichi K,Nakayama H,et al.Rifampicin attenuates the MPTP-induced neurotoxicity in mouse brain[J].Brain Res,2006,1082(1):196-204.

