不同干燥方法对薄荷多酚、总黄酮及抗氧化性的影响*
吕爽,田呈瑞,石慧
1(陕西师范大学食品工程与营养科学学院,陕西西安,710062)
2(西安市农业技术推广中心,陕西西安,710065)
不同干燥方法对薄荷多酚、总黄酮及抗氧化性的影响*
吕爽1,2,田呈瑞1,石慧1
1(陕西师范大学食品工程与营养科学学院,陕西西安,710062)
2(西安市农业技术推广中心,陕西西安,710065)
研究了3种不同干燥方法下椒样薄荷和苏格兰留兰香的多酚、总黄酮含量和抗氧化性的差异,并且对椒样薄荷和苏格兰留兰香进行了HPLC色谱分析。结果表明:椒样薄荷采用微波干燥处理,苏格兰留兰香采用风干干燥处理能够最大程度地保存样品中的多酚和总黄酮。椒样薄荷和苏格兰留兰香中均含有绿原酸、咖啡酸、对香豆酸及迷迭香酸4种酚酸。椒样薄荷在风干干燥处理下绿原酸、咖啡酸和对香豆酸含量最高,迷迭香酸含量在微波干燥处理下达最高。苏格兰留兰香在风干干燥处理下绿原酸、咖啡酸和迷迭香酸含量达最高,对香豆酸含量在热风干燥处理下达最高,但与其它两种干燥方法无显著性差异。椒样薄荷风干干燥处理下其DPPH、FRAP和TEAC抗氧化性达到最大。苏格兰留兰香风干干燥处理下其DPPH和FRAP抗氧化性达最大,而TEAC抗氧化性在微波干燥处理下达最大。
薄荷,多酚,总黄酮,HPLC,抗氧化性
椒样薄荷(Mentha piperita L.)与苏格兰留兰香(Mentha cardiaca Gerarde)均属于唇形科薄荷属芳香植物,是薄荷精油生产的主要品种。薄荷含有丰富的生物活性成分,如黄酮类、酚类、萜类、有机酸等,具有抗炎、抑菌、抗氧化等功效。
本文主要研究了不同干燥方法对椒样薄荷和苏格兰留兰香多酚和总黄酮含量及抗氧化性的影响,同时采用HPLC分析方法确定了不同干燥方法下薄荷的4种酚酸及其含量,以期寻找到一种最佳干燥方式来保留提取过程中薄荷的多酚和总黄酮成分,使其具有较高的抗氧化性,为椒样薄荷和苏格兰留兰香的多方开发利用提供依据。
1 材料与方法
1.1 供试材料
在西安市农科所三桥农业科技示范园采摘椒样薄荷和苏格兰留兰香叶片,分别采用风干干燥、热风干燥、微波干燥3种方法处理。风干干燥条件:空气温度26~32℃,空气相对湿度75%,风干干燥7 d;热风干燥:60℃烘箱中干燥5 h;微波干燥:微波功率800 W,每次干燥1 min,分4次干燥。
1.2 设备仪器
AL204电子天平仪 梅特勒-托利多仪器(上海)有限公司;RE-52AA旋转蒸发仪,上海亚荣生化仪器厂;SHZ-D(Ⅲ)循环水式真空泵,巩义市予华仪器有限公司;SHA-e恒温振荡器,金坛市富华仪器有限公司;GZX-9146MBE数显鼓风干燥箱,上海博讯实业有限公司医疗设备厂;722型 可见分光光度计,上海光谱仪器有限公司;H.H.S-91-4电热恒温水浴锅,上海医疗机械五厂;KQ-200KDE型 高功率数控超声波清洗器,昆山市超声波仪器有限公司;HHW-21CU-600电热恒温水槽,上海福玛实验设备有限公司;PHS-3C精密PH计,上海精密科学仪器有限公司。
1.3 化学试剂
甲醇、无水 Na2CO3、AlCl3(结晶)、纯 HCl、乙酸钠、冰乙酸、乙酸钾、FeCl3(以上试剂均为分析纯)。福林酚试剂(购自上海荔达生物科技有限公司)、芦丁、没食子酸、DPPH、TPTZ(购自 SIGMA公司)、BHT、绿原酸、对香豆酸、咖啡酸、迷迭香酸。
1.4 试验方法
1.4.1 提取液制备
将椒样薄荷和苏格兰留兰香用不同干燥方法干燥后粉碎、过60目筛,各取样品粉末5 g,用甲醇300 mL分3次进行超声波提取,每次30 min,超声初始温度30℃。将提取液过滤,滤液旋转蒸发至5 mL左右放入培养皿中自然挥干溶剂,用甲醇溶解并定容到10 mL,作为待测液。
1.4.2 多酚含量测定[1]
用福林法测定。吸取0.2 mL一定浓度的稀释待测液到测试管中,再加入去离子水,使总体积达到4.6 mL,加入0.1 mL福林试剂(使用前用去离子水稀释2倍)和0.3 mL 2%Na2CO3溶液,振摇试管,25℃下保温2h,760 nm下测定吸光度。多酚含量通过没食子酸标准曲线进行换算。没食子酸标准曲线y=0.0837x-0.0894,R2=0.9926,浓度范围为4~10 μg/mL,多酚含量以1 g干物质中含有的没食子酸含量(mg)表示。测定2次,取平均值。
计算公式:样品中多酚含量(mg/g)=(测定液中多酚浓度(μg/mL)×测定液体积(mL)×待测液稀释倍数×待测液定容体积(mL))/[测定时取待测液体积(μL)×称样量(g)]
1.4.3 总黄酮含量测定[2]
吸取0.2 mL一定浓度的稀释待测液与1.5 mL甲醇混合,再加入10%的FeCl30.1 mL,1 mol/L乙酸钾0.1 mL和3.1 mL去离子水。剧烈振摇,25℃下保温40 min,在415 nm下测定吸光度。总黄酮含量通过芦丁标准曲线换算,芦丁标准曲线y=0.0343x-0.0128,R2=0.9994,浓度范围为8~20 μg/mL。总黄酮含量以1 g干物质中含有的芦丁量(mg)表示。测定2次,取平均值。
计算公式:样品中总黄酮含量(mg/g)=(测定液中总黄酮浓度(μg/mL)×测定液体积(mL)×待测液稀释倍数×待测液定容体积(mL))/[测定时取待测液体积(μL)×称样量(g)]
1.4.4 HPLC测定条件
柱温:30℃;进样体积:10 μL;进样时间:60 min;流动相A:色谱纯甲醇;流动相B:1%(体积比)乙酸、10%(体积比)甲醇;梯度洗脱条件:1~2 min 30%A、2~20 min 18%A、20~60 min 30%A;检测波长:320 nm;每一次进样前,用100%的色谱甲醇冲洗色谱柱。调节完流动相比例后,平衡色谱柱30 min,然后进样。进样2次,取平均值。
通过酚酸出峰时间与标品出峰时间对照将酚酸定性,通过样品峰面积和标品峰面积的标准曲线将酚酸定量。其中,绿原酸标准曲线为:y=145904x-666270,R2=0.9926;咖啡酸标准曲线为:y=191623x-244172,R2=0.9929;对香豆酸标准曲线为:y=200682x-611203,R2=0.9912;迷迭香酸标准曲线为:y=73479x-3000000,R2=0.9959。酚酸的量表示为μg/g,干物质量。
1.4.5 体外抗氧化性评价
1.4.5.1 DPPH 自由基清除法[3]
在4.9 mL的60 μmol/L DPPH甲醇溶液中分别加入0.1 mL不同浓度的粗提物待测液,混合液剧烈振摇后在25℃下避光稳定30 min,在517 nm下测定吸光度(甲醇为参比液);对照溶液为0.1 mL甲醇。测定2次,取平均值。
DPPH·清除率/%=(1-A样品/A对照)× 100
根据不同粗提物浓度的DPPH自由基清除率计算样品的IC50值。
IC50:当DPPH自由基清除率达到50%时样品粗提物的浓度。
1.4.5.2 FRAP抗氧化评价方法[4]
FRAP反应液配置方法:300 mmol/L乙酸钠缓冲液(pH 3.6),10 mmol/L(TPTZ)溶液(40 mmol/L HCl为溶剂)以及20 mmol/L FeCl3溶液,三者体积比为10∶1∶1。FRAP每天都要现配,在使用前放置在37℃的水浴中保温。0.03 mL待测液与1.8 mL的FRAP试剂以及3.1 mL的超纯水混合。在37℃下保温30 min后在593 nm下测定吸光度,以0.03 mL甲醇与 FRAP、超纯水混合溶液作为参比液。使用FeSO4溶液标准曲线(y=0.415x-0.004,R2=0.9986,浓度范围为0.2~1 mmol/L)进行换算。FRAP值以mmol Fe(II)/g,干物质量表示。测定2次,取平均值。
1.4.5.3 TEAC抗氧化评价方法[5]
将7 mmol/L的ABTS溶液与2.45 mmol/L的过硫酸钾溶液混合反应来制备ABTS自由基溶液(ABTS+·),使用前将ABTS+·溶液在室温下黑暗中放置12~16 h,并将溶液用甲醇稀释到吸光度测定为0.70±0.02(734 nm下)。将2 mL稀释的ABTS+·溶液与25 μL待测液混合后,反应6 min,在734 nm下测定吸光度。BHT作为对照。用水溶性维生素E的标准曲线(y=-0.0005x+0.6633,R2=0.9931,浓度范围为100~1000 μmol/L)进行换算 ,结果值用μmol水溶性维生素E/g,干物质量表示。
2 结果与分析
2.1 不同干燥方法下薄荷样品多酚和总黄酮含量
比较不同干燥方法下椒样薄荷和苏格兰留兰香的多酚和总黄酮含量,结果见表1。
从表1可以看出,椒样薄荷微波干燥处理的多酚含量最高,达7.91 mg(没食子酸)/g(干物质量),热风干燥的多酚含量最少,3种干燥方法的多酚含量没有显著性差异;椒样薄荷微波干燥处理总黄酮含量最多,达23.10 mg(芦丁)/g(干物质量),风干干燥处理的总黄酮含量最少,且3种处理的总黄酮含量差异显著;苏格兰留兰香风干干燥处理多酚含量最高,达7.60 mg(没食子酸)/g(干物质量),热风干燥处理多酚含量最少,并且3种处理的多酚含量差异显著。苏格兰留兰香风干干燥处理总黄酮含量最高,达29.60 mg(芦丁)/g(干物质量),微波干燥处理总黄酮含量最少,3种不同干燥方法的总黄酮含量达到显著性差异。
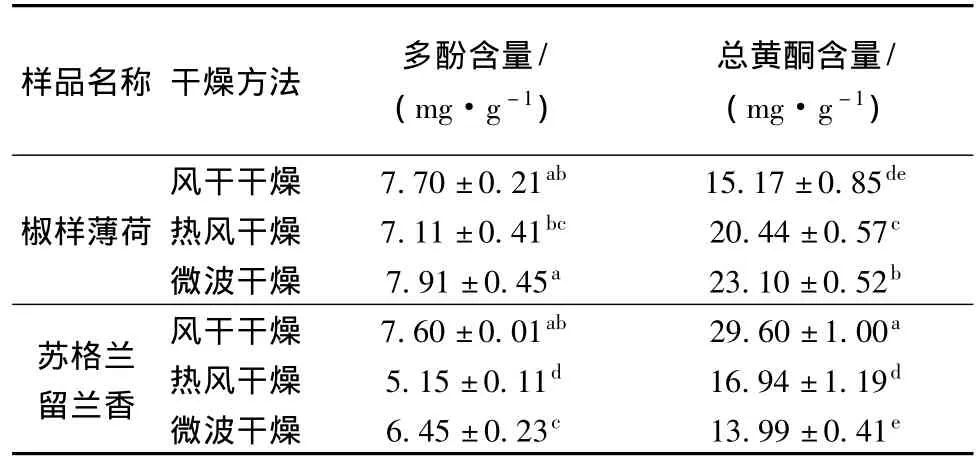
表1 不同干燥方法下多酚、总黄酮含量
结果说明,对于椒样薄荷,为了最大程度得保存样品中的多酚和总黄酮,最好采用微波干燥处理方法。而对于苏格兰留兰香,风干干燥方法能够最大程度得保存样品中的多酚和总黄酮,这主要和椒样薄荷与苏格兰留兰香所含酚酸以及黄酮种类不同有关。
2.2 不同干燥方法下薄荷样品HPLC图谱及酚酸含量分析
2.2.1 不同干燥方法下薄荷样品HPLC图谱
图1、图2、图3为混标和不同干燥方法下薄荷样品的HPLC图谱。
从图1可以看出,绿原酸,咖啡酸,对香豆酸及迷迭香酸四种标品的出峰时间分别为7、12、20和46 min,从图2和图3可以看出,椒样薄荷和苏格兰留兰香中均含有绿原酸、咖啡酸、对香豆酸及迷迭香酸。

图1 混标的HPLC色谱图

图2 椒样薄荷的HPLC色谱图

图3 苏格兰留兰香的HPLC色谱图
2.2.2 不同干燥方法下薄荷样品中酚酸含量分析
不同干燥方法下薄荷样品中酚酸含量结果见表2。

表2 不同干燥方法下酚酸含量
从表2可以看出,风干干燥处理的椒样薄荷其绿原酸、咖啡酸、对香豆酸含量最高,分别为189.61、56.08、247.02 μg/g(干物质量),且与其余2种干燥方法的差异显著;而迷迭香酸含量则是微波干燥处理的最高,为2135.90 μg/g(干物质量),与其他2种干燥方法差异显著。
对于苏格兰留兰香,风干干燥处理的绿原酸、咖啡酸、迷迭香酸含量最高,分别为207.40、71.16、2043.12 μg/g(干物质量),相较其它两种干燥方法,达显著性差异;热风干燥处理下,对香豆酸含量最高,但相较其它两种干燥方法,无显著性差异。
椒样薄荷中的迷迭香酸在微波干燥处理下最高,而苏格兰留兰香中的迷迭香酸在风干干燥处理下最高可能是由于椒样薄荷与苏格兰留兰香物料特性不同而导致微波干燥效率不同。
2.3 体外抗氧化性比较
比较不同干燥方法下薄荷的抗氧化性,结果见表3。

表3 不同干燥方法下样品的抗氧化性
从表3可以看出,对于椒样薄荷,风干干燥处理下,样品的 IC50值最小,为2.07 mg/mL,即 DPPH抗氧化性最强,FRAP值最大,为7.95 mmol Fe(II)/g(干物质量),表示其还原三价铁离子为二价铁离子的能力最强,即FRAP抗氧化性最强;并且与其余2种干燥方法的差异均为显著;TEAC值最大,为2550.52 μmol水溶性维生素 E/g(干物质量),即TEAC抗氧化性最强,与微波干燥处理达显著性差异。综合来看,椒样薄荷进行风干干燥处理能够更好的体现它的DPPH、FRAP和TEAC抗氧化能力。
对于苏格兰留兰香,风干干燥处理下,样品的IC50值最小,为1.73 mg/mL;FRAP值最大,为7.53 mmol Fe(II)/g(干物质量),相较其他2种干燥方法均为显著性差异。而微波干燥处理下样品的TEAC值最大,为2497.06 μmol(水溶性 VE)/g(干物质量),相较其他2种干燥方法,达显著性差异。综合来看,苏格兰留兰香风干干燥处理能够更好地体现它的DPPH和FRAP抗氧化能力,而微波干燥处理能够更好的体现它的TEAC抗氧化能力,这可能是由于微波干燥处理更好得保留了苏格兰留兰香中对TEAC抗氧化能力起主要作用的活性物质。
3 结论
(1)椒样薄荷微波干燥处理多酚含量最高,但3种干燥处理的多酚含量没有显著性差异。椒样薄荷微波干燥处理总黄酮含量最多,且3种处理的总黄酮含量达到显著性差异。微波干燥方法能够最大程度得保存样品中的多酚和总黄酮。
(2)苏格兰留兰香风干干燥处理多酚和总黄酮含量最高,且3种处理多酚和总黄酮含量达到显著性差异。对于苏格兰留兰香,风干干燥方法能够最大程度得保存样品中的多酚和总黄酮。
(3)椒样薄荷在风干干燥处理下绿原酸、咖啡酸和对香豆酸含量最高,只有迷迭香酸含量在微波干燥处理下达最高。苏格兰留兰香在风干干燥处理下绿原酸、咖啡酸和迷迭香酸含量达最高,对香豆酸含量在热风干燥处理下达最高,但与其他2种干燥方法无显著性差异。
(4)椒样薄荷风干干燥处理下其DPPH、FRAP和TEAC抗氧化能力达到最大;苏格兰留兰香风干干燥处理下其DPPH和FRAP抗氧化能力达到最大,而TEAC抗氧化能力在微波干燥处理下达最大。
[1]Slinkard K,Singleton V L.Total phenol analysis:automation and comparison with manual methods[J].American Journal of Enology and Viticulture,1977,28:49-55.
[2]Bor J Y,Chen H Y,Yen G C.Evaluation of antioxidantactivity and inhibitory effect on nitric oxide production of some common vegetables[J].Journal of Agricultural and Food Chemistry,2006,54:1680-1686.
[3]Brand-Williams W,Cuvelier M E,Berset C.Use of a free radical method to evaluate antioxidant activity[J].Food Science and Technology Lebensmittel-Wissenschaft und Technologie,1995,28:25-30.
[4]Netzel M,Netzel G,Tian Q,et al.Sources of antioxidant activity in Australian native fruits.identification and quantification of anthocyanins.[J].Agric Food Chem,2006,54:9820-9826.
[5]Re R,Pellegrini N,Proteggente A,et al.Antioxidant activity applying an improved ABTS radical cation decolorization assay[J].Free Radical Biology and Medicine,1999,26:1231-1237.
ABSTRACTThe content of polyphenol,total flavonoids and antioxidant activity of mints by different drying method were studied and the HPLC chromatographic analysis was applied.The results showed that the microwave drying to peppermint and air drying to Scotland spearmint were the best drying method to keep the content of polyphenol and total flavonoids.Chlorogenic acid,caffeic acid,p-coumaric acid and rosmarinic acid were detected in peppermint and scotland spearmint.In peppermint,chlorogenic acid,caffeic acid and p-coumaric acid had the highest content under air drying and rosmarinic acid had the highest content under microwave drying.For scotland spearmint,chlorogenic acid,caffeic acid and rosmarinic acid had the highest content under air drying process.p-coumaric acid had the highest content under hot air drying ,but had no significant difference with the other two drying methods.The antioxidant activity of peppermint reached maximum under air drying process in DPPH,FRAP and TEAC assay.The antioxidant activity of Scotland spearmint reached maximum under air drying in DPPH and FRAP assay,TEAC antioxidant activity reached maximum under microwave drying.
Key wordsmint,polyphenol,total flavonoids,HPLC,antioxidant activity
The Effect on the Content of Polyphenol,Total Flavonoids and Antioxidant Activity in Mint of Different Drying Method
Lv Shuang1,2,Tian Cheng-rui1,Shi Hui1
1(College of Food Engineering and Nutritional Science,Shannxi Normal University,Xi’an 710062,China)
2(Xi’an Agricultural Technology Extension Centre,Xi’an 710065,China)
硕士研究生(田呈瑞教授为通讯作者)。
*国家星火计划项目“美国薄荷种植加工基地建设及产业化开发”(2007EA851010)
2012-03-21,改回日期:2012-05-03

