对乙酰氨基酚在铁氰化铜修饰电极上的电化学行为研究
徐 雯,张莉艳
(黄山学院化学化工学院,安徽黄山245041)
对乙酰氨基酚在铁氰化铜修饰电极上的电化学行为研究
徐 雯,张莉艳
(黄山学院化学化工学院,安徽黄山245041)
用循环伏安法制备了铁氰化铜修饰玻碳电极,并研究了对乙酰氨基酚在该修饰电极上的电化学行为。结果表明,在pH=6.86的磷酸缓冲溶液中,对乙酰氨基酚在铁氰化铜修饰电极上0.437V处出现一氧化峰,与裸玻碳电极相比氧化峰电位负移了81mV。对乙酰氨基酚浓度在4×10-5-1×10-3mol/L范围内,其氧化峰电流与浓度呈现很好的线性关系,其相关系数是0.9993,检出限为1×10-5mol/L。
铁氰化铜;修饰电极;对乙酰氨基酚;循环伏安法
1 引言
对乙酰氨基酚(即扑热息痛)为芳环对位取代的芳氨类药物,有解热、镇痛作用,在中西药及其制剂中使用广泛,适用于感冒发烧、关节痛、神经痛及偏头痛、癌性痛及手术后止痛。[1]但过多服用对乙酰氨基酚对人体会造成伤害,出现恶心、呕吐、厌食、出汗、腹痛等症状。[2]因此,建立对乙酰氨基酚的灵敏检测方法是非常必要的。当前用于检测对乙酰氨基酚的方法主要有滴定法[3]、分光光度法[4]、高效液相色谱法[5]以及电化学方法。[6~8]除电化学方法外,其他的方法需要复杂的前处理过程,因此不便于快速检测对乙酰氨基酚。而电化学方法中,修饰电极的研究为对乙酰氨基酚的检测提供了快速、简便的方法。
本文采用电化学沉积法制备了铁氰化铜(CuHCF)修饰电极,并研究了对乙酰氨基酚在该修饰电极上的电化学行为。对乙酰氨基酚在裸玻碳电极上有较高的氧化电位,而在CuHCF修饰玻碳电极上发生明显的负移,说明该电极对对乙酰氨基酚氧化有较好的电催化作用。
2 实验部分
2.1 仪器与试剂
LK2005型电化学工作站(天津市兰力科化学电子高技术有限公司),3电极体系:工作电极为玻碳电极和CuHCF修饰玻碳电极,对电极为铂电极,参比电极为饱和甘汞电极(SCE);精密pH计(PHS-3C,上海雷磁新泾仪器有限公司)和超声波清洗器(KQ2200型,昆山市超声仪器有限公司)。
对乙酰氨基酚为化学纯(中国医药集团上海化学试剂公司),其余试剂均为分析纯,实验用水为二次蒸馏水。
2.2 CuHCF修饰电极的制备
将玻碳电极用砂纸(2000目)、0.05μmAl2O3粉抛光至镜面,依次用二次水、无水乙醇、二次水超声清洗各1min。
准确配制100ml1×10-3mol/LCuCl2溶液以及100ml含1×10-3mol/LK3Fe(CN)6和0.1mol/L KCl的混合溶液,然后取20mlCuCl2溶液和20mlK3Fe(CN)6、KCl的混合溶液配成电解质溶液,并用0.1mol/L的稀盐酸将其pH值调至2左右。
将处理好的玻碳电极至于上述电解质溶液中,饱和甘汞电极为参比电极,铂片为对电极组成3电极体系,在0.0-1.0V电位范围内以50mV/s的速度进行循环伏安扫描一定的圈数,即得CuHCF修饰电极。
2.3 实验方法
采用3电极体系,在选定的电位范围内记录循环伏安曲线,所有实验均在室温条件下进行。
3 结果与讨论
3.1 CuHCF膜的形成过程
图1是CuHCF在玻碳电极上发生聚合的循环伏安图。从图中可以看出,随着扫描次数的增加,氧化和还原电流逐渐增大,氧化还原峰的峰形变得尖锐起来,表明有吸附物质生成,CuHCF在电极表面沉积形成膜。当扫描至25圈的时候,电流不再增加,说明电极表面已达到饱和。如果继续沉积,膜越来越厚,将使电极表面电子传递速度减慢,导致峰电流降低。因此,我们选择的聚合圈数是25圈。

图1 CuHCF聚合过程的循环伏安图,扫描速度50mV/s
3.2 CuHCF修饰电极的电化学行为研究
分别以裸玻碳电极(a)和CuHCF修饰电极(b)为工作电极在0.1mol/LKCl溶液中进行循环伏安扫描,结果如图2所示。对比图中的a、b曲线可以看出,CuHCF修饰电极在0.2V和0.6V附近各有一对氧化还原峰,这两对峰表示为如下的反应:进一步说明了在玻碳电极表面形成了CuHC膜。

图2 裸电极(a)和CuHCF修饰电极(b)在0.1mol/LKCl溶液中的CV图,扫描速度50mv/s
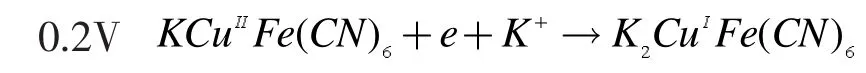

3.2 对乙酰氨基酚在CuHCF修饰电极上的电化学行为

图3 对乙酰氨基酚在裸电极(a)和CuHCF修饰电极(b)上的CV图,扫速50mv/s
图3是裸玻碳电极(曲线a)和CuHCF修饰电极(曲线b)在含有1×10-4mol/L对乙酰氨基酚的0.1mol/L磷酸缓冲溶液(pH=6.86)中的循环伏安图由图2可知,对乙酰氨基酚在裸玻碳电极上氧化峰电位为0.518V,而在CuHCF修饰电极上的氧化峰电位为0.437V,与裸玻碳电极相比氧化峰电位负移了81mV,说明该电极对对乙酰基酚有较好的电催化作用。
3.3 扫描速率的影响
考察不同扫描速率下CuHCF修饰电极在含有1×10-4mol/L对乙酰氨基酚的0.1mol/L磷酸缓冲溶液(pH=6.86)中的循环伏安曲线,发现对乙酰基酚的氧化峰电位随着描速率的增大,向电位增加的方向移动,氧化峰电流也随之增大。在0.02-0.18V/s扫描速率范围内,对乙酰基酚的氧化峰电流与扫描速率的平方根υ1/2之间有极好的线性关系,如图4所示,线性方程为ip=-0.0019+7.9022υ1/2,R=0.9970,说明对乙酰氨基酚的氧化是一个扩散控制过程。

图4 氧化峰电流与扫描速率平方根之间的关系
3.4 浓度的影响
图5是CuHCF修饰电极在含有不同浓度对乙酰氨基酚的磷酸缓冲溶液(pH=6.86)中的循环伏安曲线上的氧化峰电流与浓度的关系曲线。由图可知,对乙酰氨基酚在4×10-5-1×10-3mol/L范围内的浓度与氧化峰电流呈现较好的线性关系,线性方程为ip=0.5751+18870.1c,R=0.9993,检出限为1×10-5mol/L。

图5 CuHCF修饰电极在含不同浓度的对乙酰氨基酚的磷酸缓冲溶液(pH=6.86)中的氧化峰电流与浓度关系图,扫描速率为50mV/s。
3.5 电极的重现性与稳定性
将CuHCF修饰电极对浓度为1×10-4mol/L的对乙酰氨基酚试液连续测定5次,氧化峰的电流值分别为2.56μA、3.05μA、2.72μA、3.12μA、2.94μA,相对标准偏差RSD为0.081%,表明该修饰电极的重现性较好。将修饰电极在同一溶液中连续扫50圈,峰电流基本不变,说明该电极稳定性较好。
4 结论
用循环伏安法在0.0-1.0V的电位范围内连续扫描25圈制得CuHCF修饰电极,并用该修饰电极测定了对乙酰氨基酚。结果表明,对乙酰氨基酚在CuHCF修饰电极上发生不可逆反应,氧化峰电位相对于裸玻碳电极负移了81mV,说明修饰电极对对乙酰基酚有较好的催化作用。对乙酰氨基酚浓度在4×10-5-1×10-3mol/L范围内,其氧化峰电流与浓度呈现很好的线性关系,其相关系数是0.9993,检出限为1×10-5mol/L。
[1]徐小薇.对乙酰氨基酚及复方制剂[J].中国药房,2001,12(2):123-124.
[2]金慧萍,李中东,焦正.对乙酰氨基酚的不良反应与合理使用[J].药物不良反应杂志,2004,6(1):27-31.
[3]谢笑英,黄文峰.中成药中对乙酰氨基酚含量测定的4种方法及比较[J].河北医学,2005,11(6):563-565.
[4]徐春梅.紫外分光光度法测定氨咖黄敏胶囊中对乙酰氨基酚含量[J].延安大学学报(医学科学版),2006,4(2):6.
[5]林绍乐.HPLC法测定康必得中对乙酰氨基酚的含量[J].海峡药学,2004,16(4):71-72.
[6]罗红斌,张亚锋,陈伟,等.对乙酰氨基酚在聚刚果红修饰电极上的伏安测定[J].电化学,2006,12(3):329-332.
[7]M.Houshmand,A.Jabbari,H.Heli,M.Hajjizadeh and A.A.Moosavi-Movahedi.Electrocatacatalytic oxidation of aspirinandaccetaminophenonacobalthydroxide nanoparticle modified glassy carbon electrode[J].Journal of Solid State Electrochemistry,2008,12(9):1117-1128.
[8]Zeid Abdullah Alothman,Nausheen Bukhari,Saikh Mohammad Wabaidur,Sajjad Haider..Simultaneous electrochemical determination of dopamine and acetaminophen using multiwall carbon nanotubes modified glassy carbon electrode[J].Sensors and Actuators B:Chemical,2010,146(1):314-320.
责任编辑:胡德明
Abstract:Cuprichexacyanoferratemodifiedglassycarbonelectrodeispreparedwithcyclic voltammogram method,and the electrochemcal behavior of acetamin-ophen at the modified electrode is studied.Experimental results show that an oxidation peak is observed at about 0.437 V in 0.1 mol/L phosphate buffer solution(pH=6.86),which shifts negatively by 81mV on the Cupric hexacyanoferrate modified electrode compared with the corresponding bare electrode.The oxidation peak current is wellproportional to the concentration of acetaminophen over the range from 4×10-5~1×10-3mol/L by cyclic voltammetry,with the correlation coefficient of 0.9993.The detection limit of aceta-minophen is estimated to be 1.0×10-5mol/L.
Key Words:cupric hexacyanoferrate;modified electrode;acetaminophen;cyclic voltammetry
Electrochemical Behavior of Acetaminophen at Cupric Hexacyanoferrate Modified Electrode
Xu Wen,Zhang Liyan
(School of Chemistry and Chemical Engineering,Huangshan University,Huangshan245041,China)
O646
A
1672-447X(2012)03-0045-003
2011-10-25
黄山学院自然科学研究项目(2010xkj016)
徐雯(1978–),安徽休宁人,黄山学院化学化工学院讲师,研究方向为电化学。

