响应面法优化仿栗籽蛋白提取工艺
黄 伟,麻成金,*,黄 群,苏 超,冯 磊
(1.吉首大学植物资源保护与利用湖南省高校重点实验室,湖南吉首416000;2.吉首大学食品科学研究所,湖南吉首416000)
响应面法优化仿栗籽蛋白提取工艺
黄 伟1,2,麻成金1,2,*,黄 群2,苏 超2,冯 磊2
(1.吉首大学植物资源保护与利用湖南省高校重点实验室,湖南吉首416000;2.吉首大学食品科学研究所,湖南吉首416000)
研究了仿栗籽蛋白的碱溶酸沉法提取工艺。在单因素实验的基础上,选定提取温度、pH、提取时间、液料比四个因素的三个水平进行中心组合实验,建立了仿栗籽蛋白提取率的二次回归方程,通过响应面分析以及岭嵴分析得到了优化组合条件。实验结果表明,当提取工艺条件为pH9.6、温度42℃、时间138min、料液比1∶25(g/mL)时,仿栗籽蛋白提取率为64.97%。
仿栗籽蛋白,碱提酸沉,响应面法,提取工艺
Abstract:The extraction of protein from the sloanea hemsleyana seed by alkaline extraction and acid precipitation was studied.According to the single-factor experiments,three levels of the factors(extraction temperature,extraction time,pH and material/liquid ratio) were selected for the central composite design to establish a quadric regression equation for describing the yield of sloanea hemsleyana seed protein.By response surface analysis,the optimum extraction conditions were obtained as follows:extraction temperature of 42℃,time of 138min,pH9.6 and material/liquid ratio of 1∶25(g/mL),under which the highest yield of sloanea hemsleyana seed protein reached 64.97%.
Key words:sloanea hemsleyana seed protein;alkaline extraction and acid precipitation;response surface methodology;extraction process
仿栗(Sloanea hemsleyana(Ito)Rehd.et Wils)系杜英科猴欢喜属常绿乔木,生长在海拔500~1400m的山谷林中,国内主要分布于南亚热带至中亚热带的湘、鄂、川、滇、黔、桂等地区,国外仅越南等部分东南亚国家有分布[1-2]。湖南省湘西、湘北地区分布有大面积的野生仿栗混交林和散生林,目前我国一些地区已建立了一定规模的仿栗人工林基地,仿栗资源丰富[3]。仿栗籽是仿栗果实脱壳去假种衣后得到的种仁,其含油率最高可达58%,可以用来制备生物柴油原料油和高级食用植物油,脱脂后的籽粕还含有丰富的蛋白质(约为20%~25%),具有较高的开发和利用价值[2-3]。目前,国内外关于仿栗的研究主要集中在对其生物学特性及果实油脂的提取与应用等方面,尚未见相关仿栗籽蛋白的研究报道[3]。本实验以仿栗籽粕为研究对象,通过响应面分析法对碱溶酸沉法提取仿栗籽蛋白的工艺条件进行了优化,以期为仿栗籽的综合开发利用提供实验依据。
1 材料与方法
1.1 材料与仪器
仿栗籽粕 2011年10月初采摘于吉首大学新校区内,常温脱脂后过60目筛,蛋白质21.27%;牛血清蛋白标准品、考马斯亮蓝(分析纯) 美国AMRESCO公司;透析袋(分子截留量8000~14000) 美国Sigma公司;石油醚、盐酸、氢氧化钾、五水硫酸铜、硫酸钾、硼酸、硫酸、磷酸等 均为国产分析纯。
CDE-220E2多功能食品处理机 佛山市顺德区欧科电器有限公司;JA5103N高精度电子天平、721分光光度计 上海民桥精密科学仪器有限公司;GZX-9146MBE电热鼓风干燥箱 上海博迅实业有限公司;THZ-82A水浴恒温振荡器 金坛市顺华仪器有限公司;PHS-25数字式pH计 上海伟业仪器厂;LXJ-ⅡB飞鸽牌离心机 上海安亭科学仪器厂;FD5-2.5冻干机 西盟生命技术有限公司;凯氏定氮装置等。
1.2 实验方法
1.2.1 工艺流程 仿栗籽→粉碎→过筛→脱脂→干燥→仿栗籽粕→碱液浸提→离心分离→上清液→酸沉→离心分离→透析→干燥→仿栗籽粗蛋白粉
1.2.2 操作要点
1.2.2.1 原料预处理 仿栗籽经干燥粉碎后用环己烷按1∶7的料液比置于水浴恒温振荡器中常温振荡脱脂4h,抽滤分离后置于通风厨中12h以挥发残余溶剂,得仿栗籽粕,过60目筛后于冰箱4℃保存备用。
1.2.2.2 仿栗籽蛋白制备 取一定量仿栗籽粕与去离子水按一定料液比混合,用1mol/L NaOH调至一定pH,于一定温度下水浴恒温振荡浸提一段时间,4500r/min离心20min,分离上清液,用1mol/L的HCl调至等电点(pH4.5),4000r/min离心15min后分离得到蛋白凝乳,用去离子水透析48h后,进行真空干燥,即可得到仿栗籽粗蛋白粉。
1.2.3 蛋白质含量的测定 原料中粗蛋白含量测定采用半微量凯氏定氮法,参照GB5009.5-2003;上清液中蛋白含量测定采用考马斯亮蓝法[4],以牛血清蛋白为标准,标准曲线如图1所示。
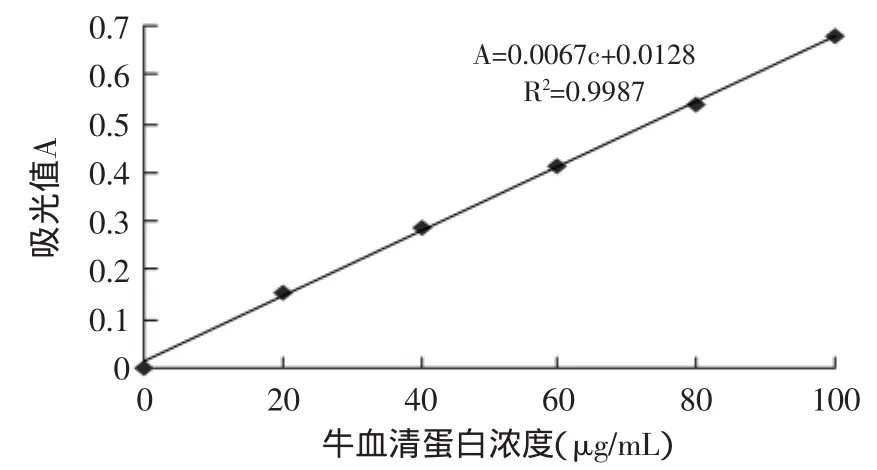
图1 牛血清蛋白标准曲线Fig.1 The standard curve of bovine serum albumin
1.2.4 蛋白提取率的计算

1.2.5 单因素实验 以蛋白提取率为指标,分别对pH(8、8.5、9、9.5、10、10.5、11)、提取温度(30、40、50、60、70℃)、提取时间(30、60、90、120、150、180min)、液料比(1∶10、1∶15、1∶20、1∶25、1∶30、1∶35、1∶40(g/mL))进行单因素实验,每组实验重复3次,结果取其平均值,探讨各因素变化对仿栗籽蛋白提取率的影响。
1.2.6 中心组合实验 在单因素实验基础上,确定中心组合实验因素与水平(见表1),以蛋白提取率为响应值,通过SAS8.1软件对实验结果进行响应面分析及岭嵴分析,对仿栗籽蛋白提取工艺参数进行优化[5-7]。
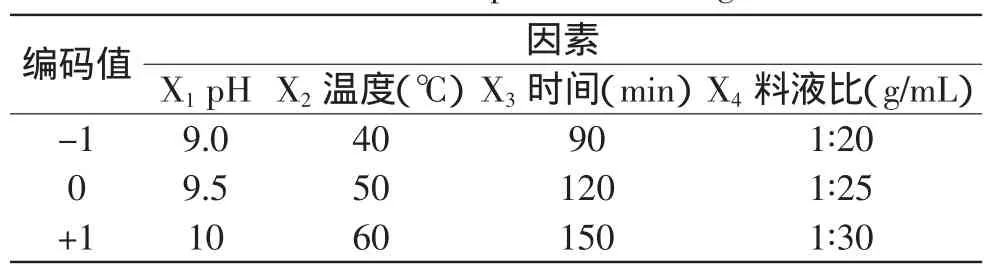
表1 Box-Behnken中心组合实验因素水平表Table 1 Experimental variables and levels for the Box-Behnken experimental design
2 结果与分析
2.1 单因素实验结果与分析
2.1.1 pH对蛋白提取率的影响 取5g仿栗籽粕,设定提取温度50℃、料液比1∶20(g/mL)、提取时间120min,不同浸提pH对仿栗籽蛋白提取率的影响如图2所示。
由图2可知,在碱性环境中仿栗籽蛋白质提取率随pH升高不断增大,当pH超过9.5后提取率变化不大。这是因为碱液使仿栗籽蛋白发生酸式解离而带负电荷,蛋白质分子间互相排斥,分散性好,对蛋白质分子有增溶作用,这种增溶作用随着pH的升高而增大;但pH过高会导致蛋白质分子间发生缩合反应,生成异味物质和有害物质[8-9]。因此,为保证提取的仿栗籽蛋白的品质,pH控制在9.5左右为宜。
2.1.2 提取温度对蛋白提取率的影响 取5g仿栗籽粕,设定浸提pH9.0、料液比1∶20(g/mL)、提取时间120min,不同提取温度对仿栗籽蛋白提取率的影响如图3所示。
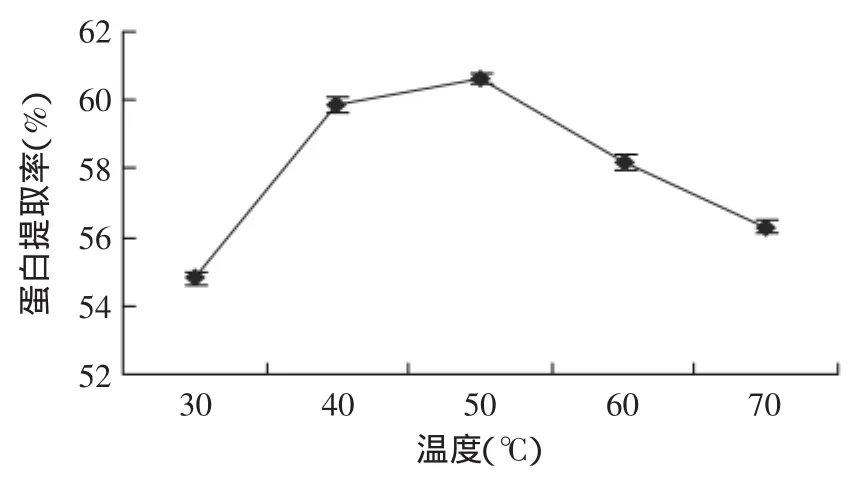
图3 温度对蛋白提取率的影响Fig.3 Effect of extraction temperature on protein yield
由图3可知,仿栗籽蛋白质提取率随温度升高先增加后减少,50℃时仿栗籽蛋白提取率最大。这是因为在较低温范围内随着温度的升高,蛋白质分子的构象发生轻微改变,分子的立体结构变得伸展,有利于蛋白质分子和水分子的运动及其相互作用,从而使蛋白提取率增加;但当温度超过50℃后,维持蛋白质空间构象的次级键被破坏,引起天然构象的解体,原来在分子内部的一些疏水基团被暴露到分子表面,导致蛋白质分子间的相互结合而凝结沉淀,蛋白提取率降低[10-11]。故提取温度宜控制在50℃左右。
2.1.3 提取时间对蛋白提取率的影响 取5g仿栗籽粕,设定提取温度50℃、浸提pH 9.0、料液比1∶20g/mL,不同提取时间对仿栗籽蛋白提取率的影响如图4所示。
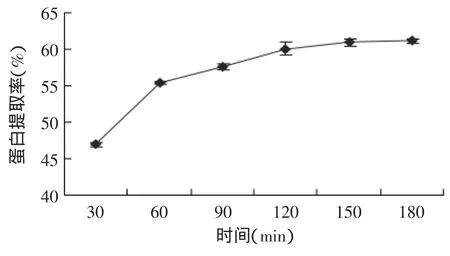
图4 时间对蛋白提取率的影响Fig.4 Effect of extraction time on protein yield
从图4可知,在一定条件下,蛋白质的提取率随着提取时间延长而增大,当浸提时间超过120min后,蛋白质的溶出基本达到动态平衡[12],提取率趋于平稳,此时,延长提取时间对提取率的影响不大。因此,综合各种因素,选择提取时间为120min较佳。
2.1.4 料液比对蛋白提取率的影响 取5g仿栗籽粕,设定提取温度50℃、浸提pH9.0、提取时间120min,不同料液比对仿栗籽蛋白提取率的影响如图5所示。
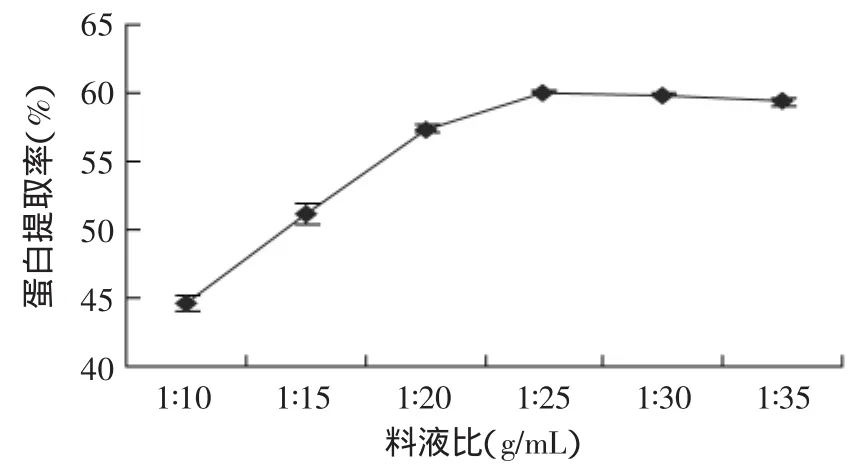
图5 料液比对蛋白提取率的影响Fig.5 Effect of material/liquid ratio on protein yield
从图5可知,仿栗籽蛋白提取率随着料液比的增大而增加,当料液比超过1∶25后,随料液比的增大,提取率趋于平稳。这是因为当料液比较低时,溶液的黏度较大,蛋白质不能充分浸润,分子扩散速率低,从而影响了传质过程;但料液比过大会增加水的消耗及后续的浓缩成本,对实际生产意义不大[13-14]。因此,选择料液比为1∶25较为适宜。
2.2 中心组合实验结果与分析
2.2.1 中心组合实验结果与响应面分析 根据Box-Benhnken中心组合实验设计原理,依据上述单因素实验结果,确定pH(X1)、温度(X2)、时间(X3)和料液比(X4)四个因素水平,以仿栗籽蛋白提取率(Y)为指标,设计四因素三水平的Box-Benhnken中心组合实验。实验设计方案及结果见表2,每组实验重复3次,取其平均值为实验结果。
通过SAS软件的RSREG程序对实验结果进行响应面分析,经二次回归拟合后求得响应函数,即回归方程为:
Y=63.5-0.914167X1-0.89X2-0.5425X3-0.643333X4-0.745833X12-1.279583X22-0.923333X32-3.232083X42-1.215X1X2+1.8825X1X3-0.175X1X4-3.91X2X3-0.585X2X4+0.935X3X4
为说明回归方程的有效性及各因素对提取率的影响程度,对该方程及各因素进行方差分析,结果见表3。
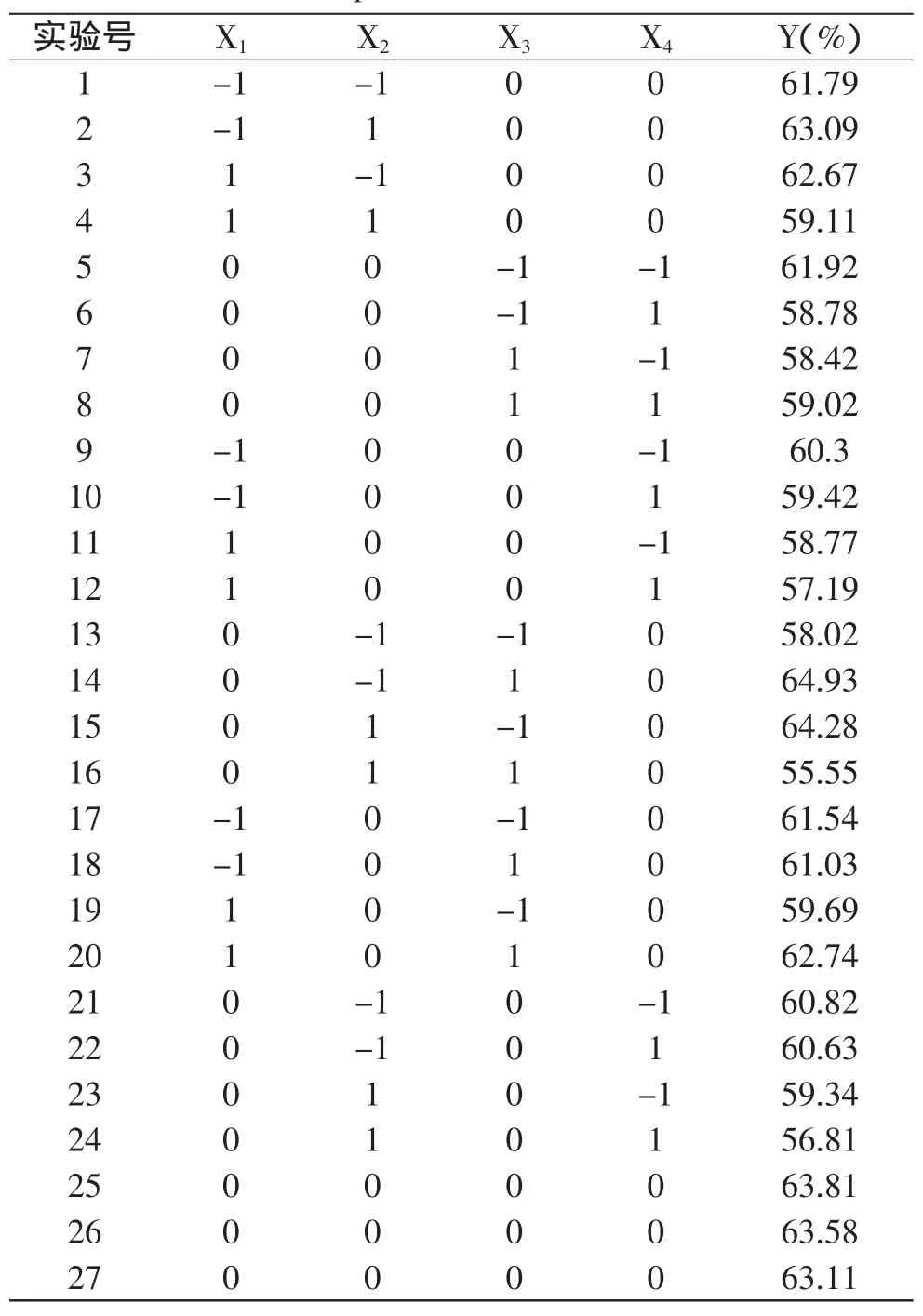
表2 Box-Behnken中心组合实验设计方案及结果Table 2 Box-Behnken experimental design arrangement and experimental results
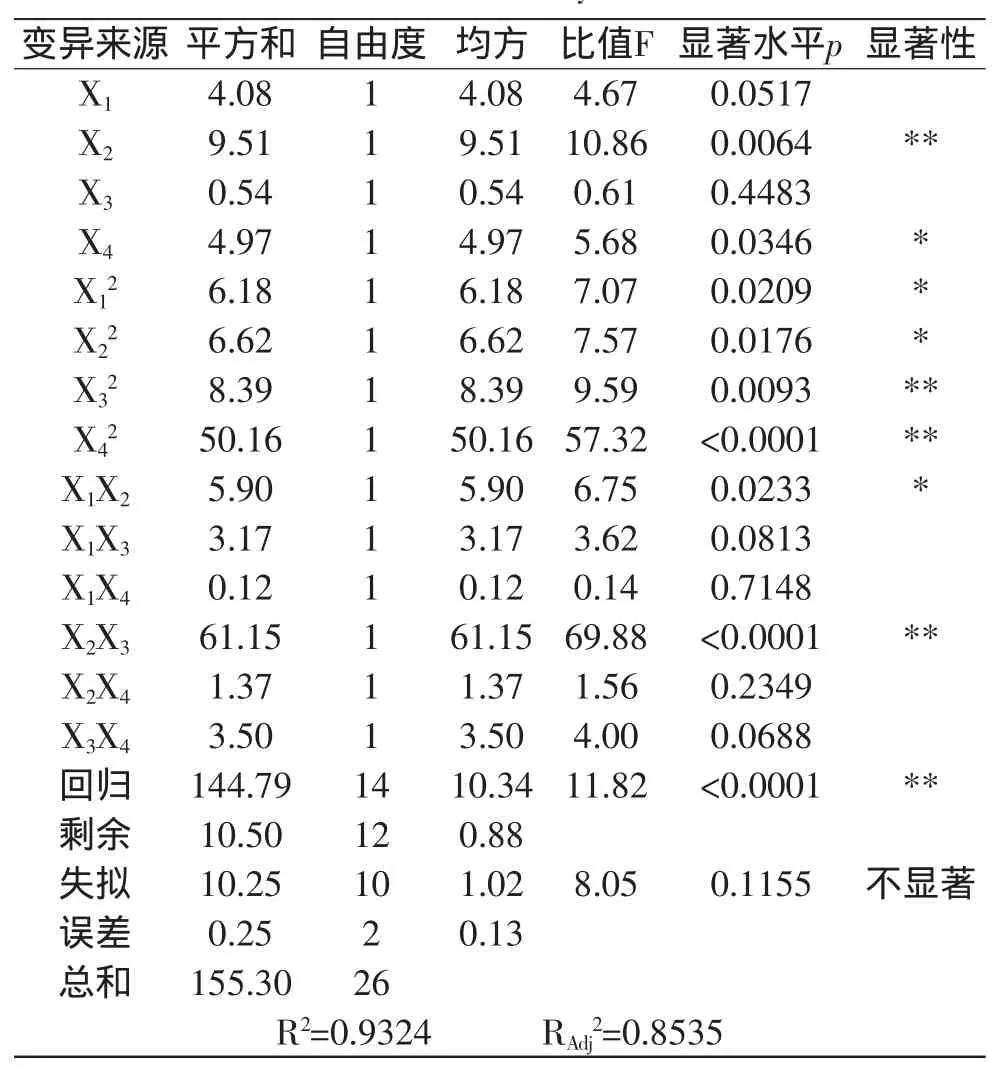
表3 方差分析Table 3 Variance analysis of results
从表3可知,回归决定系数R2=0.9324,说明响应值的变化有93.24%来源于所选因素的变化,模型修正决定系数R2Adj=0.8535,说明该模型能解释85.35%响应值的变化,回归方程的显著性检验极显著,失拟性检验不显著,表明方程对实验拟合情况很好,可用该回归方程代替实验真实点对实验结果进行分析。从方差分析表中各因素的F值可以看出,各因素对仿栗籽蛋白提取率影响大小顺序为:温度>料液比>pH>时间,且温度、料液比分别对仿栗籽蛋白提取率的影响达到了极显著与显著水平。
根据表3的分析结果,作出各显著交互因素的响应曲面图(图6、图7)。由图6、图7及方差分析可得出,浸提pH、提取时间与提取温度因素间的交互作用对仿栗籽蛋白提取率的影响最大,浸提pH与提取温度的交互作用对仿栗籽蛋白提取率的效应相关性呈山丘形曲面,它们之间的交互作用达到了显著水平,提取温度与提取时间的交互作用对仿栗籽蛋白提取率的效应相关性呈马鞍形曲面,它们之间的交互作用达到了极显著水平。由图6可知,浸提pH一定时,蛋白提取率随着温度的升高呈先增加后下降的趋势,且下降趋势随pH的增加越来越明显,这说明提取温度升高有利于蛋白提取,但高温容易使蛋白发生变性,造成提取率下降[15];由图7可知,当提取温度较低时,延长提取时间,可获得较高的蛋白提取率,但当提取温度较高时,延长提取时间,蛋白提取率反而降低,这可能是因为长时间的高温导致蛋白变性引起的[8]。
2.2.2 典型分析 典型分析结果可以判断方程是否有极值存在,当特征值均为正值时,响应面分析图为山谷形曲面,有极小值存在;当特征值为负值时,为山丘曲面,有极大值存在;当特征值有正有负时,为马鞍形曲面,无极值存在[16]。为了确定最佳提取条件,通过SAS软件对回归方程进行典型分析,结果见表4。
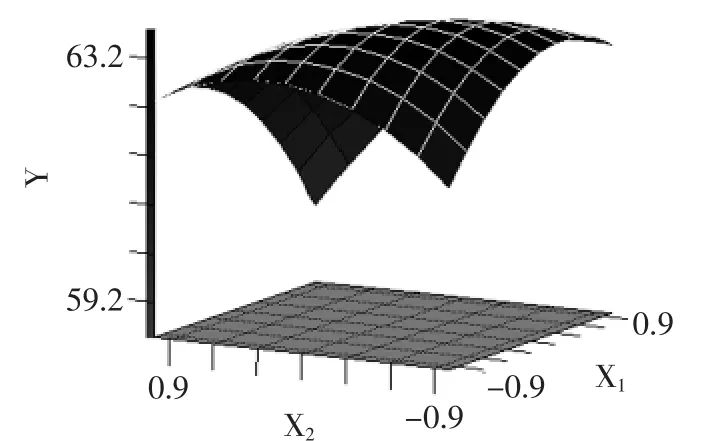
图6 Y=f(X1,X2)的响应面图Fig.6 Response surface showing the interactive effects of pH and extraction temperature on protein yield
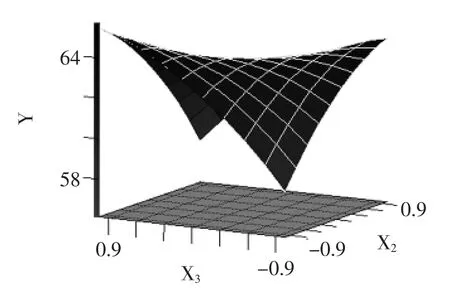
图7 Y=f(X2,X3)的响应面图Fig.7 Response surface showing the interactive effects of length of extraction time and extraction temperature on protein yield
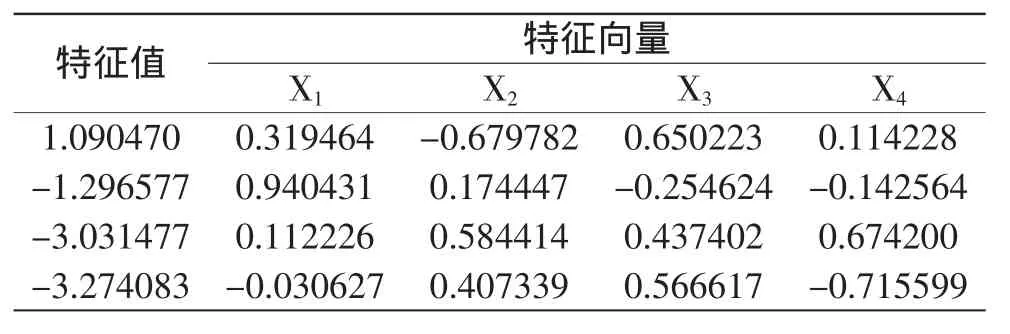
表4 典型分析表Table 4 Canonical analysis
从表4可以看出,4个因素的特征值有正有负,表明此二次响应面是鞍面,无极值存在,这与以上响应面图的直观显示结果是一致的。因此不能直接从二次响应面上找出最佳工艺参数,需要进一步作岭嵴分析。
2.2.3 岭嵴分析 岭嵴分析的原理是以原始设计中心点为球心,r为半径的超球面与响应面的交点形成的轨迹范围内找出最佳响应值,即最佳工艺条件。岭嵴分析的结果是对每个坐标从编码零值点开始不断扩大,半径r可以由实验者自行规定,但不能超出实验范围[17]。为了便于分析,本文选取r在0、0.1、0.2、…1.0上计算嵴点。岭嵴分析结果见表5。
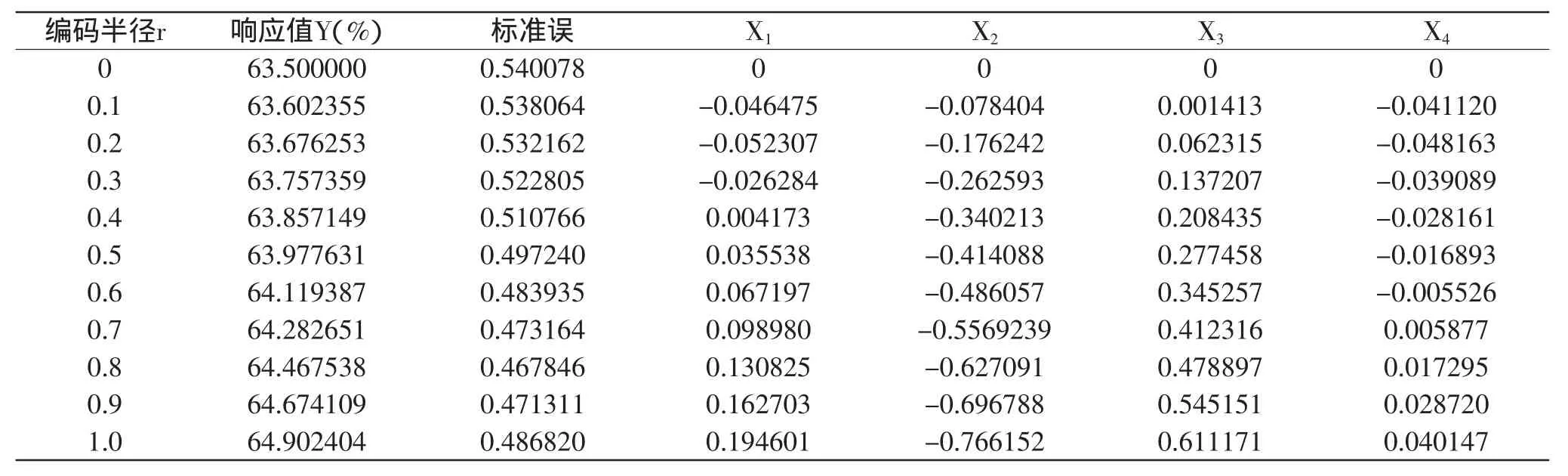
表5 岭嵴分析Table 5 Ridge analysis
从表5可以看出,随着编码半径r的增加,响应值Y逐渐增大。由此可知,仿栗籽蛋白提取率随pH、料液比、时间和温度的增加而增大。在本实验的水平范围内,当r=1.0时,此时的pH9.5973、提取温度42.3385℃、提取时间138.3351min、料液比1∶25.2007(g/mL),仿栗籽蛋白的理论提取率为64.9024%,为方便实际操作,设定最优提取条件为:pH9.6、提取温度42℃、提取时间138min、料液比1∶25(g/mL),按此优化工艺进行3次验证实验,得到仿栗籽蛋白实际提取率为64.97%,与预测值基本一致且高于中心组合实验中的任何一组。因此,回归拟合模型可较好地预测仿栗籽蛋白提取率,所得的仿栗籽蛋白提取工艺优化条件是切实可行的。
3 结论
采用响应面分析法(RSA)研究了碱溶酸沉法提取仿栗籽蛋白的工艺条件,建立了仿栗籽蛋白提取率的二次回归方程,其决定系数和修正系数分别为93.24%和85.35%;在本实验设计范围内,所选因素对仿栗籽蛋白提取率影响大小顺序为:温度>料液比>pH>时间,且温度、料液比分别对仿栗籽蛋白提取率的影响达到了极显著与显著水平,仿栗籽蛋白提取率与提取温度、pH、提取时间、料液比的二次回归曲面为鞍面,无极值存在,需要通过岭嵴分析找出最佳提取工艺条件。岭嵴分析的结果表明,碱溶酸沉法提取仿栗籽蛋白的最佳工艺条件为:pH9.6、提取温度42℃、提取时间138min、料液比1∶25(g/mL),在此条件下,仿栗籽蛋白提取率预测值为64.90%,与验证值64.97%基本一致,故回归拟合模型能较好地预测仿栗籽蛋白提取率,所得的工艺优化条件切实可行。本实验首次对仿栗籽蛋白的提取工艺进行研究,研究结果可为仿栗籽资源的综合开发利用提供一定的实验依据。
[1]李昌珠,张良波,向祖恒,等.仿栗生物学特性及果实油脂含量分析[J].湖南林业科技,2008,35(2):4-8.
[2]胡欣欣,麻成金,黄群,等.超声波辅助萃取仿栗籽油的研究[J].江苏食品与发酵,2008(1):11-14.
[3]麻成金,吴竹青,傅伟昌,等.响应面法优化仿栗籽油超临界萃取工艺[J].食品科学,2010,31(18):196-202.
[4]戴宇翔,钱志娟,曾晓雄,等.菜籽蛋白提取工艺的优化[J].食品工业科技,2011,32(3):304-306.
[5]逯与运,麻成金,黄群,等.响应面优化超声波辅助水酶法提取蜡梅籽蛋白[J].中国食物与营养,2010(9):59-63.
[6]齐宝坤,江连洲,李杨,等.响应面优化超声波辅助水酶法提取花生蛋白工艺[J].食品工业科技,2011,32(11):253-256.
[7]Sayan Gupta,Manohar C S.An improved response surface method for the determination of failure probability and importance measures[J].Structural Safety,2004(26):123-132.
[8]邓红,田芸芸,田子卿,等.响应曲面法优化文冠果种仁蛋白的碱溶酸沉提取工艺[J].食品工业科技,2010,31(8):197-200.
[9]许英一,李红,杨伟光,等.碱提酸沉法提取紫花苜蓿叶蛋白初探[J].食品工业科技,2011,32(6):264-266.
[10]Jebrail MJ,Wheeler AR.Digital microfluidic method for protein extraction by precipitation[J].Analytical Chemistry,2009,81(1):330-335.
[11]Bernardi Ra,Negri A,Ronchi S,et al.Isolation of the epithiospecifier protein from oil-rape(Brassica napus ssp.oleifera)seed and its characterization[J].FEBS Letters,2000,467(2-3):296-298.
[12]黄群,麻成金,孙术国,等.超声波辅助提取蚕豆蛋白及其功能特性研究[J].食品与发酵工业,2009,35(8):179-182.
[13]丁丹华,彭光华,夏辉,等.油茶籽粕蛋白提取工艺研究[J].食品科学,2010,31(8):102-105.
[14]Li Jing-en,Nie Shao-ping,Yang Chao,et al.Extraction optimization, characterization and bioactivity of crude polysaccharides from Herba Moslae[J].Carbohydrate Polymers,2011,38(3):1201-1206.
[15]李新华,富艳鑫,郑煜焱.米糠蛋白提取工艺条件的优化[J].食品科学,2010,31(22):251-254.
[16]王振宇,周芳,赵鑫.响应面分析法优化超声波提取大果沙棘总黄酮工艺[J].中国食品学报,2007,7(6):44-51.
[17]朱建飞,吴谋成,冯睿,等.菜籽粕中水溶性多糖提取工艺优化[J].农业工程学报,2006,22(12):251-254.
Optimization of the extraction technology of protein from sloanea hemsleyana seed by response surface methodology
HUANG Wei1,2,MA Cheng-jin1,2,*,HUANG Qun2,SU Chao2,FENG Lei2
(1.Key Laboratory of Plant Resources Conservation and Utilization,College of Hunan Province,Jishou University,Jishou 416000,China;2.Institute of Food Science,Jishou University,Jishou 416000,China)
TS255.6
B
1002-0306(2012)16-0246-05
2012-01-08 *通讯联系人
黄伟(1986-),男,硕士研究生,研究方向:天然产物化学。
湖南省高校创新平台开放基金项目(09K089);吉首大学校级科研项目(11JDYO43)。

