稻草粉基混合菌发酵产纤维素酶研究
段学辉,胡明明,熊福星,吴 量,陈加利,王 娟
(南昌大学食品科学与技术国家重点实验室,生命科学与食品工程学院,江西南昌330047)
稻草粉基混合菌发酵产纤维素酶研究
段学辉,胡明明,熊福星,吴 量,陈加利,王 娟
(南昌大学食品科学与技术国家重点实验室,生命科学与食品工程学院,江西南昌330047)
以稻草粉为主要原料,对白腐菌(White-rot fungi)NS75和黑曲霉(Aspergillus niger)NS83进行固态混合发酵产纤维素酶进行研究。混合菌固态发酵与单菌固态发酵实验结果比较表明,混合菌发酵产生的纤维素酶总体酶活明显高于单菌种发酵,其β-葡萄糖苷酶(β-G)酶活较白腐菌NS75单菌发酵提高了120.9%;葡聚糖内切酶(CMC)酶活比黑曲霉NS83单菌发酵提高了140.8%。单因素实验和正交实验结果表明,当稻草粉麸皮质量比为9∶1,料水比为1∶2,白腐菌NS75与黑曲霉NS83的接种比例为1∶1(v∶v)时,培养第3d开始搅拌,每天搅拌一次,于30℃,培养5d,稻草粉基混合菌发酵产纤维素酶中CMC酶活达到16650U/g,β-G酶活为16108U/g、滤纸酶活(FPA)酶活为3164U/g。
混合菌发酵,固态发酵,CMC酶,β-G酶,稻草粉
Abstract:Straw powder was used as the raw material,the solid fermentation conditions of cellulases production by mixed strains of White-rot fungi NS75 and Aspergillus niger NS83 had been investigated.The results of comparative experiments between single strain solid-state fermentation and mixed strains solid-state fermentation showed that,the cellulose enzyme activity produced by mixed strains had increased obviously than that produced in single strain solid-state fermentation,in which,the β-G enzyme activity had increased 120.9%than that produced by White-rot fungi NS75 single fermentation,and the CMC enzyme activity had increased 140.8%than that produce by Aspergillus niger NS83 single fermentation.According to the single factor and orthogonal experiment results the optimum fermentation conditions were determined as follows:ratio between straw powder and bran powder 9∶1,feed-water ratio 1∶2,inoculation volume ratio of White-rot fungi NS75 and Aspergillus niger NS83 1∶1(v∶v),start stirring on the third day and once a day,30℃ culture 5d.Under this conditions,the enzyme activity of CMC enzyme,β-G enzyme,FPA enzyme produced had reached respectively 16650,16108 and 3164U/g.
Key words:mixed strains fermentation;solid state fermentation;CMC enzyme;β-G enzyme;straw powder
稻草秸秆等生物质是被丢弃量最大的有机原料。植物细胞壁的主要成分是纤维素,其占植物秸秆干重的33%~50%。使用可再生木质纤维素资源生产乙醇能增加资源的利用率,降低环境污染,减少二氧化碳排放[1-3]。使用纤维素酶水解木质纤维素生物转化成乙醇技术的关键点在于纤维素酶的生产成本和催化活性。一般生产用纤维素酶是一个复合酶系,它包括:纤维二糖水解酶(cellobiohydrolases,CBH)(1,4-β-D-葡聚糖纤维二糖水解酶,EC 31211191);葡聚糖内切酶(endoglucanases,EG)(1,4-β-D-葡聚糖-4-葡聚糖水解酶,EC 3121114);β-葡萄糖苷酶(β-glucosidases,β-G)或(β-D-葡萄糖苷葡萄糖水解酶,EC 31211121)[4-5]。不同生物质纤维素的结构复杂,其水解需要复合酶的共同作用[6-7]。目前采用单菌发酵生产的纤维素酶存在酶系的不完整和个别酶活低的缺陷。如黑曲霉(Aspergillus niger)[8]发酵产纤维素酶中内切纤维素酶活性低。因此,多菌种混合发酵生产纤维素酶已逐渐引起研究者关注[9]。本研究使用实验室保存的两株纤维素酶产生菌—白腐菌(Whiterot fungi)NS75和黑曲霉(Aspergillus niger)NS83,在稻草粉为主要培养基上固态混合菌发酵生产纤维素酶,考察了混合发酵的培养条件、纤维素酶产量和主要酶种活力。
1 材料与方法
1.1 材料与设备
白腐菌(White-rot fungi)NS75、黑曲霉(Aspergillus niger)NS83 南昌大学食品科学与技术国家重点实验室分离保藏;稻草 取于南昌农田,粉碎过30目,高压灭菌锅高温处理2h,烘干保存待用;硫酸铵、磷酸氢二钾、磷酸氢二钠、无水亚硫酸钠、酒石酸钾钠、葡萄糖 分析纯,天津市大茂化学试剂厂;羧甲基纤维素钠、水杨苷、3,5-二硝基水杨酸 化学纯,国药集团化学试剂有限公司;苯酚、七水合硫酸镁、七水合亚硫酸铁、一水合硫酸锰、六水合氯化钴 分析纯,广东汕头市西陇化工厂;柠檬酸、无水氯化钙 分析纯,上海试剂一厂。
MJPS-250型霉菌培养箱、DXB-501型超级恒温水槽 上海精宏实验设备有限公司;KA-1000型低速离心机 上海安亭仪器厂;XSB-01型生物显微镜国营江西仪器总厂;AL104型电子分析天平 瑞士Mettler Toledo公司;756PC型紫外可见分光光度计上海光谱仪器有限公司;DSX-280A型不锈钢手提式灭菌锅 上海申安医疗器械厂;BHC-1300ⅡA/B3型生物安全柜 苏静集团安泰公司;DSHZ-300多用途水浴恒温振荡器 江苏太仓市实验设备厂。
1.2 实验方法
1.2.1 溶液及培养基的配制
1.2.1.1 3,5-二硝基水杨酸(DNS)溶液 称取DNS 6.3g于500mL烧杯中,用少量蒸馏水溶解后,加入2mol/L NaOH溶液262mL,再加到500mL、0.645mol/L酒石酸钾钠的热水溶液中,再加5.0g结晶酚和5.0g无水亚硫酸钠,搅拌溶解,冷却后移入容量瓶中用蒸馏水定容至1000mL,充分混匀,贮于棕色瓶中,室温放置1周后使用。
1.2.1.2 羧甲基纤维素溶液 称取2.0g羧甲基纤维素钠盐置于200mL蒸馏水中,沸水浴中搅拌溶解,过滤,取滤液150mL,加柠檬酸缓冲液30mL以及蒸馏水60mL,混匀,贮存于冰箱中备用。
1.2.1.3 1%的水杨苷溶液 准确称取1.0g水杨苷,加入适量的pH为5.0的柠檬酸缓冲液溶解,再使用蒸馏水定容至100mL。
1.2.1.4 Mandels[10]营养液 (NH4)2SO41.4g/L,KH2PO42.0g/L,(H2N)2CO 0.3g/L,CaCl20.3g/L MgSO4·7H2O 0.3g/L,FeSO4·7H2O 5.0mg/L,MnSO4·H2O 1.6mg/L,ZnSO4·7H2O 1.4mg/L,CoCl2·6H2O 2.0mg/L。
1.2.1.5 培养基 种子培养基:Mandels营养液50mL加入1%的葡萄糖和0.5%硫酸铵。固态发酵培养基稻草8g,麸皮2g,营养液20mL。
1.2.2 固态发酵培养 将在斜面上培养3~5d的白腐菌和黑曲霉菌,分别制成约107个/mL的孢子悬浮液。分别取1mL接于50mL液体种子培养基中,于30℃、150r/min培养24h,单菌发酵各菌分别接种2mL于250mL的广口瓶固态发酵培养基中,混合菌发酵则保持接种总量2mL,白腐菌∶黑曲霉按2∶1比例接于固态发酵培养基中,搅拌均匀,30℃恒温培养5~7d,单因素实验每组3个平行。
1.2.3 粗酶液的制备 均匀地取1.0g物料加入10倍的柠檬酸缓冲液,搅拌均匀,在摇床上浸提1h,然后3500r/min,离心20min,取上清液,于4℃冰箱保存,备用。另取1.0g物料在45℃干燥至恒重,测得的酶活除以干重即为固态发酵底物的酶活,其单位为U·g-1干曲。
1.2.4 酶活力测定方法 CMC酶活和FPA酶活测定参考颜淑芳等文献[11-12]。
β-G酶活测定参考苏香萍等[13]的方法加以改进:取1mL的酶液加入到2mL、1%的水杨苷柠檬酸缓冲液中,50℃水浴保温30min,DNS法测定还原糖含量。
酶活单位定义:上述反应条件下,1min水解底物生成1μg葡萄糖的酶量定义为1个酶活单位,换算成每克干物料含有的酶活,以U/g表示。
1.2.5 单菌与混合菌发酵产酶对比实验设计 分别将白腐菌孢子液、黑曲霉孢子液接入到装有10g稻草粉麸皮发酵培养基,容积为250mL的广口瓶中。接种量均为2mL,混合菌发酵则白腐菌∶黑曲霉按2∶1比例接种。于培养箱中30℃培养,发酵7d,分别测CMC酶、FPA酶和β-G酶活。
1.2.6 单因素实验设计
1.2.6.1 稻草粉麸皮质量比对混合菌发酵产酶的影响 实验保持固态培养基中麸皮与稻草总量10g,稻草粉与麸皮质量百分比为4∶0、3∶1、2∶2、1∶3、0∶4,接种总量2mL,白腐菌∶黑曲霉按2∶1接种,发酵5d测酶活。
1.2.6.2 培养基料水比对混合菌发酵产酶的影响 在固料为10g的基础上,料水比按1∶1、1∶1.5、1∶2、1∶2.5、1∶3的比例加入Mandels营养液,混合均匀,接种。30℃恒温培养5d测酶活。
1.2.6.3 发酵过程中搅拌对混合菌发酵产酶的影响
实验按以下5种方式进行。a:不搅拌;b:只第2d搅拌;c:从第2d开始搅拌,每天搅拌一次;d:从第3d开始搅拌,每天搅拌一次;e:第4d搅拌。搅拌方式为用无菌铁勺在超净台上对培养瓶中培养基进行搅拌,每次搅拌2min。培养5d测酶活。
1.2.6.4 混合菌接种比对发酵产酶的影响 实验保持接种总量2mL不变,白腐菌NS75∶黑曲霉NS83比例按3∶1、2∶1、1∶1、1∶2、1∶3五个比例考查混合菌接种比例对产酶的影响。
1.2.7 正交实验设计 在单因素实验的基础上,对料水比、稻草粉含量、搅拌方式和混合菌接种比例进行4因素3水平正交设计实验,分别测定CMC酶活、β-G酶活、FPA酶活,最终以CMC酶活为考察指标优化产酶条件,正交设计因素水平表见表1。

表1 正交实验因素水平表Table 1 Factors and levels table of orthogonal test
2 结果与讨论
2.1 单菌与混合菌发酵产酶情况对比
单菌和混合菌发酵产酶情况如图1~图3所示。
由图1可知,白腐菌(White-rot fungi)NS75具有较高的产CMC酶能力,并且在培养第5d酶活达到高点10400U/g,但其产β-G酶能力较弱,酶活为5311U/g。从图2可知,黑曲霉(Aspergillus niger)NS83产β-G酶能力较强,培养5d酶活达到10706U/g,但产CMC酶较弱,酶活只有4790U/g。白腐菌NS75与黑曲霉NS83混合发酵的图3结果表明,其CMC酶活和β-G酶活都比较高,在培养第5d酶活分别达到11533、11730U/g。相较单菌发酵,混合发酵产生的纤维素酶酶系全,酶活更高,其原因可能是混合发酵,两株菌之间纤维素酶酶系互补,各组分酶的底物反馈抑制作用也相应减弱,使得各菌处于有利的环境下生长代谢产酶。

图1 白腐菌NS75的产酶曲线Fig.1 Curve of enzyme production from White-rot fungi NS75 fermentation

图2 黑曲霉NS83的产酶曲线Fig.2 Curve of enzyme production from Aspergillus niger NS83 fermentation
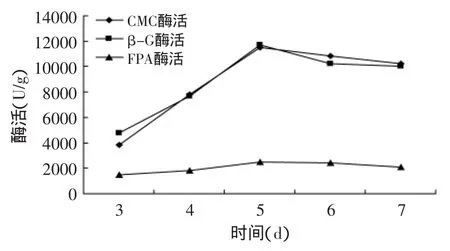
图3 白腐菌NS75与黑曲霉NS83混合发酵产酶曲线Fig.3 Curve of enzyme production from White-rot fungi NS75 and Aspergillus niger NS83 mixed fermentation
2.2 稻草粉用量对混合菌发酵产酶的影响
由图4可知,完全加稻草粉或完全加麸皮粉的产酶情况不如稻草粉与麸皮粉混合时产酶情况好,稻草粉和麸皮混合添加时,混合菌产酶能力较强。其原因与稻草粉和麸皮的成分有关,麸皮中含有淀粉酶、氧化酶、过氧化氢酶等、蛋白质、碳水化合物、维生素和矿物质等[14],这些物质都促进菌体的生长;稻草主要有果胶、木质素、半纤维素、纤维素、灰分和粗蛋白等物质[15],菌体不能很好的利用这些物质,但其中的纤维素却能诱导菌体产生纤维素酶。少量的麸皮有利于前期菌体生长,大量稻草诱导菌体中后期产酶,当稻草与麸皮质量比为3∶1时,混合菌产酶能力较高,CMC酶活达到135234U/g,β-G酶活达到13086U/g,FPA酶活达到2650U/g。
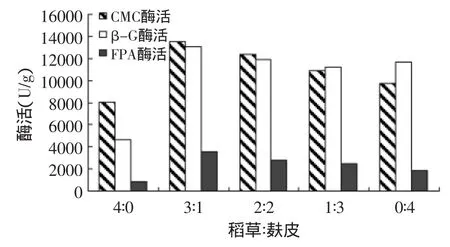
图4 稻草与麸皮的质量比对产酶的影响Fig.4 Effect of different ratio between rice straw and wheat bran on enzyme activity
2.3 培养基料水比对混合菌发酵产酶的影响
固态发酵中,培养基中的含水量是一个重要参数,本次实验考查含水量对混合菌发酵产酶的影响。由图5可知,当料水比为1∶2时,混合菌产酶效果较好,说明混合菌发酵产酶过程中,湿度会影响菌体的生长,孢子的形成以及酶的产生,水分过少或过多都不利。

图5 培养基料水比对产酶的影响Fig.5 Effect of different feed-water ratio on enzyme activity
2.4 发酵过程中搅拌对混合菌发酵产酶的影响
实验对固态发酵中基质的混匀,菌的分散对发酵产酶的影响进行了考查。实验结果如图6所示。从图6可以看出,搅拌方式d和搅拌方式c发酵所产纤维素酶酶活较高;与搅拌方式a和b相比,c和d搅拌次数多,物料和菌体分散更均匀,培养基中氧的含量也随搅拌增多,有利于混合菌的生长和产酶;搅拌方式e由于搅拌太晚,菌体可能已经到了生长和产酶中后期,所以效果不明显;搅拌方式c和d比较,方式d保证菌体具有足够的时间适应环境和前期生长繁殖,而方式c搅拌开始时菌体可能还未适应环境,菌体生长和菌丝体形成受到搅拌影响菌,因此方式c培养不如方式d培养产酶效果好。
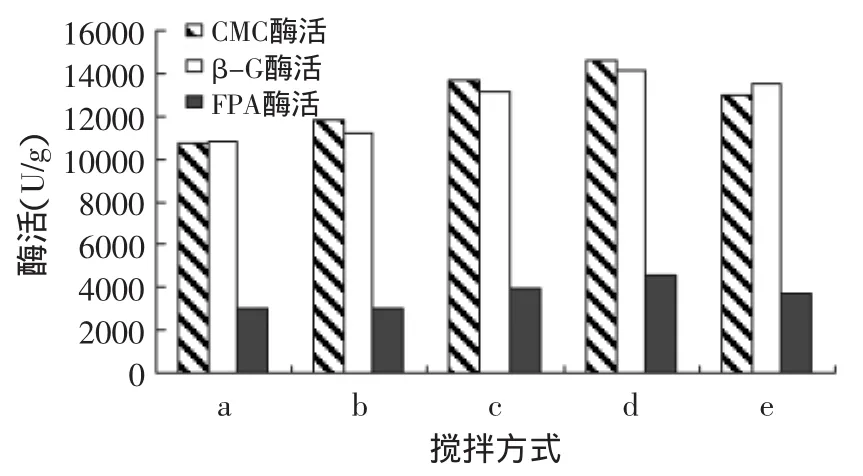
图6 不同的搅拌方式对产酶的影响Fig.6 Effect of different stirring modes on enzyme activety
2.5 混合菌接种比对发酵产酶的影响
结果如图7所示。从图7中可以看出,白腐菌NS75主导CMC酶生产,黑曲霉NS83主要产β-G酶,随着黑曲霉NS83接种比例的增加,混合菌发酵产β-G酶活明显上升,但CMC酶酶活下降,综合考虑白腐菌NS75∶黑曲霉NS83的接种比为1∶1时产酶的酶系组成较好。
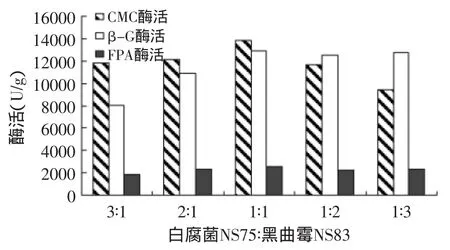
图7 混合菌接种比例对产酶的影响Fig.7 Effect of different White-rot fungi NS75 and Aspergillus niger NS83 ratio on enzyme activity
2.6 混合菌固态发酵产酶条件优化
在单因素实验的基础上,对料水比、稻草粉含量、搅拌方式和混合菌接种比例进行4因素3水平正交设计实验,分别测定CMC酶活、β-G酶活、FPA酶活。鉴于CMC酶为纤维素酶系中的主要组分,且能够有效地表达发酵产酶效果,实验选择以CMC酶活为考察指标进行产酶条件优化,正交设计见表1,正交实验及结果见表2。
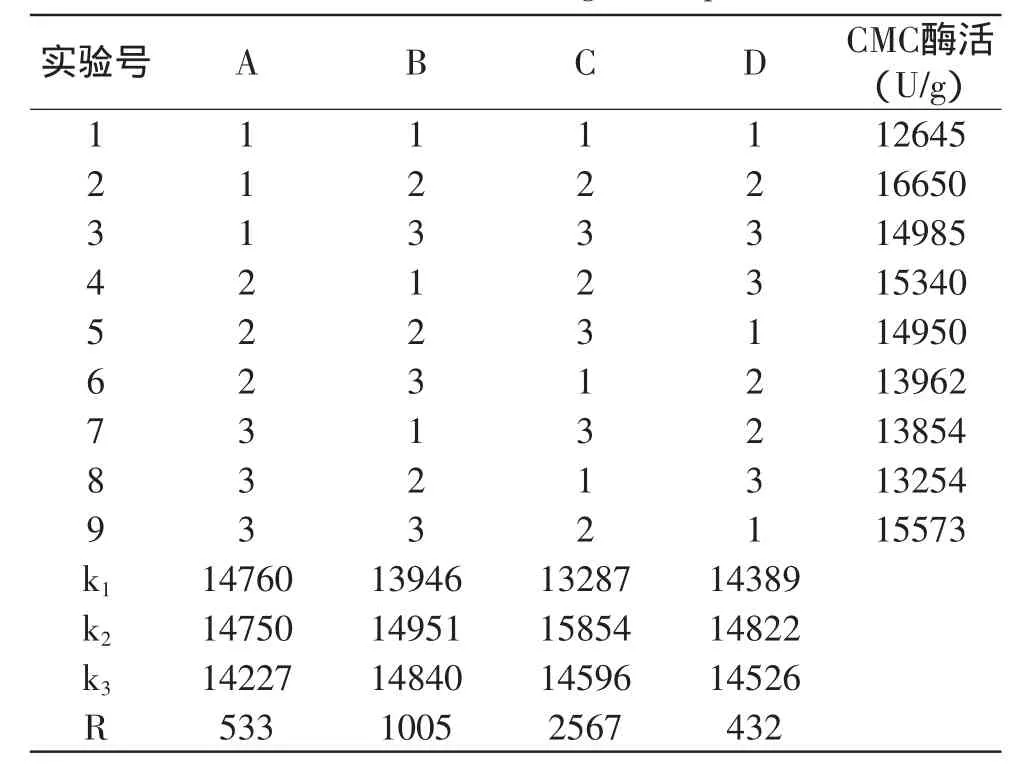
表2 正交实验结果Table 2 Results of orthogonal experiment
从表2中9组实验的CMC酶直观分析结果可以看出,混合菌固态发酵产酶最优实验组为第2组,即稻草粉麸皮质量比为9∶1,料水比为1∶2,从培养第3d开始搅拌,每天搅拌1次,菌种比为1∶1,与极差分析得到的优化组合A1B2C2D2相一致,这个组合下CMC酶活达到16650U/g。各培养条件对混合菌产酶的影响顺序为:搅拌方式>料水比>稻草含量>菌种比。由表3可以看出,搅拌方式(C)对混合菌产酶的影响显著,这可能是因为搅拌使得固态培养基中的含氧量增大,菌体、水分的分散更加均匀,因此在固态发酵过程中应该设法对培养基进行间隙搅拌。

表3 正交实验方差分析表Table 3 Variance analysis of orthogonal experiment
选择稻草麸皮质量比为9∶1,料水比为1∶2,从培养第3d开始搅拌,每天搅拌1次,接种比为1∶1固态混合发酵条件,对正交实验结果进行验证,三组平行实验的CMC酶活分别为16685、16723和16628U/g,平均值为16679U/g,与正交实验直观分析所得最优条件所得值16650U/g十分接近。
3 结论
单菌发酵和混合菌发酵实验结果比较表明,采用双菌种混合发酵产生的纤维素酶酶系全且酶活更高,相比于白腐菌NS75单菌发酵产生的CMC酶活10400U/g、β-G酶活5311U/g和FPA酶活2123U/g,混合菌发酵产生的CMC酶活达到11533U/g,β-G酶活达到11730U/g,FPA酶活达到2483U/g,分别提高了约10.9%、120.9%和17.0%;相比于黑曲霉NS83单菌发酵产生的CMC酶活4790U/g、β-G酶活10706U/g和FPA酶活2221U/g,混合菌发酵CMC酶活提高了140.8%,β-G酶活提高了9.6%,FPA酶活提高了11.8%。
在优化发酵条件:稻草与麸皮质量比为9∶1,料水比(W发酵物料∶W营养盐液)为1∶2,菌种白腐菌NS75与黑曲霉NS83的接种比例为1∶1(v∶v),从培养第3d开始搅拌,每天搅拌一次,培养5d,白腐菌NS75与黑曲霉NS83固态混合发酵产纤维素酶的CMC酶活达到16650U/g,β-G酶活为16108U/g、FPA酶活为3164U/g,比初始条件下混合发酵产酶的酶活分别提高了44.4%、37.3%和27.4%。
[1]Wyman C E.Ethanol from lignocellulosic biomass:technology,economics,and opportunities[J].Bioresource Technol,1994,50(1):3-16.
[2]刘洁丽,王靖.生物产纤维素酶研究进展[J].化学与生物工程,2008,25(21):9-12.
[3]Lynd L R,Cushman J H,Nichols R J,et al.Fuel ethanol from cellulosic biomass[J].Science,1991,251:1318-1323.
[4]Holker U,Hofer M,Lenz J.Biotechnological advantages of laboratoryscalesolid statefermentation with fungi[J].Appl Microbiol Biotechnol,2004,64(2):175-186.
[5]Esterbauer H,Steiner W,Labudova I,et al.Production of Trichoderma cellulase in laboratory and pilot scale[J].BioresourceTechnol,1991,36(1):51-65.
[6]陈合,余建军,舒国伟,等.复合酶降解高温蒸煮玉米秸秆的饲料化研究[J].食品工业科技,2010(12):176-178,181.
[7]庄童琳,李虎,郭凤霞,等.黑曲霉固态混菌发酵苹果渣生产多酶生物饲料[J].食品工业科技,2010(12):171-175.
[8]陈娜,顾金刚,徐凤花,等.产纤维素酶真菌混合发酵研究进展[J].中国土壤与肥料,2007(4):16-21.
[9]邹水洋,吴清林,肖凯军,等.康宁木霉与米根霉混合发酵生产纤维素酶和木聚糖酶的研究[J].河南工业大学学报:自然科学版,2009,30(3):69-73.
[10]Mandels M,Weber J,Pariaek R.Enhanced cellulase production by a mutant ofTrichoderm aviride[J].Applied Microbiology,1971,21(1):152-154.
[11]段学辉,颜淑芳,彭云召,等.响应面法优化灰绿青霉Penicillium glaucum NS16产酶条件[J].食品与生物技术学报,2010,29(3):464-470.
[12]张瑞萍.纤维素酶的滤纸酶活和CMC酶活的测定[J].印染助剂,2002,19(5):51-53.
[13]苏香萍,龚大春,陈国华,等.混合菌固态发酵产纤维素酶条件的研究[J].时珍国医国药,2010,12(21):3330-3331.
[14]江晖,何珣.小麦麸皮功能性成分的研究进展[J].安徽农业科学,2011,39(2):834-835.
[15]汤丽琳,夏先林,张丽,等.不同处理方法对稻草营养成分影响研究[J].草业科学,2002,19(7):16-29.
Cellulases produced by mixed strains fermentation in straw powder
DUAN Xue-hui,HU Ming-ming,XIONG Fu-xing,WU Liang,CHEN Jia-li,WANG Juan
(State Key Laboratory of Food Science and Technology,School of Life Science and Food Enginerring,Nanchang University,Nanchang 330047,China)
TS201.2+5
A
1002-0306(2012)16-0224-05
2012-01-12 *通讯联系人
段学辉(1958-),男,博士,教授,研究方向:食品生物技术、绿色化工技术。

