日本乙型脑炎病毒E抗原表位的筛选
马丽敏,李 琳,胡乐鹏,何 晔,李 叶,任秀梅,靳 朝*,夏志平*,王本旭
(1.吉林大学畜牧兽医学院,吉林长春130062;2.解放军军事医学科学院军事兽医研究所,吉林长春130017;3.北京军区疾病预防控制中心,北京100042)
流行性乙型脑炎是由日本乙型脑炎病毒(Japanese encephalitis virus,JEV)引起的一种对人类生命健康有很大威胁的急性人兽共患传染病,病死率高,后遗症严重,在亚洲地区发病率较高,而且在全球的流行有扩大的趋势[1-2]。JEV E蛋白具有血凝活性和中和活性,是病毒表面最重要的成分,它与病毒的吸附、穿入、致病和诱导宿主的免疫应答等作用紧密相关。因此,JEV E基因成为建立乙型脑炎特异性血清学检测方法及核酸疫苗研究的目的基因[3-4]。本实验以抗JEV E蛋白的单克隆抗体(MAb)作为固相筛选分子筛选噬菌体7肽库,并筛选出JEV E蛋白的抗原表位,为开展用JEV抗原表位探索JEV的防治研究创造了条件,为多肽疫苗研制、药物筛选以及特异血清学诊断方法的建立提供了依据。
1 材料和方法
1.1 病毒株及主要实验材料 JEV疫苗弱毒株SA14-14-2购自成都生物制品研究所;噬菌体随机肽库试剂盒购自美国New England Bio labs公司;受体菌为E.coli ER 2537由北京军区疾控中心分子生物学实验室提供;抗JEV E蛋白的MAb JEV-E1(1.136mg/m L)及兔抗JEV多克隆抗体由本实验室保存;TMB底物显色试剂盒购自中同生物公司;鼠抗M 13噬菌体HRP-IgG购自Pharmacia公司。
1.2 JEV E抗原表位的筛选 以抗JEV E蛋白的MAb作为固相筛选分子,应用噬菌体表面展示技术筛选噬菌体7肽库。每一轮筛选之后取1μL噬菌体测定滴度。待噬菌体得到高度富集后,挑取单克隆转接于低盐LB培养基中摇菌过夜,用ELISA方法检测其与MAb之间的特异性结合反应。对ELISA检测呈阳性的克隆提取单链DNA测序分析,确定JEV E抗原模拟表位的氨基酸序列。
1.2.1生物淘洗将单抗稀释后包被,4℃孵育过夜,用封闭缓冲液37℃封闭2h,以0.1%的TBST洗6次。每孔加入100μL噬菌体肽库,室温轻柔震荡1h,使MAb与肽库结合。再次洗涤后,每孔加入100μL 0.2M Glycine-HCl洗脱,将洗脱液转至1.5m L离心管,15μL 1M Tris-HCl中和至中性。取1μL中和液测定噬菌体滴度,其余扩增纯化并进行下一轮筛选。
1.2.2噬菌体克隆与抗JEV E蛋白MAb的ELISA分析将MAb稀释后包被96孔酶联板,以BSA作为阴性对照。次日洗涤后37℃封闭2h,加入噬菌体克隆 100μL,37℃ 孵育 1h;每孔加 100μL 1∶5000稀释的HRP标记抗噬菌体M 13MAb,室温孵育40m in,洗涤后与TMB反应10min,终止反应,检测OD450nm值。ELISA检测结果阳性者测序分析。
1.3 日本乙型脑炎病毒E抗原表位的鉴定
1.3.1序列合成设计合成包含该表位的15肽序列JEV-E-lm,对照序列则是表位序列为甘氨酸。
JEV-E-lm:5'aattcaaagtgccaactcaaaggtgctggtcgagat ggaaccccccttcggataataaa-3'
3'-gtttcacggttgagtttccacgaccagctctaccttggggggaagccta ttattttcga-5'
JEV-E-lm突变序列:5'-aattcaaagtgccaactcaaaggtg ctggtcgagggtggtggtggtttcggataataaa-3'
3'-gtttcacggttgagtttccacgaccagctcccaccaccaccaaagcct attattttcga-5'
在目的基因片段两端引入EcoRⅠ和Hin dⅢ酶切位点,3'端引入终止密码子TAA。片段大小为59bp。
1.3.2构建载体并诱导表达目的蛋白质粒经酶切后分别与JEV-E-lm及其突变体连接。将连接产物转化BL21感受态细胞,挑取单克隆转接于LB/Amp培养基中培养过夜,提取质粒并单酶切鉴定,阳性克隆测序验证。
测序正确的单克隆菌落接种于LB/Amp培养基中,待OD600nm≈0.5时加IPTG 30℃诱导表达6h,浓度为0.5mM。菌液离心取沉淀,超声裂解,离心取上清50μL,加入50μL SDS-Buffer,95℃热变性5m in。恢复至室温后12%SDS-PAGE鉴定表达产物。
1.3.3Western blot方法验证JEV-E-lm及突变短肽与JEV多抗的特异性结合反应样品经SDS-PAGE后将蛋白质转移到硝酸纤维素膜上,以兔抗JEV多抗为一抗,HRP标记的羊抗兔IgG为二抗,正常兔血清为对照进行western blot。
1.3.4ELISA方法验证JEV-E-lm及其突变短肽与JEV抗体的特异性结合反应用包被液将JEV-E-lm及突变多肽液释至100μg/m L,100μL/孔包被酶联板,包被相同量的GST蛋白作为阴性对照;5%的脱脂奶粉200μL/孔封闭;1∶1000倍稀释的JEV抗体为一抗,100μL/孔;PBST(0.5%Tween-20)洗涤;加入HRP标记二抗100μL/孔,室温孵育40min;PBST洗涤;加入TMD底物显色系统,100μL/孔,反应10min;终止后测定OD450nm值。
2 结果
2.1 噬菌体滴度测定 以抗JEV E蛋白的MAb为筛选靶标,BSA为对照,通过测定每轮筛选时样品孔与对照孔洗脱下的噬菌体滴度比(P/N),检测噬菌体克隆的富集程度。在4轮洗脱过程中,P/N值逐渐增加,最后P/N值接近30倍,表明与MAb结合的噬菌体克隆得到高度富集(图1)。

2.2 ELISA方法检测噬菌体克隆与MAb之间的特异性结合反应 30个克隆扩增,用ELISA方法检测其与MAb之间的特异性结合反应,有22个噬菌体克隆ELISA检测结果呈阳性(图2)。体正确连接(图3)。测序结果利用DNAMAN软件分析比对,PGEX-KG-lm、突变体序列与原序列符合率100%。

表1 表位测序结果Table 1The results of sequence analysis

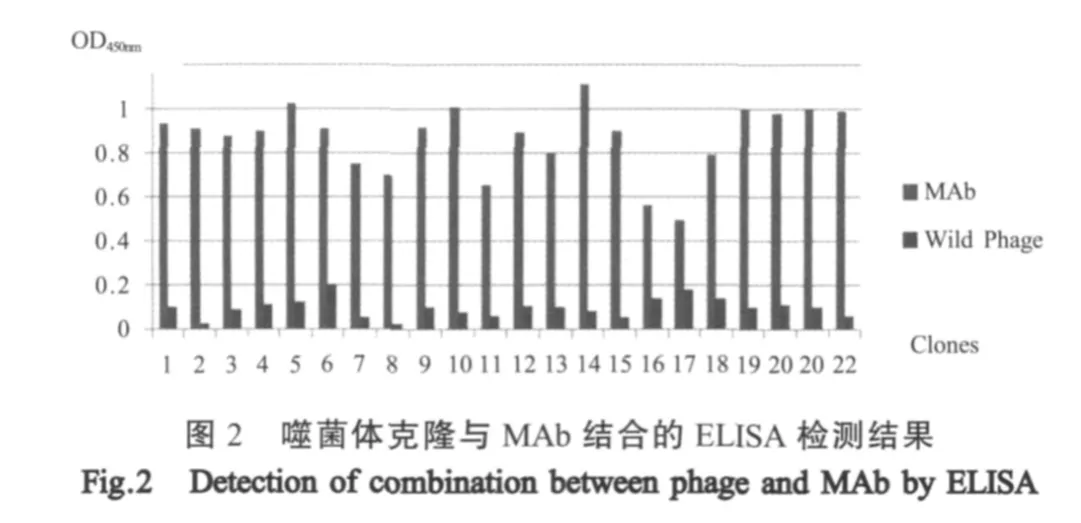
2.3 噬菌体阳性克隆序列测定及保守性分析 将20个ELISA检测呈阳性的克隆提取单链DNA进行基因序列测定。分析测序结果表明出现频率较高的序列为M(/Q)EPPL(/F)。利用DNAMan软件将该序列与JEV全基因组序列、E蛋白序列进行比对,发现该序列为JEV E蛋白序列的一部分(表1)。
2.4 重组表达载体XhoⅠ单酶切电泳结果 用XhoⅠ对重组表达载体进行单酶切鉴定,PGEX-KG-JEV-E-lm与其突变体均未被切开,表明目的片段与载
2.5 重组表达载体的诱导表达 将诱导表达后的菌液超声破碎,离心,上清与沉淀分别SDS-PAGE电泳,重组蛋白得到表达(重组蛋白分子量约为30ku,以包涵体形式为主)(图4)。
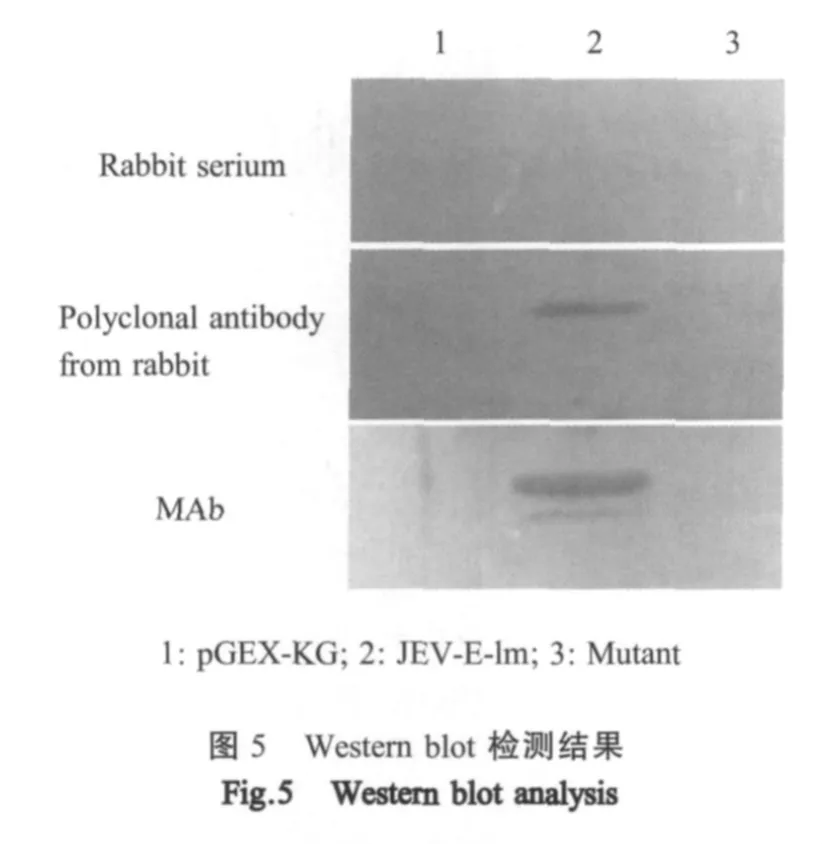
2.6 JEV-E-Im融合多肽western blot结果 Western blot检测结果显示,筛选所得的表位能够与兔抗JEV多抗发生特异性结合反应,与兔正常血清无反应;而空载体和突变体与兔抗JEV多抗及兔正常血清均无反应。表明本试验所获得的表位是JEV的抗原表位(图 5)。

2.7JEV-E-lm融合多肽ELISA结果 将JEV-E-lm及突变体融合多肽,以及GST蛋白分别包被ELISA板孔,各加入1∶1000倍稀释的JEV抗体,检测其与抗体之间的特异性结合反应(图6)。试验结果表吸JEV-E-Im融合多肽既能够特异性结合作为靶标筛选用的抗JEV MAb,也能够特异性结合兔抗JEV多抗。

3 讨论
噬菌体展示技术常用单链丝状噬菌体、T4噬菌体和λ噬菌体作为载体,利用基因工程手段,将多肽的基因表达产物或外源蛋白质与噬菌体衣壳蛋白以某种方式有机结合并表达在其表面,之后将噬菌体展示文库作为流动相,与待选择的重组基因产物有特异性亲和力的靶分子作为固定相进行洗脱[5]。在洗脱的过程中,可以特异性结合的成分被固定,而不能与固定相特异结合的大部分成员则被洗脱下来,之后进一步扩增,进入下一轮淘选。用此方法经数轮洗脱,即可将无用的基因去掉而将有用的基因富集并分离出来。该技术可直接将表达型与基因型联系在一起,利用配体的特异性亲和力,筛选出感兴趣的蛋白质或多肽[6-7]。
本实验选用噬菌体表面展示技术,以MAb为靶标进行筛选,通过分析抗体识别的特异性序列来确定抗原表位,从而筛选出机体对病原的真正识别位点。相比传统的从蛋白质及结构分析来预测抗原表位,不受病原体变异程度的影响,不依赖于蛋白的一级结构信息,具有更高的准确性,优化过程也更为简便高效。应用ELISA方法检测噬菌体克隆与MAb之间的特异性结合反应,结果显示筛选得到的阳性克隆与JEV E蛋白的MAb能够特异性结合,表明所筛选出的氨基酸序列MEPP为JEV E蛋白的模拟表位。通过在大肠杆菌中的表达研究,验证了该表位的正确性。
[1]Gyulai Z,Endresz K.Cytotoxic T lymphocyte(CTL)responses to human cytomegalovirus pp65,IE1-Ex-on4,gB,pp150,and pp28in health individuals:Reevaluation of precalence of IE1-specific CTLs[J].J Infect Dis,2000,181(5):1537-1546.
[2]Goel N,Rong Q,Zimmerman D,et al.A LEAPSTM heteroconjugate vaccine containing a T cell epitope from HSV-1glycoprotein D elicit Th1responses and proteiction[J].Vaccine,2003,21:4410-4420.
[3]Wanf Z,Rose C L,Mekhoubad S,et al.Attenuated poxviruses generate clinically relevant frequencies of CMV-specific T cells[J].Blood,2004,104(3):847-856.
[4]Diamond D J,York J,Sun J-Y.et al.Decelopment of a candidate HLA A*0201restricted peptide-based vaccine against cytomegalovirus infection[J].Blood,1997,90(5):1751-1767.
[5]Wietzke B P,Meier V,Braun F,et al.Combination of"low dose"ribavirin and interferon alpha 2a therapy followed by interferon alpha 2a monotherapy in chronic HCV infected non responders and relapses after interferon alpha 2a monotherapy[J].World JGastroenterol,2001,7:222-227.
[6]Wang Ben-xu,Liu Yu,Liu Zhan,et al.A novel neutralizing epitope of human cytomegalovirus glycoprotein M screened by phage display[J].Progress in Biochem istry and Biophysics,2009,36(2):220-227.
[7]高学良,钱旻,赵群飞.噬菌体展示技术的发展及应用[J].生命的化学,2001,21(5):432-433.

