巴曲酶对短暂性脑缺血发作患者血浆Fib、PGF1α 及 NSE 动态影响
祝炜 陈维杰
短暂性脑缺血发作(TIA)好发于老年人,男性多于女性,是历时短暂并经常反复发作的脑局部供血障碍,不超过24 h即完全恢复[1]。但TIA可以反复发作,与卒中没有本质的区别,都享有共同的病理生理学基础[2],易进展为脑梗死,是脑梗死最重要的危险因素,且发作后出现心肌梗死或其他血管事件的概率大大增加,故近年来国内外学者均认识到应重视TIA的诊治[3]。
特异性神经元烯醇化酶(neuron-specific enolase,NSE)是反映神经元损伤最敏感的生化指标,能够反映脑损伤的程度[4]。纤维蛋白原(Fib)作为凝血因子参与凝血,前列环素也在血栓形成机制中有重要地位,在生理环境下水解为前列腺素1α(PGF1α),且二者随病程、病情不断变化。本研究以巴曲酶治疗TIA并观察临床疗效,动态检测NSE、Fib及PGF1α水平,探讨其在TIA中的变化特点及意义。
1 对象与方法
1.1 研究对象 选择我院2009年1月至2011年12月所治疗的TIA患者(均为颈内动脉型),符合1995年第四届全国脑血管病学术会议通过的《各类脑血管疾病诊断要点》,共120例。男76例,女44例。年龄55~75岁,平均(69.6±7.5)岁,均发病24 h内入院,均合并原发性高血压。按参考文献标准进行分组[5]:TIA发作持续时间≤1 h或发作≤4次者为A组(TIA轻症组),>1 h或发作>4次者为B组(TIA重症组)。按照用药情况共分为4个亚组,即A1组(TIA轻症+巴曲酶治疗组)、A2组(TIA轻症+常规治疗组)、B1组(TIA重症+巴曲酶治疗组)、B2组(TIA重症+常规治疗组)。另设健康对照组(C组):选自门诊同年龄段体检的健康人,男21例,女9例,年龄60~71岁,平均(69.1±2.9)岁。上述各组样本例数均为30例。
1.2 排除条件 除外急性心肌梗死、心力衰竭、严重感染及严重肝肾功能不全者,以及1周内应用抗凝、降纤、溶栓药物者。
1.3 给药方法 A2组与B2组给予常规治疗,包括红花20 ml,低分子右旋糖酐500 ml静滴每日1次,尼莫地平20 mg每天3次。A1与B1组在常规治疗基础上给予生理盐水250 ml+10 U巴曲酶(东菱克栓酶,日本东菱制药株式会社产品)静脉点滴隔日1次,共3次,每次静滴1 h以上。其余治疗,如降糖、调脂、支持治疗均一致。
1.4 标本采取及指标检测 TIA组患者在发病24 h和第3、7、14天各采血1次,均取肘静脉血2 ml。Fib用凝固法,采用DADE Thrombin Reagent试剂盒;NSE行电化学发光法,采用罗氏NSE诊断定量测定试剂盒;6-K-PGF1α采用放射免疫法测定,试剂由上海生物制品研究所提供。
1.5 疗效判定 治愈:72 h内停止发作;有效:3~14 d内停止发作;无效或恶化:发作在15 d后停止或进展为脑梗死[5]。
2 结果
2.1 NSE水平的变化 A1、A2、B1、B2组 NSE水平在发病后24 h即出现升高,与C组相比差异显著(P<0.05),第3天升高更明显,至第7天起呈下降趋势,至第14天进一步下降。其中A1组下降至C组水平(P>0.05),其余3组仍高于C组(P均<0.05)。TIA各组间发病24 h时NSE水平相近,第3、7、14天重症组NSE水平显著高于轻症组(P均<0.05)。其中应用巴曲酶组(A1、B1组)第3、7、14天NSE血浆水平明显低于常规治疗组(A2、B2组,P均<0.05)。见表1。
表1 各组患者不同时间血浆NSE水平比较(±s,pg/ml,n=30)

表1 各组患者不同时间血浆NSE水平比较(±s,pg/ml,n=30)
注:与C组比较,*P<0.05;与A1组比较,▲P<0.05;与B1组比较,△P<0.05;与A2组比较,#P<0.05;与前一个时间点比较,&P<0.05
2.2 PGF1α、Fib 的变化 (1)PGF1α的变化:A1、A2、B1、B2组PGF1α水平于发病后24 h变化不显著。第3天开始升高,第7、14天继续升高(P<0.05)。第3、7、14天可见重症组 PGF1α水平低于轻症组(P均 <0.05);并且常规治疗组低于巴曲酶治疗组(P均<0.05);(2)Fib的变化:TIA组Fib水平于发病后升高,第3天即降低,治疗组低于常规组(P<0.05),第7天逐步回升,第14天Fib水平近于发病24 h。见表2。2.3 各组间疗效比较 A1组及A2组治疗有效率分别高于B1组和B2组(P<0.05);A1组及B1组疗效分别高于A2组及B2组(P<0.05)。见表3。
表2 各组患者不同时间血浆PGF1α和Fib比较(±s,n=30)
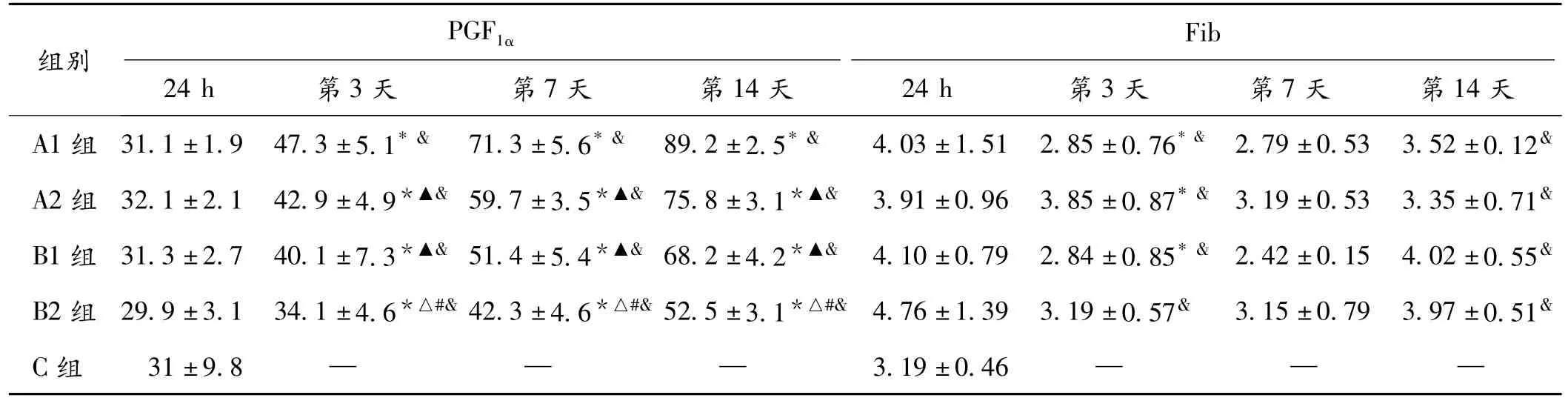
表2 各组患者不同时间血浆PGF1α和Fib比较(±s,n=30)
注:与C组比较,*P<0.05;与A1组比较,▲P<0.05;与B1组比较,△P<0.05;与A2组比较,#P<0.05;与前一个时间点比较,&P<0.05
组别PGF1α 24 h 第3天 第7天 第14天Fib 24 h 第3天 第7天 第14天A1组 31.1±1.9 47.3±5.1*& 71.3±5.6*& 89.2±2.5*& 4.03±1.51 2.85±0.76*& 2.79±0.53 3.52±0.12&A2组 32.1±2.1 42.9±4.9*▲& 59.7±3.5*▲& 75.8±3.1*▲& 3.91±0.96 3.85±0.87*& 3.19±0.53 3.35±0.71&B1组 31.3±2.7 40.1±7.3*▲& 51.4±5.4*▲& 68.2±4.2*▲& 4.10±0.79 2.84±0.85*& 2.42±0.15 4.02±0.55&B2组 29.9±3.1 34.1±4.6*△#& 42.3±4.6*△#& 52.5±3.1*△#& 4.76±1.39 3.19±0.57& 3.15±0.79 3.97±0.51&C组 31±9.8 — — — 3.19±0.46— — —
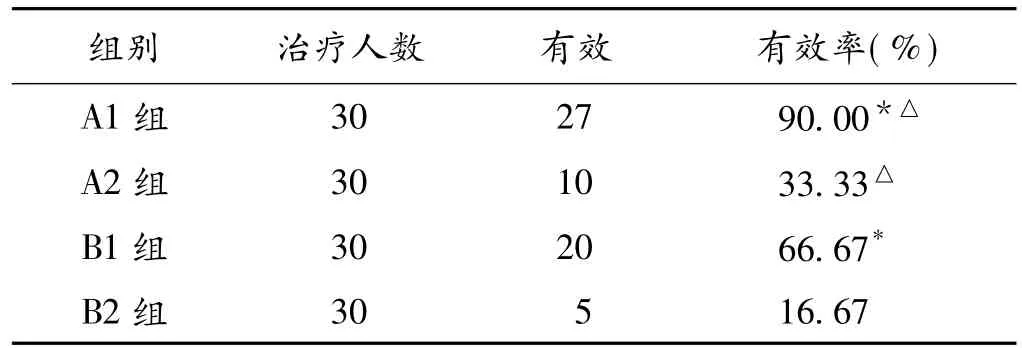
表3 TIA各组患者疗效比较
3 讨论
NSE特异性地存在于神经元和神经内分泌细胞中,当脑组织受损时,NSE从神经元内漏出,进入脑脊液和血液,被认为是神经元损伤的标志酶[6],与癫、卒中、脑外伤等中枢神经系统疾病密切相关,其水平变化能够反映神经元损伤程度及疾病预后[7]。本研究显示TIA患者病程24 h即出现NSE水平升高,提示症状虽然消失但已发生神经元损害。病程第3天升高更为明显,考虑可能与缺血再灌注损伤有关。此后随病情的逐渐稳定神经元损伤减轻,NSE漏出减少,同时经机体吸收、代谢,NSE水平逐渐下降。本研究结果显示,TIA重症组NSE水平较轻症组高(P<0.05),下降慢,治疗后有效率低于轻症组(P<0.05);巴曲酶治疗组有效率(79%)较常规治疗组(25%)高(P<0.01),NSE水平下降明显。上述结果提示:TIA发作次数越多,持续时间越长,治疗效果及预后愈差,NSE升高愈明显,下降愈缓慢。巴曲酶治疗较常规治疗更为有效,更能减轻神经元损伤度。
前列腺素是一种潜在的血小板功能抑制剂,且能扩张血管。动物实验发现PGI2的增高是在动物缺血再灌注的过程中,提示其增高与循环的改善有关,同时研究发现TIA急性期出现PGF1α升高[8]。急性脑缺血时组织缺氧,血管内皮细胞受损,不仅合成PGI2的能力下降,而且也有利于血小板黏附聚集,在聚集过程中血小板也将释放大量生物活性物质,从而更加重局部血管收缩,加速血小板聚集,以致组织缺氧和血管内皮损伤程度进一步加重。此后随着血管痉挛的缓解和再灌注的发生,PGI2的合成逐渐增加。它具有防止或明显减轻有害物质对细胞的损伤和致坏死作用,能与血小板膜受体特异性结合,激活腺苷酸环化酶,使血小板中环磷酸腺苷水平升高,从而抑制血小板聚集、释放,并使血管扩张。
本研究对象颈内动脉TIA以微栓塞性多见。TIA发病主要机制是大动脉近端血管壁动脉粥样硬化斑块脱落形成微栓子,而粥样斑块表面的血管内皮细胞层脱落,内皮下胶原直接暴露于血流,激活血小板,纤维蛋白单体交联为纤维蛋白,促进血小板聚集,产生释放反应,引起纤维蛋白原增高,而巴曲酶可诱发内皮细胞释放组织型纤溶酶原激活剂,使纤溶酶原激活成纤溶酶起溶栓作用,增强纤溶酶活性,降低血黏度,改善循环,并减少纤维蛋白原在内皮的黏附[9]。因而巴曲酶治疗较常规治疗更为有效。
TIA患者PGF1α升高,缺血早期血小板聚集和血管收缩,同时产生大量自由基,加重了脑的缺血与损伤,使NSE升高,而脑的缺血与损伤进一步刺激了Fib的合成,如此形成恶性循环,使血栓易于形成。而巴曲酶是选择性纤溶酶原抑制剂,降解纤维蛋白原、抑制血小板聚集,阻断该循环,因而能有效地治疗TIA。
[1]Elkind MS.Prognosis of transient neurological attacks[J].JAMA,2008,299(15):1771-1772.
[2]毕齐,王力峰.对短暂性脑缺血发作诊断的思考[J].中国卒中杂志,2008,3(3):167.
[3]徐重白,丁亚军,石磊,等.脑动脉硬化大鼠模型的试制及药物干预[J].实用老年医学,2008,22(6):425-428.
[4]Perez LF,Prieto JM,Tutor JC.A thermodynamic study of beta-N-acetylhexo saminidase enzyme heterogeneity in cerebrospinal fluid from patients with multiple sclerosis[J].Ups J Med Sci,2007,112(3):296-302.
[5]匡培根,彭超英,陶沂,等.巴曲酶速控频发的短暂性脑缺血发作[J].脑与神经疾病杂志,1996,4(2):65-70.
[6]Lima JE,Takeyanagui OM,Garcia LV,et al.Neuron-specific enolase in patients with neurocysticercosis[J].J neurol sci,2004,217(1):31-35.
[7]Lima JE,Takayanagui OM,Garcia LV,et al.Use of neuron-specific enolase for assessing the severity and outcome in patients with neurological disorders[J].Braz J Med Biol Kes,2004,37(1):19-26.
[8]张一凡,徐酝宜,王玉龙.脑血管病人血浆血栓素B2和6-酮-前列腺素 F1α比值的改变[J].上海医科大学学报,1997,24(1):67-68.
[9]赵艳,刘振胜,王少华.巴曲抗栓酶治疗新进展[J].中国新药杂志,2005,14(8):979.

