正十八硫醇的合成反应动力学研究
章亚东,潘开林,梁政勇
(郑州大学化工与能源学院,河南郑州450001)
0 引言
正十八硫醇是一种重要的精细化学品,用途十分广泛,其可作为有机合成中间体合成含硫化学品[1].正十八硫醇亦能够在金属表面形成自组装膜,这种自组装膜具有易制备、稳定性好和能预先进行表面设计等特点,对金属有很好的保护作用,可以作为金属表面强化剂及金属缓蚀剂,在微电子、电化学、电分析化学等领域备受关注,市场前景广阔[2-3].目前,国内外对于其应用方面的研究很多,但对其合成方面的研究甚少,低碳硫醇的合成方法有硫脲法和硫氢化钠法,但收率不高,副产物多,很难实现工业化[4-5],而且正十八硫醇为长碳直链伯硫醇,其合成工艺过程远比低碳链硫醇复杂,因此,开展正十八硫醇的合成及其动力学研究,不仅具有重要的学术价值,而且有较好的经济效益.笔者在以氯代十八烷和硫脲为主要原料合成正十八硫醇得到的优化条件基础上,研究了其动力学模型,为正十八硫醇合成的工业化设计提供了参考依据.
1 实验部分
1.1 主要实验仪器与试剂
GC9800型气相色谱仪(上海科创色谱仪器有限公司);98-3型恒温油浴锅(郑州凯鹏实验仪器有限公司);精密温度计及其它实验室常用仪器.
氯代十八烷(98%,阿拉丁试剂);硫脲(分析纯,天津科密欧化学试剂开发中心);有机溶剂(市售).
1.2 实验操作
实验在一个250 mL的四口圆底烧瓶中进行,烧瓶的一个侧口连接冷凝管,另一个侧口装精密温度计和采样管,中间安装搅拌器,反应温度由恒温油浴锅控制,依次加入适量的溶剂和硫脲,搅拌升温至指定温度后迅速加入氯代十八烷,并开始计时.每30 min取样分析,每次用移液管取1 mL反应液,用去离子水除去硫脲和异硫脲盐等难挥发物质,加入内标物,然后用气相色谱分析检测氯代十八烷的浓度.
1.3 分析方法
用气相色谱进行定量分析,分析方法为内标法,内标物选择为氯代十六烷,色谱条件为:仪器型号:GC9800TFP;色谱柱:SE-54 30 m ×0.32 mm;柱箱温度:250℃;柱前压:0.085 MPa;汽化温度:290℃;氢气压力:0.025 MPa;检测温度:290℃;空气压力:0.03 MPa;样品:待测组分;灵敏度:2;载气种类:N2;检测器:FID;进样量:0.1 μL;尾吹:0.045 MPa;采用一阶程序升温:250℃不保温;15℃/min升温至280℃;保温10 min;降温至250℃.
2 实验结果与讨论
2.1 影响因素的排除
由于反应是均相反应,不考虑相转移催化剂内扩散的影响,搅拌速度恒定且为400 r/min,可以忽略搅拌对反应速率的影响,反应溶剂为120 mL,每次所取样品为1 mL,在整个反应过程中总体积变化很小,因此可以忽略反应溶液体积变化对反应的影响.
2.2 动力学方程的推导
以氯代十八烷和硫脲为原料合成正十八硫醇的反应方程如下:

正十八硫醇合成工艺可分为三步,首先是氯代十八烷和硫脲反应制得S-十八烷基异硫脲盐,然后用氢氧化钠碱性水解,再用硫酸酸化,提纯可以制得正十八硫醇.在这三步反应当中,第一步反应是合成正十八硫醇的核心技术步骤,它对正十八硫醇的收率具有最为重要的影响.因此研究第一步的反应动力学是非常必要的,它可为正十八硫醇合成扩大乃至生产提供重要的动力学数据支持.
鉴于该反应过程中第二、三两步为碱、酸中的离子反应,反应速率较快,影响正十八硫醇反应的决速步骤是氯代十八烷与硫脲的加成反应.设氯代十八烷为A组分,硫脲为B组分,则第一步反应动力学方程为:

在第一步反应过程中加入氯代十八烷与硫脲的摩尔比为1∶4,因此在整个反应过程中硫脲的浓度近似恒定,速率方程在形式上只与氯代十八烷的浓度有关,而与脲硫的浓度无关,在反应过程中cB不发生变化且过量,则β=0,上式简化为:

假设反应级数为一级,α=1,则

分别选取 373.15,378.15,383.15,388.15,393.15 K 5个温度进行考察,在指定温度下反应,测定不同时间t下cA/cA0的值,如表1所示.
由表1中的数据可以求出指定温度下不同时间t和ln(cA/cA0)的关系,其线性拟合方程如表2所示,利用表2进行作图得到图1,在硫脲大大过量的条件下,通过图1可以看出在不同温度下ln(cA/cA0)与时间t成良好的直线关系,表明氯代十八烷与硫脲的反应为准一级反应.因此前面的假设是正确的.

表1 不同温度和时间下的cA/cA0值Tab.1 The cA/cA0at different temperature and time%

表2 线性拟合方程Tab.2 Linear regression equation

图1 t与ln(cA/cA0)的关系图Fig.1 Relationship between ln(cA/cA0)and t
2.3 反应表观活化能的确定
为了考察温度对动力学方程的影响[6-7],根据不同反应时间对应的氯代十八烷浓度的实测数据,以及由t与ln(cA/cA0)回归出来的动力学参数计算出不同温度下表观的反应速率常数k值,其结果如表3所示,以表中的实验数据作lnk-T-1图,结果如图2所示.由图可知,lnk与T-1呈良好的线性关系.

表3 表观反应速率常数k和温度T之间的关系Tab.3 Relationship between the reaction ratio constant k and temperature T
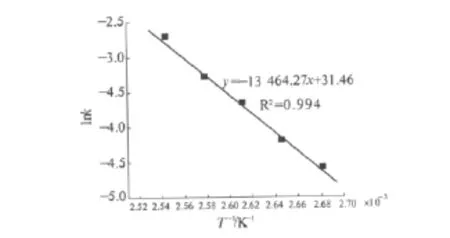
图2 反应速率常数与温度间的关系Fig.2 Effect of temperature on reaction ratio constant
根据Arrhenius方程有:
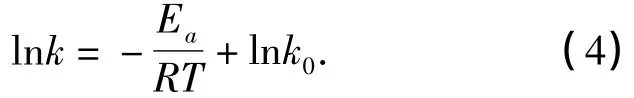
因此,用lnk对1/T作图得到一条直线,由图2进行线性回归,其结果为:

由直线斜率可以求出活化能Ea,由截距可以求出指前因子,计算出Arrhenius方程中的表观活化能和指前因子分别为:Ea=13 464.27×8.314 5=111 948.67 J/mol,k0=e31.46=4.602 × 1013.
2.4 动力学方程的验证
根据以上分析,在反应温度为 373.15~393.15 K时表观的动力学方程可表示为:

积分式为:

其中,k=4.602 ×1013exp(
为了考察反应动力学方程的可信度,在温度为380.15 k下,用动力学方程式计算出不同反应时间所对应的氯代十八烷的浓度cA/cA0,cal,将计算值 cA/cA0,cal与实测值 cA/cA0,exp进行比较,其结果见表4.由表4可知,计算结果基本与实验结果相符,说明本实验所得数据确定的反应动力学模型是可靠的.

表4 温度为380.15 K时动力学模型计算的cA/cA0与实验结果比较Tab.4 The experimental concentration compared with the calculated cA/cA0at 380.15 K %
3 结论
(1)在反应温度373.15~393.15 K,搅拌速度为400 r/min,硫脲过量的条件下,反应级数近似为一级.在该反应条件下,反应动力学表征方程可表示为:

反应的表观活化能为Ea=111.95 kJ/mol,介于一般化学反应活化能40~400 kJ/mol之间,属于化学反应控制过程.
(2)经检验,所得氯代十八烷的反应速率方程是可信的,本研究结果可以从理论上为合成正十八硫醇的反应器的设计提供一定的参考.符号说明:
cA,cB——反应到t时刻氯代十八烷和硫脲的有效浓度,mol·L-1;
cA0——反应开始时氯代十八烷的有效浓度,mol·L-1;
rA——反应到 t时刻氯代十八烷的反应速率,mol·L-1·min-1;
XA——氯代十八烷的转化率;
a,β——反应级数;
R——通用气体常数为8.314 5 J·mol-1·K-1
Ea——表观活化能,kJ·mol-1;
k——反应速率常数;
k0——指前因子;
t——反应时间,min;

[1]赵辉,杨雪,于海丰.硫醇作亲核试剂在有机合成中的应用[J].辽宁化工,2009,38(12):903-905.
[2]MEIRAV C A,ANDREW N,DANIEL M.Characterization of n-alkanethiol self-assembled monolayers on mercury by impedance spectroscopy and potentiometric measurements[J].Journal of Electroanalytical Chemistry,2006,593(1/2):227-240.
[3]刁鹏,蒋殿录,贾振斌,等.用电容平面图研究金/十八硫醇单分子膜的自组装过程和缺陷情况[J].化学研究与应用,1999,11(6):630-634.
[4]田勇.正十二碳硫醇的合成工艺研究[D].哈尔滨:黑龙江大学化学化工与材料学院,2006.
[5]孙宝国,李玉,郑福平.1,6-已二硫醇合成研究[J].精细化工,1996,13(2):17-19.
[6]周则卫.1,2-乙二硫醇制备工艺的改进[J].化学试剂,2008,30(3):225-226.
[7]张珍,李华.异丙硫醇合成反应动力学的研究[J].化学试剂,2009,31(4):292-294.

