维甲酸联合低浓度化疗药物对肺腺癌A549细胞的作用
赵俊刚,任开明,汤隽,张磊
(中国医科大学附属盛京医院胸外科,沈阳 110004)
肺癌是世界上发病率和死亡率增长最快,预后最差的恶性肿瘤之一,化疗是治疗肺癌的重要手段,遗憾的是,传统的大剂量、长间歇化疗模式在治疗肺癌的同时也产生了严重的不良反应,许多患者不能耐受或是对化疗药物耐药而导致化疗失败。近年来对于肿瘤诱导分化剂的研究越来越受到学者的重视,特别是全反式维甲酸(all-trans retinoic acid,RA)具有的强大诱导分化能力,不仅在治疗急性早幼粒细胞白血病方面取得了良好的临床效果[1,2],而且能够抑制多种肿瘤细胞的生长。因此被认为是一类很有希望的抗癌防癌药物[3,4]。诱导分化剂与低浓度化疗药物联合应用有希望显著减少药物的剂量,降低化疗药物的毒性,增强疗效。在本实验中,我们采用全反式维甲酸和低于临床用药浓度不同剂量的化疗药物吉西他滨、顺铂等及2者联合处理A549人肺腺癌细胞株,观察不同药物、不同剂量及不同作用时间对A549细胞增殖、细胞周期的影响。
1 材料与方法
1.1 材料及细胞培养
A549人肺腺癌细胞株由中国医科大学中心实验室馈赠。A549细胞接种于含10%小牛血清、青霉素 100 U/mL 和链霉素 100 μg/mL、pH 7.10~7.12的RPMI1640培养液中,于37℃、5%CO2培养箱中培养,反复传代,培养至实验所需数量。
1.2 药物配制及实验分组
全反式维甲酸(RA)贮存液:溶于95%乙醇中配成10.0 mmol/L贮存液,实验前用培养液稀释。各组乙醇顺铂、吉西他滨等药物浓度设计参照临床用药剂量。药物顺铂浓度依不同要求分别为0.10、0.41、0.83、3.30、33.00 mg/L (分别标记为 D1、D2、D3、D4、D5);吉西他滨浓度分别为 1.0、4.1、8.3、33.0、330.0 mg/L(分别标记为 G1、G2、G3、G4、G5)。
1.3 MTT方法检测细胞增殖
培养细胞经过常规胰酶消化后,接种于96孔培养板中,每孔(200 μL)5×104个细胞,于实验结束前4 h,加入 5 mg/mL MTT 10 μL/孔,继续培养 4 h,弃上清,加入DMOS 200 μL/孔,待MTT代谢产物Fomrazan完全溶解后,用酶标比色仪(美国)测定各孔OD值(490 nm),每组重复4~6孔。MTT OD值与癌细胞接种数目之间有良好线性关系,同时也能反映细胞的代谢活力,并以此反映体外试验中化疗药物对细胞的杀伤效果。细胞抑制率(%)=(1-实验组OD值/对照组OD值)×100%。
1.4 流式细胞仪测定细胞周期时相
贴壁培养细胞常规消化,使之成为单细胞悬液,将约5×105~1×106个细胞移入离心管中,800~1 000 r/min离心5 min,PBS洗2次,800~1 000 r/min离心5 min,弃上清后,在离心管中留约0.5 mL PBS,将细胞混匀,加70%乙醇到细胞悬液中,迅速混匀,置4℃8 h以上,然后800~1 000 r/min离心5~10 min,去乙醇,加适量PBS重悬细胞,800~1 000 r/min,洗1次,留 0.4 mL PBS,重悬细胞,加人 RNase 5 μL(10 μg/mL),37℃,1 h,再加PIl(100 μg/mL),以流式细胞仪测定细胞时相。
1.5 统计学处理
2 结果
2.1 最佳RA浓度及时机的筛选
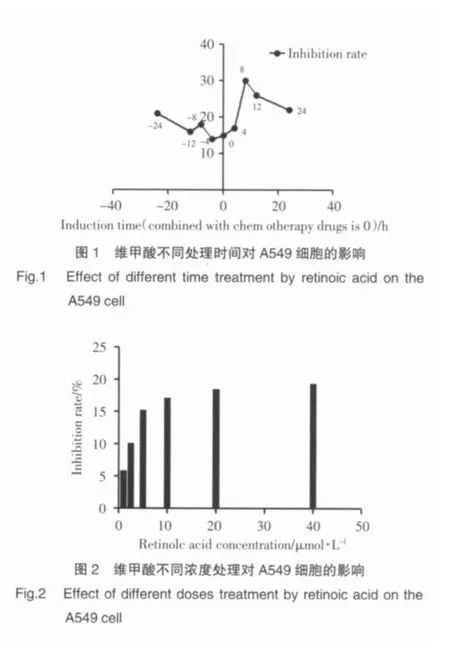
对于维甲酸(RA)最佳浓度及时机的筛选如图所示,我们考查其针对A549细胞的抑制率,当维甲酸与化疗药物作用A549细胞8 h后再加入联合作用抑制效果最佳,抑制率达到30%(图1),而当维甲酸浓度>5 μmol/L后各组抑制率差别不大,基本在16%~19%之间(图2),究其原因可能与受体饱和度有关。
2.2 维甲酸对化疗的增效作用
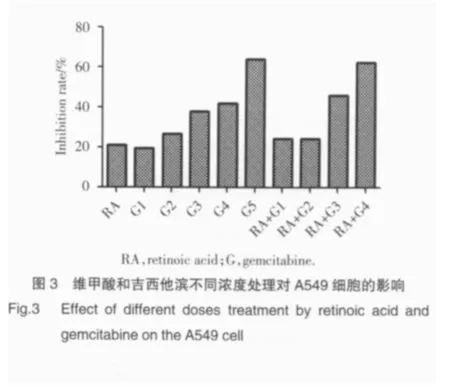
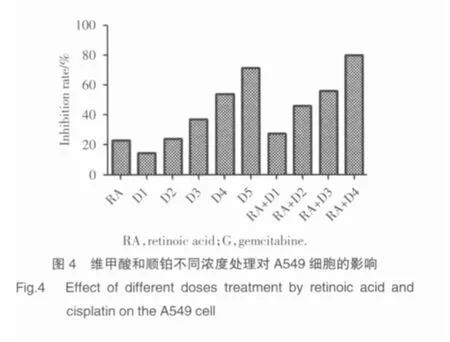
在维甲酸对化疗的增效作用的研究中,我们发现:吉西他滨浓度在1.0 mg/L、4.1 mg/L时维甲酸的增效作用并不明显(19.6%和26.8%),进一步加大浓度可见抑制率上升明显(38.1%~64.0%),吉西他滨临床用药浓度组的抑制率和维甲酸联合吉西他滨1/10临床用药浓度组差别不大(图3),而维甲酸联合每一个顺铂浓度组在抑制率的比较上都有一定程度的提升(14.6%~71.8%),维甲酸联合顺铂1/10临床用药浓度组甚至比顺铂单药临床用药浓度抑制率高(图 4)。
2.3 维甲酸及化疗药物对细胞周期的影响
流式细胞仪检测结果显示,维甲酸主要作用于A549细胞的G1期和S期。顺铂对细胞周期的影响主要是将细胞阻滞在G1期,减少S期细胞,而维甲酸可明显促进顺铂对细胞周期的影响。吉西他滨对细胞周期的影响主要为对S期的阻滞,加入维甲酸后S期比例并无明显变化,仅仅增加了G1期的比例。

3 讨论
在肺癌的治疗中,无论是否接受手术治疗,化疗都是重要的治疗手段之一,但是传统的大剂量细胞毒化疗模式主要是针对肿瘤细胞的增殖失控设计的。这些疗法靶向性差,因此在杀伤肿瘤细胞的同时,也会对正常细胞产生杀伤效应,而导致诸如骨髓抑制、消化道反应等严重毒副作用,而且在机体可能承受的条件下,难以从根本上彻底清除患者体内的肿瘤细胞,总体化疗有效率不高。1988年,上海维甲酸协作组首先使用全反式维甲酸(ATRA)诱导分化治疗人急性早幼粒细胞白血病获得显著疗效。这一结果和研究工作的不断深入,诱导分化作为恶性肿瘤的一种新型治疗方法已日益引起医学工作者的关注和兴趣。其对肺癌的防治作用,也越来越受到广大学者的重视。有研究证实[5~7],ATRA能抑制肺癌细胞的快速增殖,诱导其分化和凋亡,降低肺癌细胞的体外侵袭能力。本实验研究观察了联合应用维甲酸和不同浓度的化疗药物对肺腺癌A549细胞的作用,发现维甲酸可以显著提高肺癌细胞对化疗药物的敏感性,确保抑制率的同时减少用药量,减少化疗药物的毒副反应,提高患者对化疗的耐受性。
维甲酸直接抑制肿瘤细胞的生长同时亦调整细胞周期,促进肿瘤细胞的同步化疗作用。细胞周期中G1期主要合成RNA和核糖体,该期特点是物质代谢活跃,迅速合成RNA和蛋白质,细胞体积显著增大。这一期的主要意义在于为下阶段S期的DNA复制做好物质和能量的准备,S期为DNA合成期,G1期的增高和S期的减少导致细胞周期延迟或阻滞,DNA合成发生障碍,从而抑制A549细胞生长、代谢、增殖,最终触发凋亡机制,导致细胞死亡。吉西他滨通过抑制DNA合成发挥细胞毒作用,作为细胞周期特异性药物,吉西他滨主要作用于DNA合成期(S期)。在一定的条件下,也可以阻止G1期向S期的进展,对G2和M期无作用[8]。而顺铂为细胞周期非特异性药物,主要抑制RNA及蛋白质合成,阻滞细胞于G1期。流式细胞仪检测结果显示维甲酸主要作用于A549细胞的G1期和S期,它通过调节多种肿瘤细胞周期相关蛋白表达,阻止癌细胞G1/S期进程,抑制癌细胞增殖、诱导肿瘤细胞凋亡[9],联合顺铂时促进了对S期的阻滞,而与吉西他滨联合作用时除保持对S期的阻滞作用外,还加强了对G1期的阻滞。
肺腺癌对放疗、化疗敏感性均较差,联合使用维甲酸诱导分化治疗,可增加化疗有效率,延长患者的生存期,而不明显地破坏其机体的免疫机制与造血、肝肾等功能,提高患者的生存质量。
[1]Ferrara F.Acute promyelocytic leukemia:what are the treatment options[J].Expert Opin Pharmacothera,2010,11(4):587-596.
[2]Wang ZY,Chen Z.Acute promyelocytic leukemia:from highly fatal to highly curable[J].Blood,2008,111(5):2505-2515.
[3]Coelho SM,Vaisman M,Carvalho DP.Tumour redifferentiation effect of retinoic acid:a novel therapeutic approach for advanced thyroid cancer[J].Curr Pharm Des,2005,11(19):2525-2531.
[4]Sun SY,Lotan R.Retinoids and their receptors in cancer developmentandchemoprevention[J].CritiRevOncolHematol,2002,41(1):41-55.
[5]周人杰,肖颖彬,张国强.全反式维甲酸对人肺腺癌细胞株A549细胞黏附分子-1表达及体外侵袭力的影响[J].中国肿瘤生物治疗杂志,2004,11(4):291-292.
[6]Suzuki S,Kawakami S,Chansri N,et al.Inhibition of pulmonary metastasis in mice by all-trans retinoic acid incorporated in cation icliposomes[J].J Control Release,2006,116(1):58-63.
[7]Manna SK,Aggarwal BB.All-trans retinoic acid upregulates TNF receptors and potentiates TNF induced activation of nuclear factors kappaB,activated protein-1 and apoptosis in human lung cancer cells[J].Oncogene,2000,19(17):2110-2119.
[8]徐家廉,赵萍.吉西他滨治疗非小细胞肺癌的研究进展[J].中国肺癌杂志,2001,4(3):211-215.
[9]Borriello A,Cucciolla V,Criscuolo M,et al.Retinoic acid induces p27Kip1 nuclear accumulation by modulating its phosphorylation[J].Cancer Res,2006,66(8):4240-4248.

