黄芩苷体外对白念珠菌凋亡的影响
冯 鑫, 汪长中, 汪天明, 徐振华, 韩 宁, 程惠娟, 官 妍, 王 艳
(安徽中医学院中西医结合临床学院,安徽合肥230038)
近年来,以白念珠菌为主的机会性真菌感染发生率正逐年升高,尤其是其引起的深部感染往往成为真菌感染致死的主要原因[1]。同时,临床上抗真菌药物不仅种类少,对肝肾等器官毒副作用大,且易产生耐药性,因此真菌感染成为临床上棘手的难题。目前,从天然产物尤其是中药中筛选抗真菌药物并深入研究其抗菌机制成为近年来抗真菌药物研发的一个热点。本课题组前期研究发现,中药有效成分黄芩苷对白念珠菌具有较强的抑制作用,但黄芩苷是否能诱导白念珠菌凋亡尚不明确[2-3]。本实验拟进一步探讨黄芩苷体外对白念珠菌凋亡的影响,为其抗真菌感染提供重要的实验依据。
1 材料与方法
1.1 菌株、培养基、试剂和仪器 白念珠菌标准株ATCC10231与黄芩苷标准品 (批号110715-201016)购于中国药品生物制品检定所,沙氏培养基购于杭州微生物试剂有限公司,RPMI-1640培养基购于GIBCO公司,罗丹明123(Rh123)与Hoechst 33258购于 Sigma公司,二氢罗丹明(DHR)与蜗牛酶购于Ruibio公司。流式细胞仪XL为Beckman Coulter公司,荧光显微镜为Olympus公司产品。
1.2菌液的制备 将白念珠菌划线接种于SDA培养后,挑选2个菌落接种于RPMI-1640(含10%小牛血清)培养基中稀释,血球计数板计数,再以RPMI-1640培养液调整菌液密度为1×107/mL。
1.3 凋亡的药物诱导及脱壁处理[4]在白念珠菌悬液 (1×107/mL)中分别加入黄芩苷1 000,100,10 μmol/L,37℃静置作用16 h,另设不加药的正常对照组 (每组n=6)。冷PBS洗2次,然后参照文献[4]对各组细胞进行脱壁处理:即加入脱壁促进剂 (50 mmol/L K2HPO4,5 mmol/L EDTA,50 mmol/L DTT),30℃、100 r/min摇床孵育30min,PBS洗涤2次,再转移至1.5%蜗牛酶溶液中,30℃、100 r/min摇床孵育45 min,即得脱壁后原生质体状态的白念珠菌。冷PBS洗2次后,用于下述流式细胞仪检测ROS与MMP。
1.4 Hoechst 33258荧光染色观察细胞形态改变在白念珠菌悬液 (1×107/mL)中分别加入黄芩苷1 000,100,10 μmol/L,作用 16 h,PBS洗两次,另设正常对照组。加入4%多聚甲醛 (新鲜配制),固定细胞 (4℃15 min),加入Hoechst 33258(5 mg/L)染色液作用15 min,PBS冲洗,荧光显微镜下观察、拍照。
1.5 流式细胞术检测细胞活性氧 (reactive oxygen species,ROS) 在脱壁的原生质体状态白念珠菌细胞悬液中,加入10 μmol/L的DHR 500 μL,室温下避光孵育1 h,PBS洗涤后用流式细胞仪检测Rh123的平均荧光指数 (mean fluorescence index,MFI)。
1.6 流式细胞术检测线粒体膜电位 (mitochondrial membrane exponential,MMP) 用含10%小牛血清的RPMI-1640培养基将1 g/L的Rhl23(溶于DMSO,储存于-20℃)稀释至终质量浓度10 mg/L,加入原生质体状态白念珠菌悬液中,37℃避光孵育30 min,冷PBS洗涤5 min,流式细胞仪检测MMP。
1.7 统计学处理 实验重复3次,由SPSS17.0统计软件分析,数据以均数±标准差表示。两组数据采用t检验,多组数据采用单因素方差分析。P<0.05为显著性差异。
2 结果
2.1 黄芩苷对白念珠菌细胞形态的影响 荧光显微镜高倍镜 (×400)下,Hoechst 33258染色显示,正常对照组的白念珠菌细胞核呈弥漫均匀的低强度荧光 (图 1A)。100 μmol/L,1000 μmol/L 浓度黄芩苷组的菌细胞呈现凋亡细胞的核浓染致密、固缩状态或颗粒状荧光 (图1C,1D),但10 μmol/L黄芩苷组的菌细胞未见明显凋亡征象 (图1B)。油镜下 (×1 000),可更清晰见到正常菌细胞的均匀一致的荧光密度,而凋亡菌细胞核则呈明显浓缩、核碎裂等表现 (图1E,1F)。
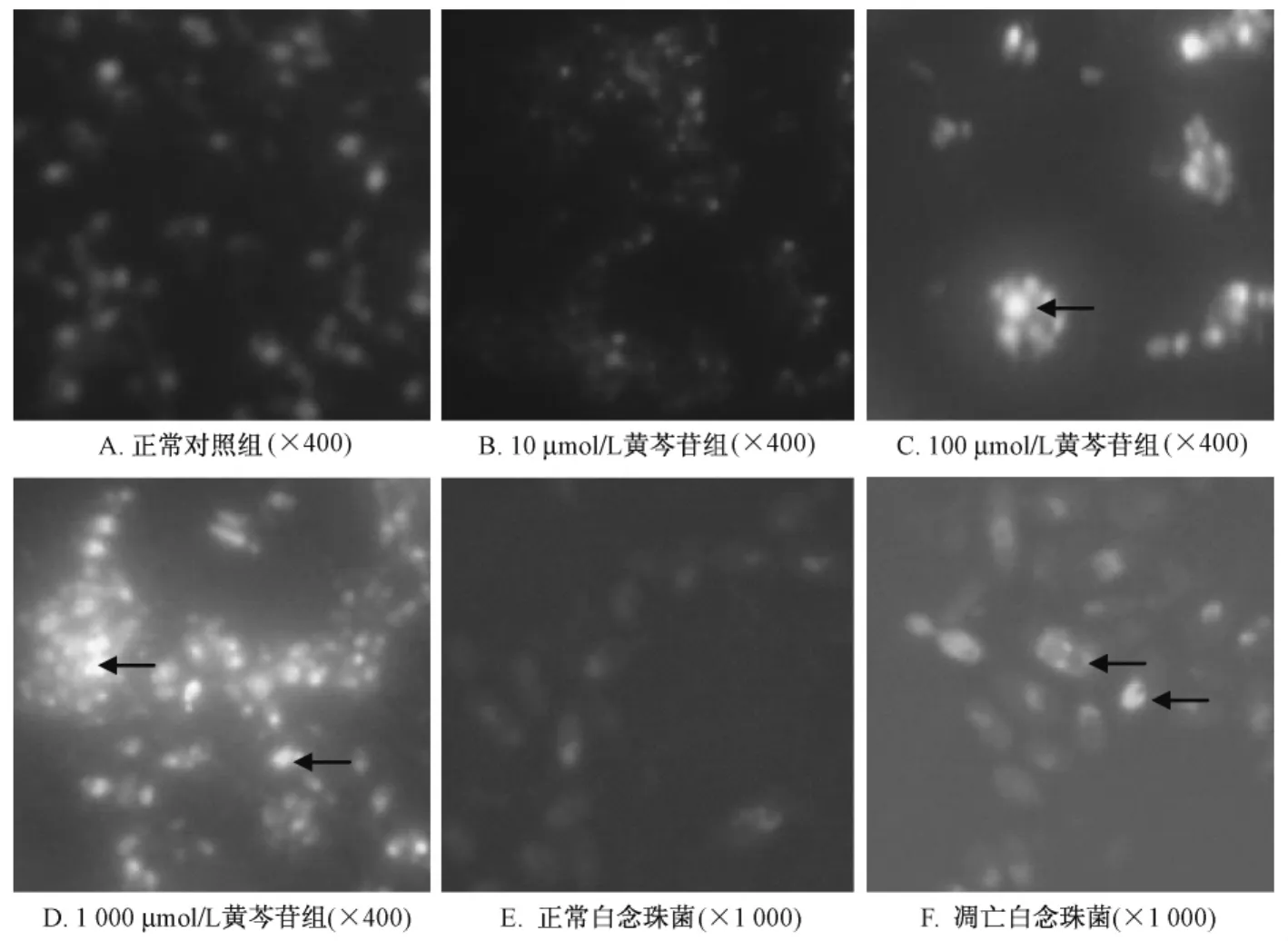
图1 荧光显微镜观察不同浓度黄芩苷对白念珠菌形态的影响Fig.1 Fluorescence microscopic observation of the morphological changes of Candida albicans cells exposed to baicalin
2.2 黄芩苷对白念珠菌线粒体膜电位 (MMP)的影响 黄芩苷作用于白念珠菌细胞后,反映MMP的平均荧光指数 (MFI)随着药物浓度的升高而降低。正常对照组 MMP值为202.88±12.20,10 μmol/L组MMP值为189.60±11.57,两者无显著性差 异。100 μmol/L,1 000 μmol/L 浓 度 组 的MMP值分别为167.46±9.61和161.38±9.10,与正常对照组相比较,有显著性差异 (P<0.05),但100 μmol/L和1 000 μmol/L浓度组之间MMP值无显著性差异,见图2。
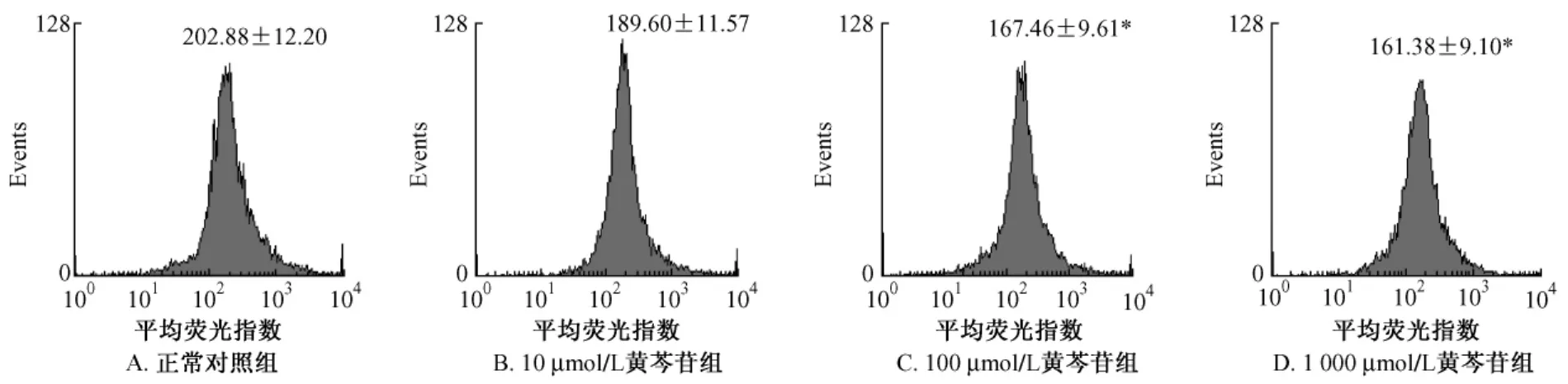
图2 流式细胞仪检测黄芩苷作用后的白念珠菌线粒体膜电位Fig.2 Flow cytometryic analysis of MMP in baicalin-treated Candida albicans
2.3 黄芩苷对白念珠菌胞内活性氧 (ROS)水平的影响 黄芩苷作用于白念珠菌细胞后,反映ROS水平的平均荧光指数 (MFI)随着药物浓度的递增而升高。正常对照组细胞释放ROS水平较低,MFI为28.50 ±2.16,而 10 μmol/L 组、100 μmol/L组、1 000 μmol/L组的MFI分别为54.98±4.30,78.16±5.86和145.38±9.70,与正常对照组相比,有显著性差异 (P<0.05),黄芩苷浓度越高诱导白念珠菌细胞释放出的ROS越多,见图3。
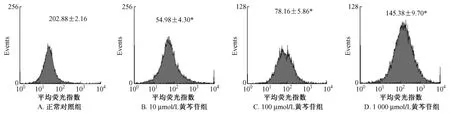
图3 流式细胞仪检测黄芩苷作用后的白念珠菌胞内活性氧 (ROS)水平Fig.3 Flow cytometryic analysis of intracellular ROS accumulation in baicalin-treated Candida albicans
3 讨论
黄芩苷 (baicalin)是中药黄芩的主要有效成分。有文献报道,黄芩苷具有抗炎、抗病毒、抗肿瘤、抗内毒素休克等药理活性[5],并对皮肤致病性真菌与多种细菌在内的病原微生物均具有较强的抑制作用[6]。本课题组前期研究发现黄芩苷对白念珠菌的黏附及生物被膜形成具有一定的抑制作用[2-3];熊英等证实黄芩苷体外通过抑制白念珠菌的DNA、RNA、蛋白质的生物合成导致菌细胞死亡而起到杀菌作用[7]。但黄芩苷是否能通过诱导凋亡来抗白念珠菌尚未见报道。本研究即是在原有工作基础上对黄芩苷抗白念珠菌作用机制的进一步深入探讨。
凋亡是真核细胞常见的生理现象,白念珠菌为真核微生物,近年来人们发现白念珠菌也存在凋亡现象。Phillips与杨丞喆等用乙酸成功地诱导白念珠菌凋亡[4,8];AL-Dhaheri等也观察到两性霉素 B能诱导生物被膜状态的白念珠菌发生凋亡[9]。这些研究表明有望通过药物诱导白念珠菌凋亡作为抗真菌的一个重要手段。
细胞凋亡过程中,细胞核会发生固缩、碎裂、溶解等一系列变化。本实验中,1 000,100 μmol/L的黄芩苷作用后,荧光显微镜下能直接观测到经Hoechst 33258染色所显示的细胞核形态变化,即白念珠菌细胞核呈浓染致密、固缩状态或颗粒状荧光,但10 μmol/L的黄芩苷对菌细胞核无明显影响。
线粒体不仅是维持细胞生命活动重要的细胞器,同时也在凋亡通路中发挥重要作用。一定水平的线粒体膜电位 (MMP)的维持是线粒体发挥功能的必要前提,MMP若下降会启动细胞凋亡级联反应,细胞即进入不可逆的凋亡过程[10]。在乙酸、两性霉素B等诱导下,细胞可通过线粒体途径而进入凋亡过程。本实验中,流式细胞术检测的MMP结果显示,黄芩苷作用于白念珠菌细胞后,MMP随药物浓度递增而呈下降趋势,提示黄芩苷可能通过线粒体途径诱导白念珠菌细胞凋亡。活性氧 (ROS)是真核细胞有氧呼吸过程中形成的一组化学性质活泼的具有含氧基团的化合物,且与MMP密切相关。ROS过多累积会损伤核酸、蛋白质和磷脂膜等重要细胞组分,并可降低MMP,从而诱导凋亡[11]。本实验显示,随着黄芩苷浓度增高,白念珠菌细胞产生的ROS也逐渐增多,提示一定浓度的黄芩苷可能促进ROS的产生进而诱发凋亡。
从天然产物中寻找具有抗真菌活性的天然有效成分并深入阐明其作用机制,进一步将其开发应用已成为抗真菌新药研究的重要方向。本研究表明,中药有效成分黄芩苷可以通过线粒体途径即降低MMP和促进ROS累积而诱导白念珠菌凋亡。近期国内姜远英课题组发现黄芩的另一有效成分黄芩素(baicalein)也可通过诱导白念珠菌凋亡抑制其生长[12-13],黄芩苷与黄芩素均可通过诱导凋亡方式抗白念珠菌,不仅有助于阐明黄芩及其有效成分抗真菌的作用机制,亦为其临床防治白念珠菌感染提供重要依据。
[1]Fridkin S K,Jarvis W R.Epidemiology of nosocomial fungal infections[J].Clin Microbiol Rev,1996,9(4):499-511.
[2]汪长中,冯 鑫,张晓露,等.黄芩苷对白念珠菌芽管形成及粘附性的影响[J].中国中药杂志,2010,35(23):3216-3218.
[3]汪长中,程惠娟,徐 颖,等.黄芩苷体外抗白念珠菌生物膜作用的研究[J].上海中医药杂志,2008,42(8):78-80.
[4]Phillips A J,Sudbery I,Ramsdale M,et al.Apoptosis induced by environmental stress and amphotericin B inCandida albicans[J].Proc Natl Acad Sci USA,2003,100(24):14327-14332.
[5]延卫东,王瑞君,何 琰,等.黄芩苷药理作用研究进展[J].陕西中医,2002,23(12):1127-1129.
[6]季宇彬.中药有效成分药理与应用[M].黑龙江科学技术出版社,2004:60-62.
[7]熊 英,傅颖媛,况南珍,等.黄芩苷抗白念珠菌作用及机制研究[J].中国药理学通报,2004,20(12):1404-1407.
[8]杨丞喆,宫玮玉,卢境婷,等.口腔白色念珠菌凋亡现象的初步研究[J].上海口腔医学,2008,17(5):492-495.
[9]AL-Dhaheri R S,Douglas L J.Apoptosis inCandida albicansbiofilms exposed to amphoterincin B [J].J Med Microbiol,2010,59(2):149-157.
[10]Jeong S Y,Seol D W.The role of mitochondria in apoptosis[J].BMB Reports,2008,41(1):11-22.
[11]Circu M L,Aw T Y.Reactive oxygen species,cellular redox systems,and apoptosis[J].Free Radic Biol Med,2010,48(6):749-763.
[12]Dai B D,Cao Y Y,Huang S,et al.Baicalein induces programmed cell death inCandida albicans[J].J Microbiol Biotechnol,2009,19(8):803-809.
[13]Fu Z,Lu H,Zhu Z,et al.Combination of baicalein and Amphotericin B acceleratesCandida albicansapoptosis[J].Biol Pharm Bull,2011,34(2):214-218.

