益气化瘀化痰养阴方剂对肝纤维化大鼠TGF-β1表达的影响
李 艳, 曹文富
(重庆医科大学中医药学院,重庆401331)
肝纤维化是肝脏遭到各种致病原侵袭时,肝脏细胞外基质分泌与降解失衡,从而在肝细胞间隙可逆性沉积的结果[1]。当前痰浊胶结加之气虚血瘀促成肝纤维化是目前中医医学家对肝纤维化核心病机的共识。多年来,中医治疗肝纤维化取得了较好的临床效果,但是如何以更科学手段和方法来揭示中医治疗效果,同时,反过来更有益指导中医临床治疗成为当前重要科学问题。近年诸多文献有采用突出益气、化瘀、化痰、养阴等方法治疗肝纤维化,以及突出几种配伍方法结合治疗肝纤维化的文献报道,但是依然不能揭开这些方法治疗的有效性能,对其效价不能进行单独评价和衡量。益气、化瘀、化痰、养阴四法单独应用和合用到底有什么疗效上的区别依然是困惑中西医临床的重要问题。许多文献表明,TGF-β1是目前已知致肝纤维化最强的细胞因子,在形成肝纤维化的过程中起着至关重要的作用,以作为检测肝纤维化的重要标志物[2-3]。因此,在本研究中分别采用益气、化瘀、化痰、养阴单剂和合剂治疗肝纤维化,通过检测肝纤维化程度和TGF-β1作为中药治疗肝纤维化的疗效指标,以期初步揭示益气、化瘀、化痰、养阴四法单剂与合剂的治疗效价,有益今后判断用药的选择。
1 材料与方法
1.1 材料与试剂 雄性SD大鼠130只,清洁级,体质量180~220 g,由重庆医科大学动物中心提供[许可证号 syxk(渝)20070001]。兔抗 TGF-β1(abcom),RNA提取相关试剂 (天根公司),TRPCR逆转录试剂盒 (东洋纺),BCA试剂盒、蛋白裂解液 (碧云天公司),山羊HRP标记二抗 (北京中杉)。
1.2 药物 (1)精选中药黄芪、白术,按1∶1比例配伍,混合水提并浓缩成益气饮 (每1 mL含生药2 g)。
(2)精选中药川芎、姜黄,按1∶1比例配伍,混合水提并浓缩成化瘀饮 (每1 mL含生药2 g)。
(3)精选中药半夏、海藻,按1∶1比例配伍,混合水提并浓缩成化痰饮 (每1 mL含生药2 g)。
(4)精选中药鳖甲、白芍,按2∶1比例配伍,混合水提并浓缩成养阴饮 (每1 mL含生药2 g)。
(5)精选中药黄芪、白术、川芎、姜黄、半夏、海藻、白芍、鳖甲,按1∶1∶1∶1∶1∶1∶1∶2比例配伍,混合水提并浓缩成益气化瘀化痰养阴的合剂 (每1 mL含生药2 g)。
1.3 方法
1.3.1 动物分组 130只雄性SD大鼠,随机分为正常对照组10只、肝纤维化模型组20只、益气组20只、化瘀组20只、化痰组20只、养阴组20只、合剂组20只。
1.3.2 造模方法 除正常对照组大鼠给予正常普通饲料喂养外,其余各组大鼠:(1)给予39.5%玉米面+40%面粉+20%猪油+0.5%胆固醇组成的高脂低蛋白饲料;(2)采用背部皮下注射40%CCl4油剂,每周2次,共计12周。第一周的2次皮下注射剂量皆为0.5 mL/100 g体质量,以后每次注射剂量为0.3 mL/100g体质量,安排每周星期2和星期5进行。建立肝纤维化大鼠模型,并将试验大鼠随机分入相应各组;(3)每天5%酒精作为唯一饮料。造模12周后,死亡率为55%左右,即除正常对照组大鼠无死亡外,其它6组实验组,每组平均剩9只SD肝纤维化大鼠,只对益气组、化瘀组、养阴组、化痰组、合剂组此5组用药。中药的用量,黄芪、白术、川芎、姜黄、半夏、海藻、白芍皆为6 468 g,鳖甲12 936 g。
1.3.3 给药方法 (1)益气组、化瘀组、化痰组、养阴组、合剂组,各组剩下的9只实验大鼠用相对应的中药饮剂——益气饮、化瘀饮、化痰饮、养阴饮及合剂灌胃;每只大鼠按约3 mL/(100 g·d)剂量灌胃;(2)肝纤维化模型组:9只大鼠生理盐水灌胃 (剂量约3 mL/(100 g·d);(3)正常对照组:10只大鼠生理盐水灌胃 (剂量约3 mL/(100 g·d)。连续14周。
1.3.4 标本留取 最后一次用药后24 h,免疫组化标本采用心脏灌注方法取标本,电镜和分子生物学标本采用麻醉大鼠,断头处死大鼠取肝脏,取部分肝组织用10%中性福尔马林溶液或戊二醛-锇酸双重固定,待做免疫组化或电镜检查,其余标本于液氮中冷冻后再转移到-70℃冰箱中保存。
1.4 观察指标
1.4.1 电镜观察 电镜显示各实验组肝脏的超微结构变化、胶原纤维的沉积情况等。见图1.
1.4.2 Masson三色胶原染色 对肝组织石蜡切片进行Masson法常规纤维染色,光镜观察肝纤维化程度等。
1.4.3 RT-PCR法检测肝组织TGF-β1 mRNA表达提取大鼠肝组织总RNA,然后在42℃20 min条件下逆转录为 cDNA。于 genebank中查的大鼠TGF-β1和GAPDH整个核酸序列,利用Premier5.0查得其引物详见下列,退火温度56℃。PCR反应条件预变性94℃ 4 min,变性94℃,30 s,退火56℃ 30 s,延伸72℃ 1 min,共30个循环,最后72℃延伸5 min。反应结束后取PCR产物再浓度为1.5%琼脂糖凝胶进行电泳。在紫外灯光下观察电泳结果,并用凝胶在Bio-Rad公司所生产的凝胶成像仪上用Quantityone图像分析软件进行照相分析。各条带的相对光密度值=目的条带光密度值/内参GAPDH条带光密度值。
GAPDH:上游:GTGGAGTCTACTGGCGTCTT;下游:GTCTTCTGAGTGGCAGTGAT,扩增275 bp
TGF-β1: 上 游:CATGGAGCTGGTGAAACG;下游:TGAAGCGAAAGCCCTGTA,扩增548 bp
1.4.4 Western blot法检测肝组织TGF-β1蛋白表达 肝脏组织,加入10倍体积的组织裂解液匀浆,冰浴30 min后,4℃ 12 000 r/min离心30 min,取上清,BCA试剂盒蛋白定量,组织总蛋白加入上样缓冲液煮沸变性。30 g蛋白经15%SDS-PAGE胶分离后转移到PVDF膜,3%BSA室温封闭2 h,加入一抗4℃过夜,TBS-T洗膜后加HRP标记的二抗,室温孵育2 h,加入ECL发光液,经EC检测系统检测各组TGF-β1蛋白表达。
1.5 统计学方法 采用SPSS18.0统计软件包进行数据处理,计量资料采用用方差分析和LSD检验,以P<0.05确定差异有统计学意义。
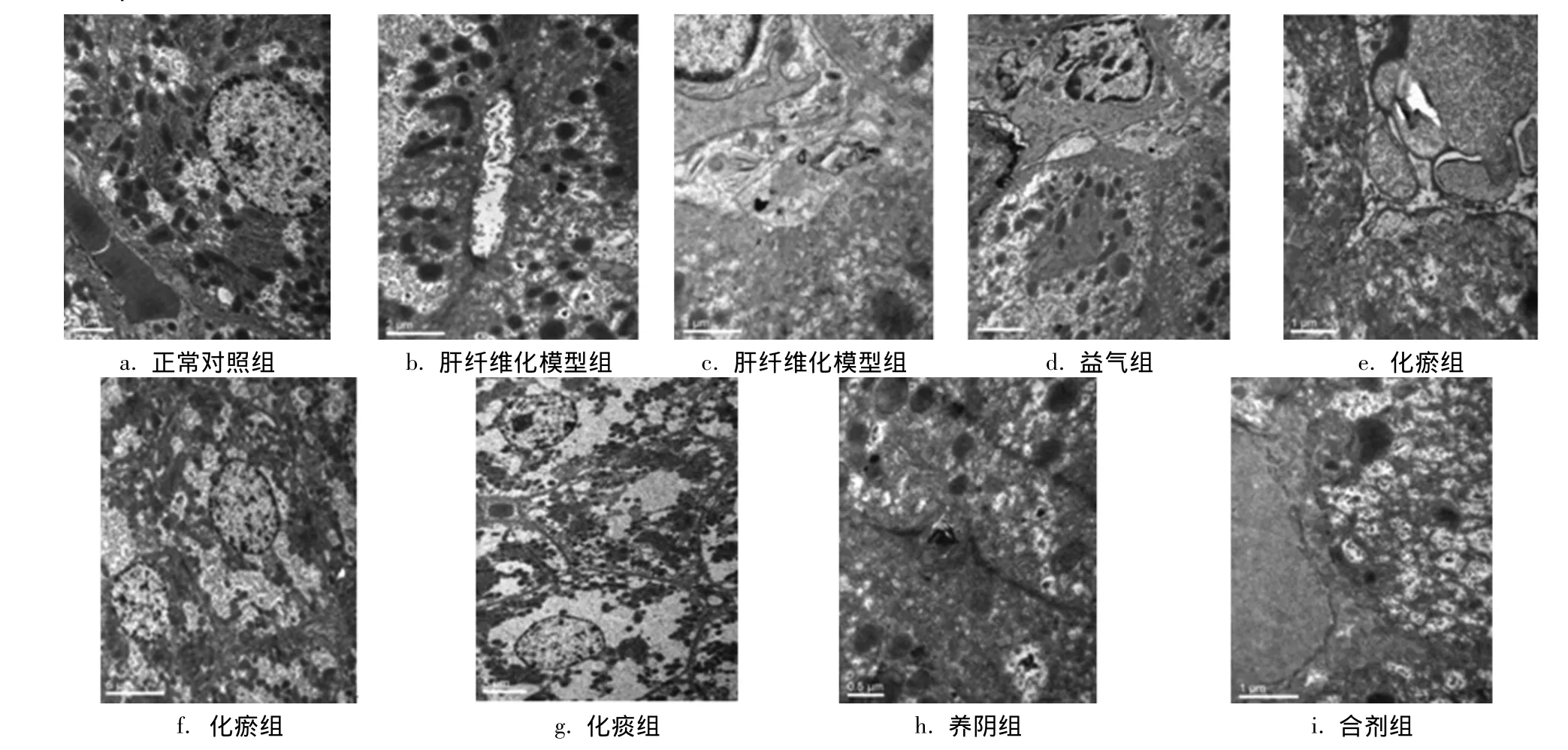
图1 各组大鼠益气化瘀化痰养阴单剂与合剂对肝纤维化大鼠肝组织电镜影响变化Fig.1 Effects of electron microscope on rats of hepatic fibrosis by single prescriptions and mixture of benefiting“qi”,removing blood stasis,reducing phlegm and nourishing“yin”
2 结果
2.1 电镜结果 正常对照组大鼠肝组织切片电镜显示,肝组织一切正常,其周围无明显胶原纤维沉积 (见图1a)。肝纤维化模型组可见胆小管扩张(见图1b),肝组织大量胶原纤维沉积 (见图1c)。益气组可见内皮细胞肿胀、见髓样变,少量胶原纤维沉积 (见图1d)。化瘀组可见血窦内微绒毛轻微肿胀和变性 (见图1e),胆小管改变不明显,极轻微扩张,少量细胞见脂滴 (见图1f)。化痰组可见肝细胞肿胀,有部分溶解,肝细胞间隙增大,胆小管扩张,内见髓样变 (见图1g)。养阴组可见毛细血管内皮细胞肿胀、溶解,胆小管未见扩张,胞浆有很轻微的溶解 (见图1h)。合剂组可见正常肝细胞,血窦内微绒毛改变不明显 (见图1i)。
2.2 Masson三色胶原染色结果 正常对照组大鼠肝组织切片显示,肝组织一切正常,其周围无明显胶原纤维沉积 (见图2a)。肝纤维化模型组可见肝组织内大量胶原纤维沉积 (见图2b、2c)。益气组(见图2d)、化痰组 (见图2e)、化瘀组 (见图2f)、养阴组 (见图2g)皆可见肝内胶原纤维组织中度增生。合剂组肝内胶原纤维组织增生不明显(见图2h)。
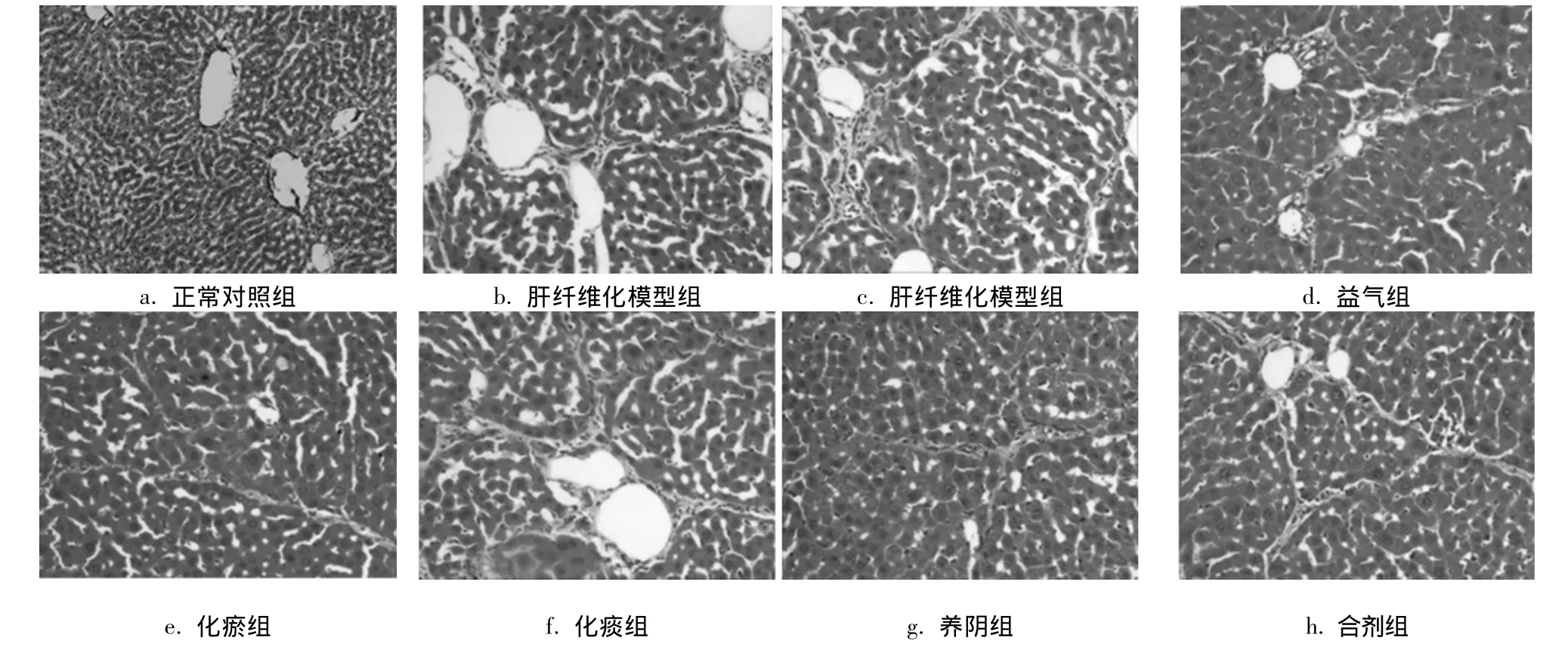
图2 益气化瘀化痰养阴单剂与合剂对肝纤维化大鼠肝组织的Masson三色胶原染色 (×400)Fig.2 The VG staining in the rats of hepatic fibrosis by single presctiptions and mixture of benefiting“qi”,removing blood stasis,reducing phlegm and nourishing“yin”(×400)
2.3 RT-PCR检测TGF-β1 mRNA的表达 与肝纤维化模型组相比,益气组、化瘀组、化痰组、养阴组中大鼠肝组织 TGF-β1基因表达降低 (P<0.01),其中养阴组与化瘀组、益气组、化痰组相比,大鼠肝组织TGF-β1基因表达相对明显降低(P<0.05)。与益气组、化瘀组、化痰组、养阴组相比,合剂组中大鼠肝组织TGF-β1基因表达明显降低 (P<0.05)见图3,表1。
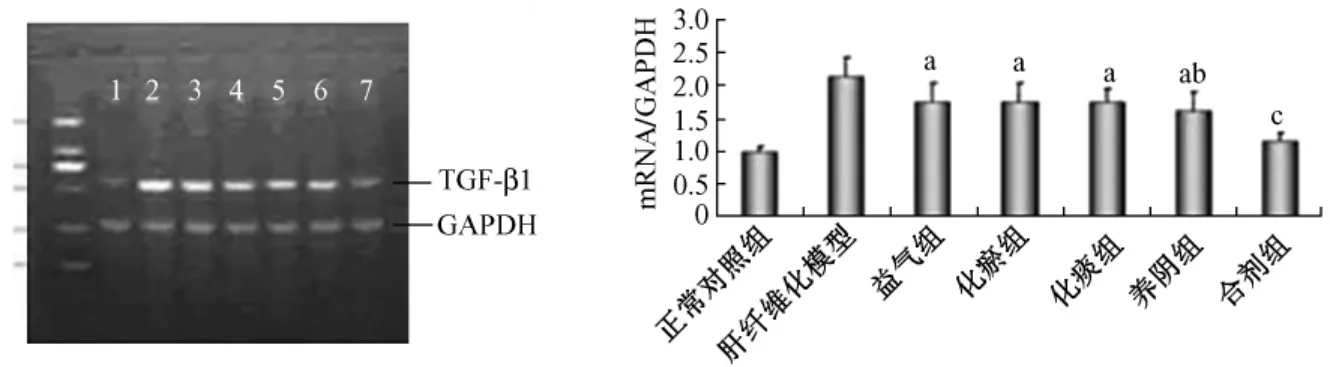
图3 益气化瘀化痰养阴单剂与合剂对肝纤维化大鼠TGF-β1mRNA的表达影响Fig.3 Effects of TGF-β1 TGF-β1mRNA expression on rats of hepatic fibrosis by single prescriptions and mixture of benefiting“qi”,removing blood stasis,reducing phlegm and nourishing“yin”
2.4 Western Blot法检测肝组织TGF-β1蛋白表达 与肝纤维化模型组相比,益气组、化瘀组、化痰组、养阴组中大鼠肝组织TGF-β1蛋白表达降低(P<0.01),其中养阴组与化瘀组、益气组、化痰组相比,大鼠肝组织TGF-β1蛋白表达相对明显降低 (P<0.05);与益气组、化瘀组、化痰组、养阴组相比,合剂组中大鼠肝组织TGF-β1蛋白表达明显降低 (P<0.05)见图4。
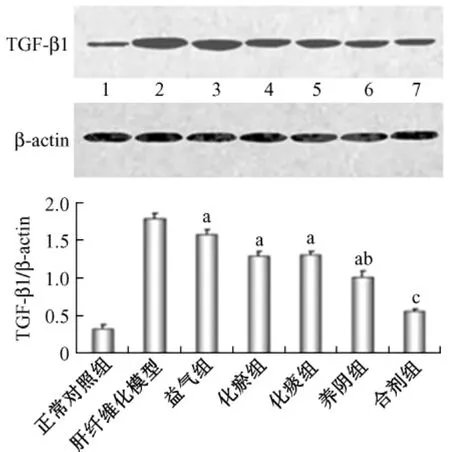
图4 益气化瘀化痰养阴单剂与合剂对肝纤维化大鼠TGF-β1蛋白的表达影响Fig.4 Effects of TGF-β1 TGF-β1 protein expression on rats of hepatic fibrosis by single prescriptions and mixture of benefiting“qi”,removing blood stasis,reducing phlegm and nourishing“yin”
3 讨论
肝纤维化是由各种致病因子所致肝内结缔组织异常增生,导致肝内弥漫性细胞外基质过度沉淀的病理过程,作为一种慢性、进行性、弥漫性的肝脏病变,治疗不及时或治疗不当都可使其发展为肝硬化。许多文献表明,TGF-β1是目前已知致肝纤维化最强的细胞因子,在形成肝纤维化的过程中起着至关重要的作用[2]。在血液中,TGF-β1作为一种失活的蛋白能够被多种因素激活[4-5]。激活的TGF-β1具有内分泌和旁分泌的作用,通过结合肝细胞表面的TGF-β1受体,来激活MAPK和Smad信号通路促使肝星状细胞活化[6],从而导致过量细胞外基质的沉积[7],最终导致肝纤维化。前述说明TGF-β1在肝纤维形成过程中起着重要的作用,可以用来作为肝纤维化的重要参考指标。
本实验结果显示,益气、化瘀、化痰、养阴单剂均能够降低肝纤维化模型组肝组织内纤维化程度,但是它们之间却有降低程序的差异。在单独的四种方法治疗中,养阴法治疗效果最好,益气法治疗效果最差,化瘀法与化痰法之间差异不大,说明化瘀与化痰在治疗上均达到同等的效果。四种单独治疗方法的比较,使今后在用药文献更趋于重养阴之法。研究发现,与单剂相比,共用益气化瘀化痰养阴四法更能够有效降低肝组织内纤维化程度,说明单独治疗虽然不能完全达到最好的疗效,但是它们在共同配伍之中却起到更好的治疗作用。
肝纤维化属于近代医学提出的西医诊断名称,中医学领域根据临床症候特点,可归属于中医“胁痛”、“积聚”、“痰凝”、“黄疸”等病范畴,而中医治疗突出整体观念和辨证论治,所以治疗方法也多异,无完全统一的治疗模式和方法。其总体病机既可归结于气虚使津液不能正化,故凝而为痰;又可为外感六淫、内伤七情、饮食失当等多种致病因素致气机阻滞而致病;另外正如《血证论》中所云“血不利则为水,水凝而成痰”,“血积既久,亦能化为痰水”,“久病血运不利”,最终形成肝纤维化病机的中心环节是痰浊胶结加之气虚血瘀促成。痰阻则气血不利,而致血滞血瘀,加之痰浊与瘀血互为因果,互相转化,相互胶结,脏腑气血功能日益虚损和失调,而致顽症重症,病情缠绵难愈。近些年来,采用益气活血、化瘀化痰、养阴软坚等均可以有效延缓或抑制治疗肝纤维化进程,取得了较好的疗效。养阴药中鳖甲味咸,性微寒,归肝、肾经,具有滋阴潜阳、软坚散结、退热除蒸等功效。鳖甲含骨胶原、碳酸钙、磷酸钙、中华鳖多糖和17种氨基酸,还含有十多种微量元素,可提高机体免疫力,其所含的大量氨基酸具有抑制肝脏纤维增生、促进肝内新生纤维吸收的作用,成为治疗肝纤维化应用最广的药物之一[8]。白芍是我国传统中药,具有养血柔肝、缓中止痛、敛阴收汗之功效。白芍总苷是白芍根中提取的有效部位,具有明显的抗炎、免疫调节和抗氧化等作用,能够降低肝纤维化大鼠血清中丙氨酸氨基转移酶,天冬氨酸氨基转移酶,透明质酸以及PCⅢ胶原的水平,抑制肝星状细胞的功能及促进其凋亡等,从而对肝纤维化大鼠具有良好的防治作用[9]。另外有研究表明,姜黄、黄芪、川芎等药物可以显著抑制实验性肝纤维化大鼠模型的肝纤维化,其机制可能与抑制TGF-β1的表达有关[10];复方黄芪颗粒可以在蛋白水平增强MMP-2酶蛋白的表达,同时抑制TIMP-2酶蛋白的表达,促进ECM的降解,从而达到逆转肝纤维化的目的[11]。本实验通过益气化瘀化痰养阴法单剂和合剂,通过抑制TGF-β1产生和表达,从而抑制细胞外基质形成和促进细胞外基质的降解,改善肝组织器官代谢状况等途径,从而抑制与延缓肝纤维化的进程,控制肝纤维化这类难治性疾病的进展[12]。
总之,本研究提示益气、化瘀、化痰、养阴四法单剂治疗都可以降低肝组织内纤维化程度,但也有程度差异;四剂合用更能够明显降低肝组织内纤维化程度,说明益气化瘀化痰养阴法对肝纤维化能达到更好的疗效,这种治疗特点可以有效指导临床,对于深入阐释中医药益气化瘀化痰养阴法治疗肝纤维化的机制,不断提高中医药防治肝纤维化的水平,促进学科进步具有重要意义。
[1]Cheng K,Yang N,Mahato R I.TGF-beta1 gene silencing for treating liver fibrosis[J].Mol Pharm,2009(6):772-779.
[2]Pinzani,M,Marra F,Carloni V.Signal transduction in hepatic stellate cells[J].Liver,1998,18(1):2-13.
[3]Lin W,Tsai W L,Shao R X,et al.Hepatitis C virus regulates transforming growth factor beta1 production through the generation of reactive oxygen species in a nuclear factor kappaB-dependent manner[J].Gastroenterology,2010,138(7):2509-2518.
[4]Dennis P A,Rifkin D B.Cellular activation of latent transforming growth factor beta requires binding to the cation-independent mannose 6-phosphate/insulin-like growth factor type II receptor[J].Proc Natl Acad Sci USA.1991,88(2):580-584.
[5]Schultz-Cherry S,Murphy-Ullrich J E.Thrombospondin causes activation of latent transforming growth factor-beta secreted by endothelial cells by a novel mechanism[J].J Cell Biol,1993,122(4),923-932.
[6]Takekawa M,Tatebayashi K,Itoh F,et al.Smad-dependent GADD45beta expression mediates delayed activation of p38 MAP kinase by TGF-beta[J].EMBO J,2002,21(23):6473-6482.
[7]Wells R G.TGF-beta signaling pathways[J].Am J Physiol Gastrointest Liver Physiol,2000,279(5):G845-850.
[8]彭龙希,刘红艳,方步武.蒿鳖养阴软坚方对刀豆球蛋白A诱导的肝纤维化的预防作用研究[J].中国药房,2011,22(11):967-970.
[9]路景涛,孙妩弋,刘 浩,等,白芍总苷对免疫性肝纤维化大鼠肝组织NF-κB和 TGF-β1蛋白表达的影响[J].中国药理学通报,2008,24(5):588-592.
[10]马桂凤,王 莉,季万胜,等.黄芪注射液对肝纤维化大鼠模型肝细胞胶原及TGF-β1的影响[J].潍坊医学院学报,2007,29(6):535-536.
[11]张 技,李 筠,赵景民,等.复方黄芪颗粒对肝纤维化大鼠肝脏基质金属蛋白酶-2、金属蛋白酶组织抑制因子-2蛋白表达的影响[J].中西医结合肝病杂志,2008,18(4):242-244.
[12]Ueno H,Sakamoto T,Nakamur T,et al.A soluble transforming growth factor beta receptor expressed in muscle prevents liver fibrogenesis and dysfunction in rats[J].Hum Gene Ther,2000,11(1):33-42.

