螺旋藻粉β-胡萝卜素含量测定方法的优化*
赵 楠,李勇勇,邵明飞,郁章玉,3,秦 松
(1.曲阜师范大学化学与化工学院,山东 曲阜 273165;2.南京农业大学资源与环境科学学院江苏省海洋生物学重点实验室,江苏 南京 210095;3.菏泽学院化学与化工系,山东 菏泽 274015;4.中国科学院烟台海岸带研究所生物资源实验室,山东 烟台 264003)
螺旋藻是丝状的多细胞蓝藻,具有很高的药用及营养价值,被联合国粮油组织推荐为“21世纪最优秀的食品”.螺旋藻中β-胡萝卜素的含量非常丰富,所含的 β-胡萝卜素达 1 700 mg/kg(干重)[1].β-胡萝卜素是维生素A的前体物质,大量研究证实β-胡萝卜素是有效的抗氧化剂,能消除人体中的活性氧,消除自由基,在防癌[2]抗癌[3]、预防心血管疾病,增强免疫功能[4]等方面有明显作用[5].螺旋藻粉中的β-胡萝卜素含量为所有食物之冠,比胡萝卜中的β-胡萝卜素含量还要高出10倍[6].β-胡萝卜素作为螺旋藻综合开发利用的一种功能因子,有很大的商业化前景.因此,有关螺旋藻中β-胡萝卜素成分的研究和测定方法倍受重视.目前常用的测定β-胡萝卜素含量的方法有纸层析法、分光光度法和高效液相色谱法[7,8].由于高效液相色谱法样品的前处理较为麻烦且所需仪器昂贵,所以还未能广泛普及.而纸层析法步骤比较繁琐,故本文采用分光光度法进行螺旋藻粉β-胡萝卜素含量的测定,并对该方法操作条件进行优化.
1 材料与方法
1.1 材料
螺旋藻粉,2011年12月份购于广西,置于阴凉抽屉中避光保存.
1.2 试剂与仪器
仪器:恒温水浴锅,上海福玛试验设备有限公司产品;电子分析天平,上海舜宇恒平科学仪器有限公司产品;TU-1901紫外可见分光光度计,北京普析通用有限责任公司产品;50 mL具塞比色管,分液漏斗等.
试剂:标准β-胡萝卜素(Sigma公司产品,质量分数>97%),无水硫酸钠、正庚烷、丙酮、无水乙醇、甲苯、乙酸乙酯、氯仿、甲醇、石油醚均为国产分析纯.
1.3 β-胡萝卜素最大吸收波长的测定及标准曲线的绘制[5]
取一定量的β-胡萝卜素标准品,溶解在石油醚中,在波长300~600 nm范围内,用紫外可见分光光度计进行波谱扫描,得到 β-胡萝卜素的特征吸收峰,作为β-胡萝卜素的测定波长.
准确称取2.50 mg β-胡萝卜素标准品,溶于石油醚,并定容于100 mL棕色容量瓶中,配制成25 ug/mL的β-胡萝卜素标准溶液,分别吸取0.2,0.4,0.6,0.8,1.0 mL 于 5 个 10 mL 棕色容量瓶中,用石油醚定容,以石油醚为参比溶液,在450 nm处测定各样品的吸光度,并绘制标准曲线.
1.4 样品的测定
准确称取0.2 g左右的螺旋藻藻粉于50 mL的比色管中,加入30 mL提取剂和1 mL质量浓度为400 g/L的KOH溶液,混合均匀;比色管放于35℃恒温水浴中浸泡12 h后,将浸泡液过滤,滤液倒入内盛50 mL的20 g/L硫酸钠溶液的250 mL分液漏斗中,用10 mL提取剂冲洗滤渣,重复两次,将洗液、过滤液收集到分液漏斗中.向分液漏斗中加入30 mL乙醚及100 mL蒸馏水,振摇后静置分层,弃去下层溶液,上层溶液再重复萃取两次.萃取所得上层溶液通过一装有10 g无水硫酸钠的小漏斗滤入100 mL棕色容量瓶中,用少量石油醚洗涤分液漏斗,并洗去无水硫酸钠表面的色素,定容至刻度线,摇匀,用分光光度计测定其在450 nm处的吸光度.
1.5 提取剂
在50 mL具塞比色管中加入0.2 g螺旋藻粉后,再分别加入30 mL下列溶液:V(正庚烷)∶V(丙酮)∶V(无水乙醇)∶V(甲苯)=10∶7∶6∶7;V(石油醚)∶V(丙酮)=1∶1;V(甲醇)∶V(石油醚)=2∶1;乙酸乙酯;V(石油醚)∶V(丙酮)=4∶1;V(丙酮)∶V(氯仿)=1∶2;V(丙酮)∶V(甲醇)=7∶2;石油醚.其余步骤按1.4所述步骤进行操作.
1.6 浸提温度
在50 mL具塞比色管中加入0.2 g螺旋藻粉、30 mL 最佳提取剂后,分别于 25,35,45,55,65,75℃恒温水浴中浸泡12 h,其余步骤按1.4所述步骤进行操作.
1.7 提取剂体积
在50 mL具塞比色管中加入0.2 g螺旋藻粉后,再分别加入 15,20,25,30,35,40 mL 最佳提取剂,于最佳浸提温度恒温水浴中浸泡12 h,其余步骤按1.4所述步骤进行操作.
1.8 浸提时间
在50 mL具塞比色管中加入0.2 g螺旋藻粉、最佳提取剂体积的提取剂后,于最佳温度恒温水浴中,分别密封避光浸泡 2,4,6,8,10,12 h,其余步骤按1.4所述步骤进行操作.
1.9 正交试验设计
采用L9(33)正交试验表,以 V(正庚烷)∶V(丙酮)∶V(无水乙醇)∶V(甲苯)=10∶7∶6∶7为提取剂,选取浸提温度、提取剂体积、浸提时间3个因素,每个因素取3个水平,其因素水平见表1.
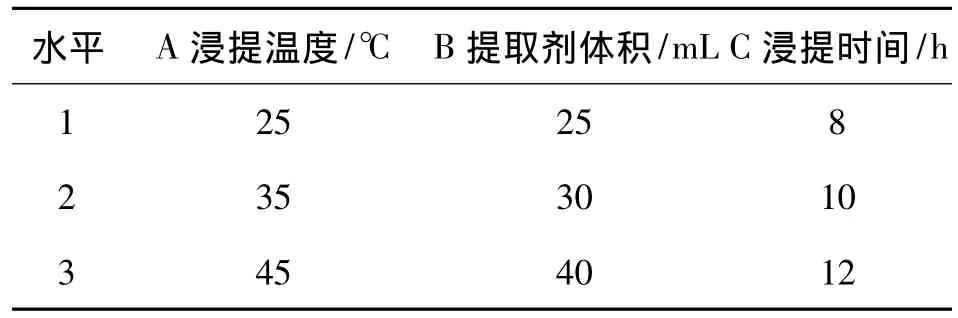
表1 L9(33)正交试验的因素水平
2 结果与分析
2.1 β-胡萝卜素的吸收光谱及标准曲线图
β-胡萝卜素的吸收光谱,如图1所示.从图1可见,β-胡萝卜素在波长300~600 nm范围内有两处较大的吸收峰,其中在450 nm处吸收峰值最大,是β-胡萝卜素的特征吸收峰,本试验选择450 nm作为β-胡萝卜素的测定波长.
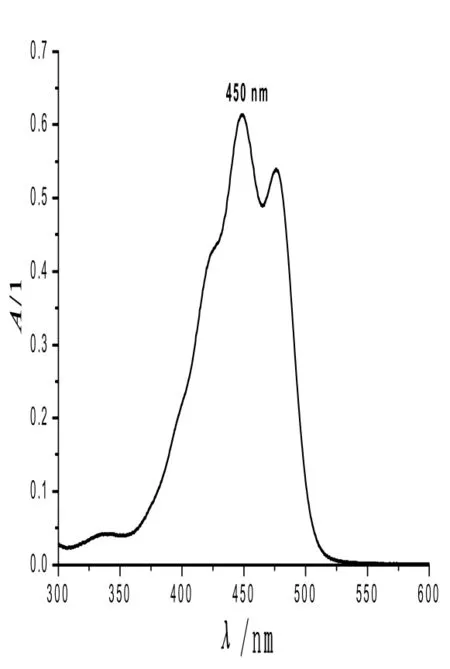
图1 β-胡萝卜素光谱扫描曲线
β-胡萝卜素的质量浓度(ρ)在0~2.5 ug/mL范围内与吸光度值(A)呈现很好的线性关系,如图2所示.其标准曲线公式为:A=0.308 9ρ-0.008 8,r2=0.999 5.
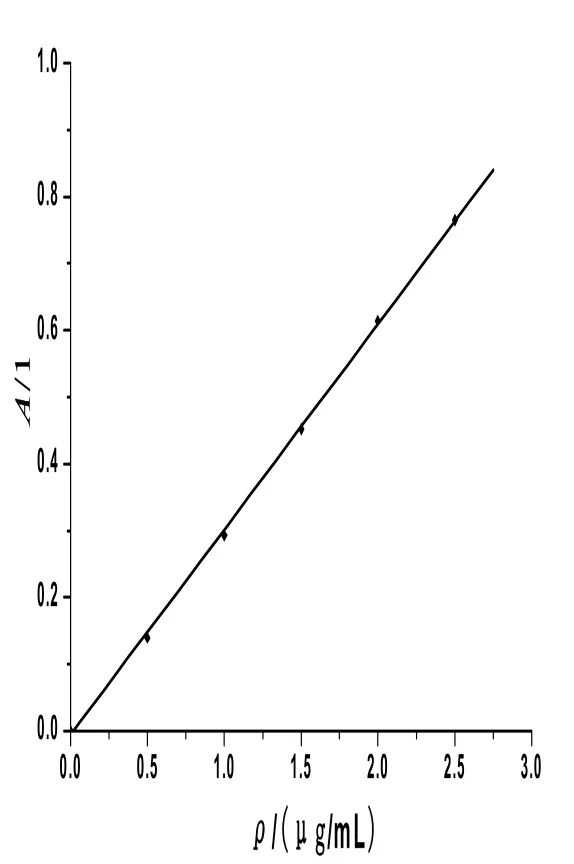
图2 β-胡萝卜素的标准曲线
2.2 提取剂对β-胡萝卜素含量测定的影响
各提取剂对β-胡萝卜素含量测定的影响见表2.由表2知,V(正庚烷)∶V(丙酮)∶V(无水乙醇)∶V(甲苯)=10∶7∶6∶7为最佳提取剂,其提取到的β-胡萝卜素含量测定最高,以下实验中均以此为提取剂.
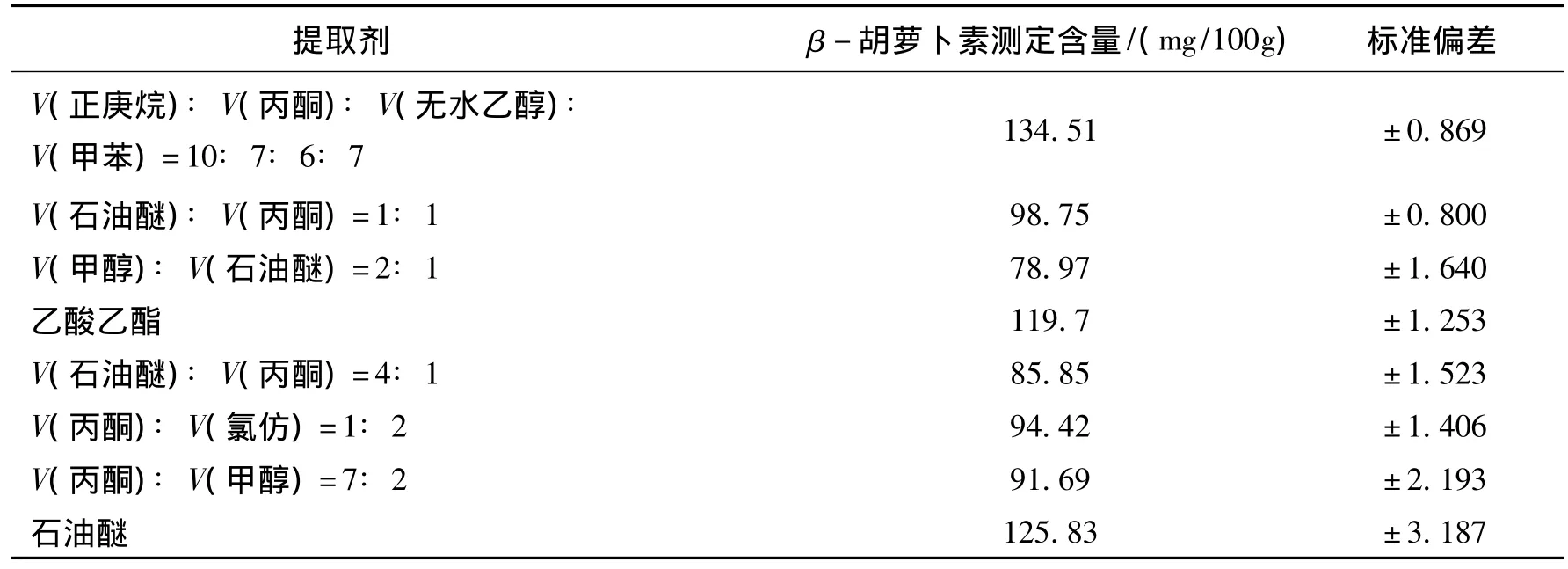
表2 提取剂对β-胡萝卜素含量测定的影响
2.3 浸提温度对β-胡萝卜素含量测定的影响
随着浸提温度的升高,β-胡萝卜素的测定含量呈先增大后减小的趋势,见表3.当恒温水浴温度为35℃时,β-胡萝卜素测定的含量最大,为134.15 mg/100g.此后随着恒温水浴温度的升高,β-胡萝卜素的测定含量开始平缓地减小.这表明适当地提高浸提温度可提高β-胡萝卜素的测定含量,过高的温度可能会影响β-胡萝卜素的稳定性,可能会使β-胡萝卜素发生降解而被破坏,使得β-胡萝卜素的测定含量较低.
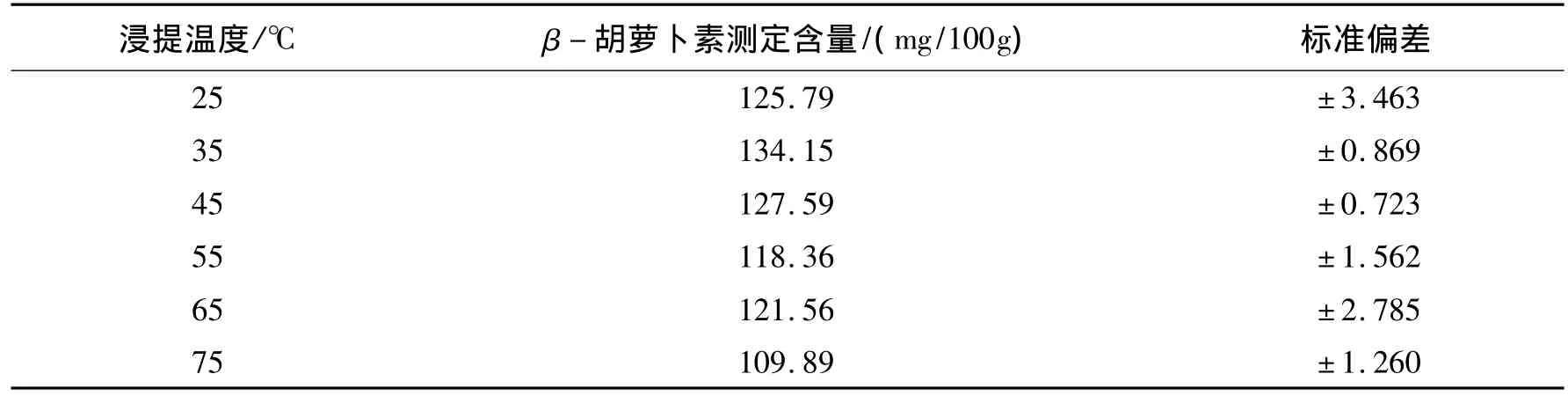
表3 浸提温度对β-胡萝卜素含量测定的影响
2.4 提取剂体积对β-胡萝卜素含量测定的影响
当提取剂体积为30 mL时,提取效果较好,此时提取物中的β-胡萝卜素的测定含量达到最高值,见表4.试验表明,提取剂的体积过大或过小,都不利于β-胡萝卜素的提取,因此30 mL为最佳提取剂体积.
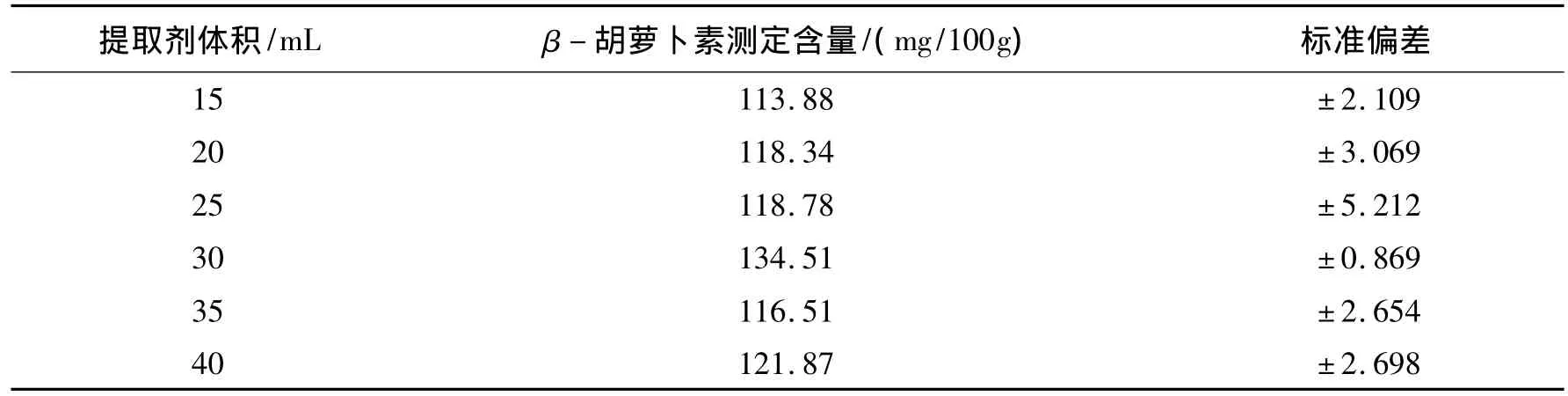
表4 提取剂体积对β-胡萝卜素含量测定的影响
2.5 浸提时间对β-胡萝卜素含量测定的影响
当浸提时间为12 h时,浸提效果最好,此时提取物中的β-胡萝卜素测定含量达到最高值为134.15 mg/100 g,见表5.浸提时间过短,不利于β-胡萝卜素的充分溶出.随着浸提时间的延长,β-胡萝卜素测定含量逐渐增大.
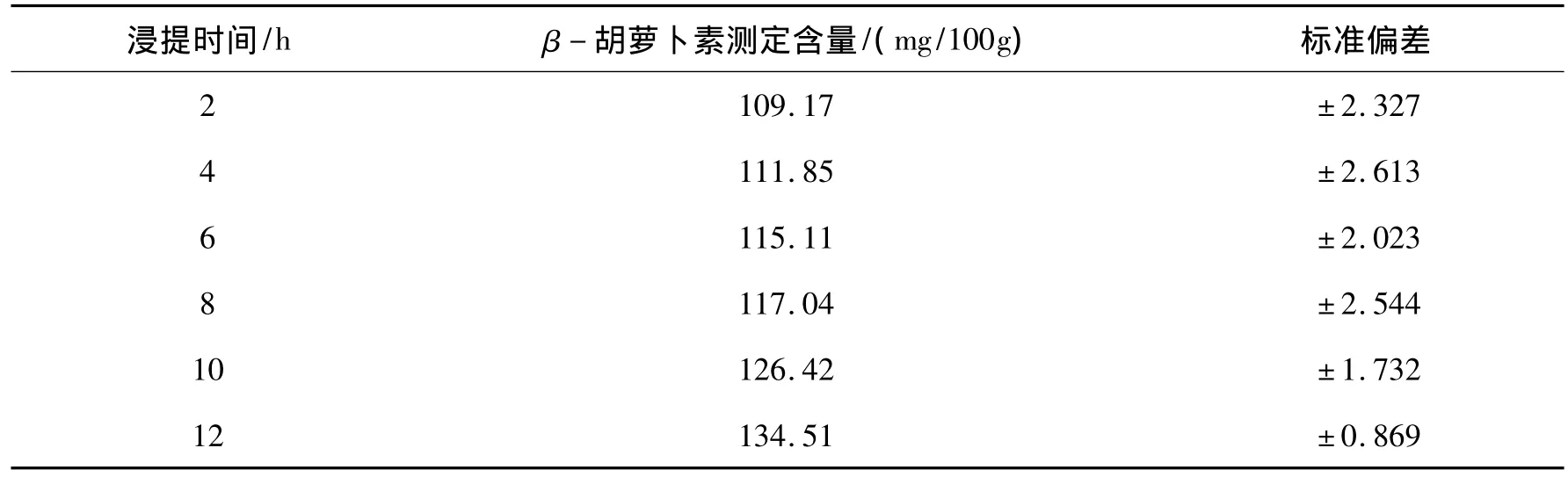
表5 浸提时间对β-胡萝卜素含量测定的影响
2.6 正交设计优化提取工艺
β-胡萝卜素含量测定的正交试验结果见表6.由表6可知,影响β-胡萝卜素含量测定的因素依次为:浸提温度>提取剂体积>浸提时间,最佳提取工艺为A2B2C3,即以V(正庚烷)∶V(丙酮)∶V(无水乙醇)∶V(甲苯)=10∶7∶6∶7为提取剂,提取剂体积为30 mL,浸提时间为12 h,浸提温度为35℃.
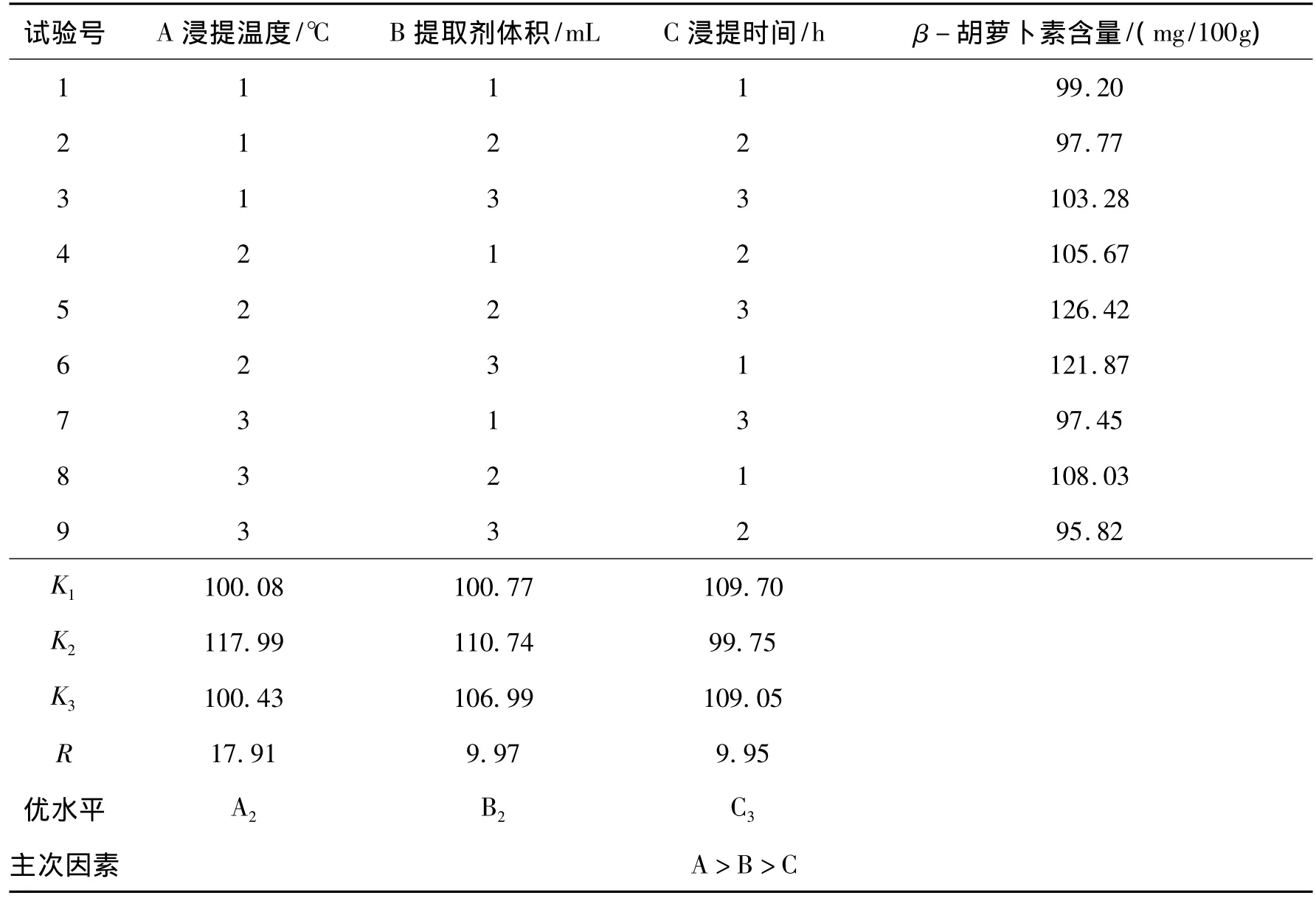
表6 L9(33)正交试验结果与分析
3 讨论与结论
1)β-胡萝卜素易被氧化,见光易分解,故本试验须在遮光条件下进行.样品在提取过程中,遮光条件下浸泡12 h,在一定程度上减少了β-胡萝卜素的损失,从而提高了β-胡萝卜素的测定含量.
2)通过正交试验得出,提取β-胡萝卜素的最佳工艺条件为:V(正庚烷)∶V(丙酮)∶V(无水乙醇)∶V(甲苯)=10∶7∶6∶7为提取剂,提取剂体积为30 mL,35℃下浸提12 h;在最佳工艺条件下β-胡萝卜素的测定含量为134.5 mg/100 g.
3)本试验方法简单,实验所需仪器均较为普通,便于企业生产过程对β-胡萝卜素进行快速检测及监控.
[1]王文博.螺旋藻的生物活性成分分析及其免疫特性研究[D].呼和浩特:内蒙古农业大学,2009.
[2]赵文恩,韩雅珊,苏震,等.类胡萝卜素对H2O2-NaClO体系生成的1O2的淬灭作用[J].生物物理学报,1997,13(1):137-142.
[3]Gregory G K,Chen T S,Philip T.Quantitative analysis of lutein esters in marigold flowers(Tagetes erecta)by high performance liquid chromatography[J].Food Sci,1986,51(4):1093-1095.
[4]房明.螺旋藻β-胡萝卜素的提取及生物活性研究进展[J].现代农村科技,2012,(1):70-71.
[5]李新,安鑫南,刘震.β-胡萝卜素原料筛选及其超临界二氧化碳萃取[J].南京林业大学学报,1999,23(3):37-40.
[6]郑静.螺旋藻化学成分及其生物活性研究[J].科技信息,2009,(7):25-27.
[7]赵厚民,徐慧,周小平.螺旋藻中β-胡萝卜素高效液相色谱测定方法的研究[J].中国野生植物资源,2005,24(3):43-45.
[8]卢红梅,梁逸曾.高效液相色谱法测定食物中的类胡萝卜素[J].色谱,2005,23(1):57-62.

