复合诱变选育高效生物破乳剂产生菌及其特性
刘 畅,杨基先,李 昂,李 旭,马 放,陆 建
(1.哈尔滨工业大学城市水资源与水环境国家重点实验室,150090哈尔滨;2.中国宜兴环保科技工业园科技发展局,214200江苏宜兴)
生物破乳剂的高效性和环保性是化学破乳剂无法比拟的.在原油脱水、油污分离、含油废水处理等领域开发、应用前景十分广阔[1-6].目前,生物破乳剂仍处于实验室研发阶段,无法进行大规模应用,其中野生型生物破乳剂产生菌的破乳能力和破乳活性物质产量较低成为主要限制因素之一.因此,采用人工诱变或生物改造方法对野生型的生物破乳剂产生菌进行改造,提高生物破乳剂的产率及活性,对生物破乳剂的工程化应用具有重要意义.
以人工诱变基因突变为基础的诱变育种方法,如利用物理(紫外辐射、微波)和化学(亚硝基胍、亚硝酸等)诱变获得突变体,已成为发酵工业中获得优良高产菌株的主要途径,也是研究微生物生理代谢机制的主流方法[7-8].传统的诱变育种多采用单一的诱变方法,盲目性和随机性较大,且随着诱变次数的增多,菌种的耐受性增强,诱变效率下降.因此,使用多种诱变方法,通过协同作用进行复合诱变成为诱变育种的一个重要趋势.为提高生物破乳菌的破乳能力,对生物破乳剂产生菌Bacillus mojavensis XH1进行复合诱变育种研究,筛选高效的破乳剂产生菌突变株,为工业生产提供优质的菌种资源.
1 实验
1.1 实验材料
1.1.1 出发菌株
生物破乳剂产生菌株XH1分离自大庆油田受石油污染的土壤,经生理生化及16S rDNA鉴定为芽孢杆菌属莫海威芽孢杆菌(Bacillus mojavensis),由本实验室保藏.
1.1.2 培养基及模型乳状液的配制
筛选培养基:NH4Cl 4.0 g,K2HPO44.0 g,KH2PO46.0 g,MgSO4·H2O 0.2 g,微量元素溶液1 mL,液体石蜡4%(体积分数),去离子水1 L,于121℃下灭菌20 min.
发酵培养基:NH4Cl4.0 g,K2HPO44.0 g,KH2PO46.0 g,MgSO4·H2O 0.2 g,微量元素溶液1 mL,液体石蜡4%(体积分数),酵母膏1.0 g,葡萄糖10.0 g,去离子水1 L,于112℃下灭菌20 min,葡萄糖单独灭菌.培养条件:XH1菌株种子液置于30℃、140 r/min的摇床中培养.
平板培养基:牛肉膏5.0 g,蛋白胨10.0 g,NaCl 5.0 g,琼脂粉20.0 g,葡萄糖5.0 g,去离子水1 L,pH=7.0,于112℃下灭菌20 min.
模型乳状液的配制方法见文献[9].
1.1.3 实验仪器和设备
紫外-可见分光光度计:北京普析通用仪器有限公司T6新世纪;低温高速离心机:SIGMA 2-16PX型;乳化剪切机:FLUKO awdel F6/10.
1.2 实验方法
1.2.1 诱变方法
1)紫外诱变.对数期的XH1菌株离心10 min(5 kr/min)收集菌体制成菌悬液,用生理盐水洗涤悬浮后的菌悬液放于直距30 cm、20 W紫外灯下照射一定时间后,在红灯下稀释适当倍数,取0.1 mL涂平板30℃光培养,计平板菌落数,计算致死率,绘制致死曲线并挑出菌落形态差异明显的突变菌落继代培养.
2)1-甲基-3-硝基-1-亚硝基胍(NTG)诱变.对数期的XH1菌株离心10 min(5 kr/min)收集菌体制成菌悬液,用pH 7.0的0.05 mol/L的磷酸缓冲液配制一定质量浓度的NTG溶液,取1 mL菌悬液加入9 mL pH 7.0的0.05 mol/L的磷酸缓冲液充分混合,于37℃下震荡培养30 min后,取2 mL加入10 mL 0.07 mol/L Na2HPO4液中止,稀释后取0.1 mL涂平板,30℃,计平板菌落数,计算致死率,绘制致死曲线.
1.2.2 致死率的计算及菌株初筛
致死率/%=[(对照1 mL菌液中的活菌数-处理后1 mL菌液中的活菌数)/对照1 mL菌液中的活菌液]×100.
紫外诱变以80%左右的致死率确定诱变时间,NTG诱变以70%~80%左右的致死率确定诱变时间后,在平板上随机挑取直径较大的单菌落进行初筛.
1.2.3 复筛及破乳剂产生菌破乳性能的测定
复筛时选取初筛中发生正突变的菌株,采用液态发酵,测定每株菌株发酵液的破乳能力,并测试其连续传代后的破乳能力,考察突变体的遗传稳定性.原始菌株和突变体的破乳率和生物量的测定方法见文献[9].
2 结果与分析
2.1 紫外线辐射后突变株的选择
通过不同紫外线辐照时间对出发菌株XH1的致死率和正突变率的双重影响来确定最佳紫外辐射强度,通过比较突变株与出发菌株破乳率的高低来计算正变率,结果见图1.随紫外线照射时间的增加,细菌死亡率也逐渐增加,当紫外辐照时间达2 min时,出发菌株XH1的死亡率为83.13%,这时细菌的正突变率相对最大为27.57%,因此,确定紫外线最佳辐射时间为2 min.紫外线诱变筛选突变菌株的过程见文献[10],随机挑取直径较大的单菌落放入发酵培养基中培养24 h,测试其破乳能力,初选出8株正突变菌株(表1所示),经过连续传代后测其破乳能力,考察突变体的遗传稳定性.大多数突变菌株显示出不稳定的破乳性能遗传特性,破乳能力都有所下降.综合对比后筛选出4株破乳能力相对稳定的突变株,分别命名为XV2、XV7、XV15和XV26.其中,XV2的12 h和24 h的破乳率分别比原始菌株XH1高出42.4%和12.4%,因此选择其为下一轮诱变的出发菌株.

图1 紫外辐照时间对XH1致死率和正突变率的影响
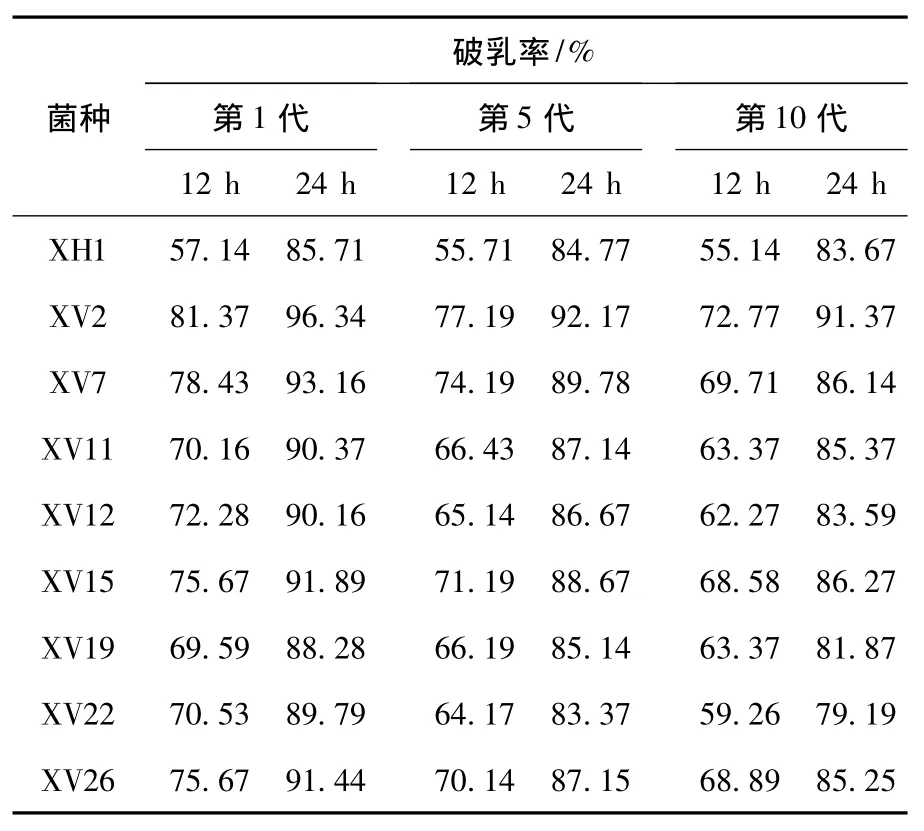
表1 紫外诱变筛选突变菌株破乳能力的传代稳定性
2.2 紫外线与NTG复合诱变高效生物破乳剂产生菌突变株的选择
2.2.1 NTG最佳处理剂量的选择
超诱变剂亚硝基胍(NTG)能使细胞发生一次或多次突变,在复制叉附近1个基因突变能诱发附近位置的基因陆续连锁突变[11-12].以经过紫外辐射筛选出的XV2为初发菌株,经NTG质量浓度分别为20、40、60、80、100 mg/L处理20 min后,其致死率和正突变率结果见图2.随着NTG质量浓度的增加,菌体死亡率也随之增加.当NTG质量浓度为40 mg/L时,菌株XV2的死亡率达73.64%,正突变率为21.47%,菌体的死亡率较高而且可以保障较高的正突变率,因此,确定NTG的最佳处理质量浓度为40 mg/L.
2.2.2 紫外线与NTG复合处理突变株的选择
将经NTG处理后的菌株XV2的菌悬液接种到筛选培养基中,置于摇床转数为140 r/min的培养条件下,30℃培养3~5 d后,将菌液梯度稀释后,均匀涂布于平板培养基中,随机挑取直径较大的单菌落放入发酵培养基中培养24 h,测试破乳能力.在大量的突变体中筛选出3株破乳能力明显高于XV2的突变菌株,分别命名为XN5、XN17和XN23.经过连续的传代进行遗传稳定性考察,结果显示XN5的破乳能力比较稳定,见表2.XN5的12 h和24 h破乳率分别为94.17%和98.67%,比其出发菌株XV2分别提高了15.73%和2.42%,比原始菌株XH1提高了64.81%和15.12%.
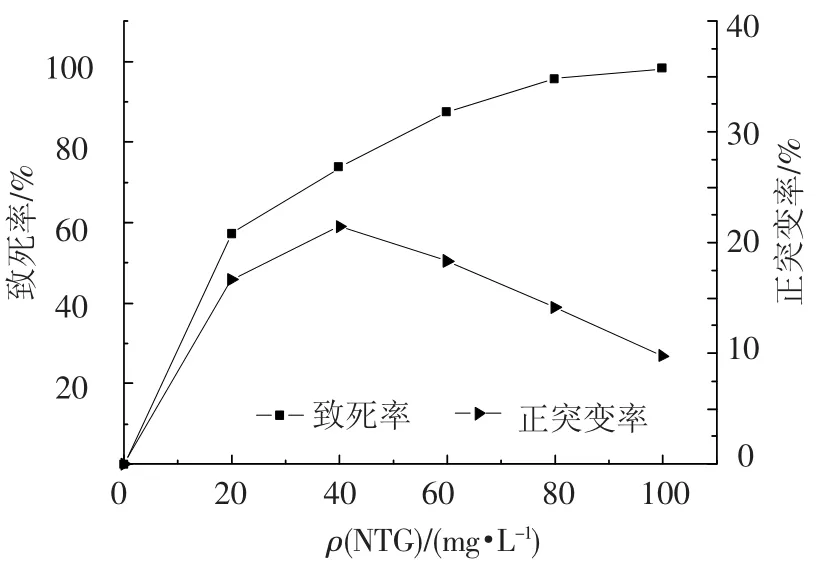
图2 NTG质量浓度对XV2致死率和正突变率的影响

表2 紫外与NTG复合诱变筛选突变菌株破乳能力的传代稳定性
2.3 复合诱变后的菌株XN5与原始菌株XH1破乳性能的对比
在碳源为葡萄糖10 g/L和液体石蜡的混合碳源,其中液体石蜡投加量为4%(质量分数),氮源为NH4Cl 4.0 g/L与酵母膏的混合氮源,其中酵母膏投加量为1.0 g/L,温度30℃,初始pH=6.5,摇床转数为140 r/min的培养条件下,探讨了突变体XN5和原始菌株XH1生长曲线的对比和不同培养时间破乳率的变化(图3、4所示).通过对比发现突变株和原始菌株的生长曲线没有明显区别,都在14~26 h时处于对数生长期,26 h以后进入了稳定期和衰亡期,但是单位体积发酵液中的生物量,突变菌株与原始菌株相比有所提高.培养时间在14~24 h时,突变株和原始菌株都具有较高的破乳活性,而且突变菌株的破乳能力明显优于原始菌株,突变菌株的破乳速率也明显高于原始菌株,当培养时间为20 h时,突变菌株12 h的破乳率比原始菌株提高了64.81%.

图3 突变体XN5和原始菌株XH1的生长曲线对比
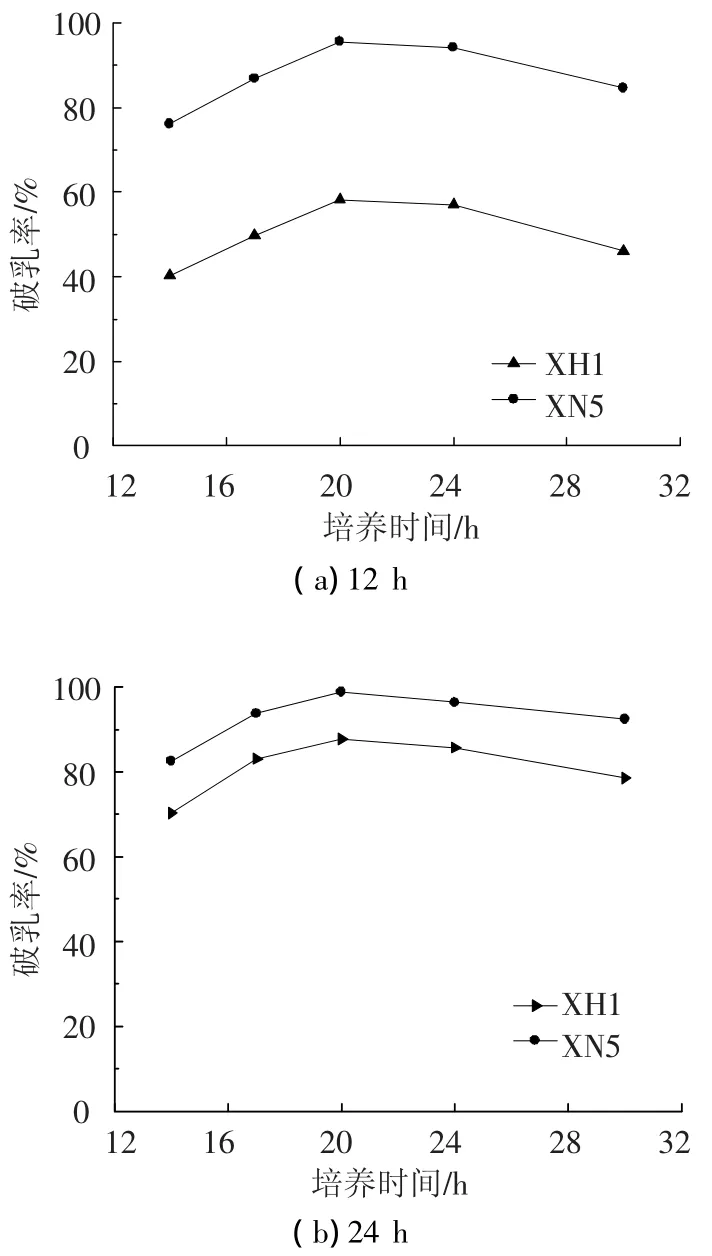
图4 突变体XN5和原始菌株XH1不同培养时间破乳率对比
3 结论
1)紫外和亚硝基胍具有很好的协同作用,利用二者复合处理诱变对象,使诱变产生的突变体后代遗传基础比较复杂,在世代分离选择中通过优良基因的重组和累加,可获得较高的正突变率,是生物破乳剂产生菌诱变育种的一种好方法.
2)生物破乳剂产生菌Bacillus mojavensis XH1在采用紫外和亚硝基胍(NTG)复合诱变后筛选出了一株遗传特性稳定、破乳性能更高的突变体XN5.突变株XN5的12 h和24 h破乳率分别为94.17%和98.67%,比原始菌株XH1提高了64.81%和15.12%.
3)在最佳培养条件下,突变菌株XN5和出发菌株XH1的生长曲线基本一致;在不同的培养时间下,突变菌株的12 h和24 h破乳率比原始菌株XH1分别提高了35.91%~38.53%和10.6%~13.95%.
[1]NADARAJAH N,SINGH A,WARD O P.De-emulsification of petroleum oil emulsion by a mixed bacterial culture[J].Process Biochemistry,2002,37(10):1135-1141.
[2]MADHUSWETA D.Characterization of de-emulsification capabilities of a micrococcus species[J].Bioresource Technology,2001,79(1):15-22.
[3]NADARAJAH N,SINGH A,WARD O P.Evaluation of a mixed bacterial culture for de-emulsification of waterin-petroleum oil emulsions[J].World J Microbiol Biotechnol,2002,18(5):435-440.
[4]NISHIMAKI F,TAKAHASHI N,TSUCHIDA T,et al.Microorganisms,demulsifiers and processes for breaking an emulsion:US,5989892[P].1999-11-23.
[5]DAS M.Characterization of de-emulsification capabilities of a micrococcus species[J].Bioresource Technology,2001,79(1):15-22.
[6]方云,夏咏梅.生物表面活性剂[M].北京,中国轻工业出版社,1992.
[7]侯红萍,杜文娟.微波诱变筛选高产纤维素酶菌株[J].中国酿造,2008(24):44-46.
[8]兰时乐,李立恒,王晶,等.微波诱变结合化学诱变选育纤维素酶高产菌的研究[J].微生物学杂志,2007,27(1):22-25.
[9]侯宁,马放,李大鹏.高效破乳菌的破乳效能及活性成分[J].石油学报(石油加工),2009,25(3):435-441.
[10]ZAKOUR R A.Site-specific mutagenesis by error-directed DNA synthesis[J].Nature,1982,295:708-710.
[11]施巧琴.工业微生物育种学[M].北京:科学出版社,2003.
[12]郑国香,任南琪,李永峰,等.三种化学诱变剂对产氢细菌Ethanoligenens sp.ZGX4的诱变效应[J].太阳能学报,2008,29(1):61-64.

