Zn-PANi二次电池循环寿命影响因素
韩家军,程瑾宁,耿 林
(1.哈尔滨工业大学材料科学与工程学院,150001哈尔滨;2.哈尔滨工业大学(威海)海洋学院,264209山东威海)
随着能源危机的出现,新能源和新的储能方式的研发得到了普遍重视,传统的铅酸蓄电池和镍镉蓄电池污染严重,锂离子电池价格过于昂贵.导电聚合物聚苯胺(PANi)制备简单且无毒,因此,Zn-PANi二次电池的研究受到广泛关注[1-3].对于电池而言,循环寿命是一个重要的指标.PANi在充放电过程中,阴离子的掺杂与脱掺杂不影响PANi的分子结构,其理论循环次数高达数千次,而锌则具有很好的可逆电沉积特性.所以,理论上Zn-PANi电池应该具有很长的循环寿命.但对Zn-PANi电池的深入研究表明,Zn-PANi电池的循环寿命往往只有300~400次[4-5],远远达不到理论寿命.
目前,Zn-PANi电池在经过一定循环之后,比容量都有不同程度的下降,而且比容量越高,下降幅度越大.S.Neves等[6]采用硅溶胶作为模板制备了PANi电极,其比容量高达335 mAh·g-1,然而循环20次之后,比容量下降至223 mAh·g-1,下降幅度超过30%.目前,国内外关于Zn-PANi电池循环寿命的研究非常少[7-8].电池的循环寿命取决于如下因素[9]:正极材料过充降解、负极钝化、枝晶、集流体腐蚀和电解液干涸等.本文主要通过电化学方法对上述影响因素进行研究,加速了Zn-PANi电池的工业化进程.
1 实验
1.1 主要试剂和原料
苯胺,分析纯,经减压蒸馏后使用;其余均为分析纯试剂,锌片质量分数为99.9%.
1.2 聚苯胺的制备
A液:取700 mL浓度为1.5 mol·L-1的盐酸,在搅拌情况下加入0.62 mol苯胺,转入冰水浴中至温度降至10℃以下.B液:取300 mL浓度为1.5 mol·L-1的盐酸,加入过硫酸铵0.62 mol,搅拌至过硫酸铵全部溶解.在搅拌情况下,将B液滴入A液中,滴加时间控制在1 h内.滴加结束后,继续搅拌,反应15 h,整个反应过程温度控制在10℃以下.反应结束后,用去离子水反复冲洗产物直至滤液pH=6~7,于60℃烘干24 h后备用.
1.3 电池的组装
电池外壳为一端封闭绝缘硬质塑料管.阳极为高纯锌片(负极过量),用300目砂纸打磨光洁.隔膜为双层的玻璃纤维隔膜,厚度0.8 mm.电池装备工艺如下:双层隔膜与锌片平行叠在一起,将其卷绕成中空的圆柱形并刚好可以装入绝缘塑料外壳中.将1.0 gPANi粉末和0.2 g石墨(325目)在玻璃研钵中仔细研磨,然后将混合粉末填充到锌片与隔膜围成的圆柱形中空处并压实.在粉末中心处压入直径为3 mm的圆柱形集流体,滴加电解液至隔膜被完全浸润,密封处理.电解液为:2 mol·L-1ZnSO4+0.5 mol·L-1(NH4)2SO4+15 g·L-1H3BO3,用氨水调节pH值为3.4~3.6.
1.4 研究方法
1)正极过充降解:锌片作为负极,确保负极和电解液远远过量.充电过程中,初始上限电压为1.68 V,在第4和第10周期电池的充电上限电压分别调为1.70和1.72 V,加速阴极分解.根据文献[10-11]所述,聚苯胺的主要分解产物是对苯二酚,分别在两个电池的电解液中加入4和20 mg·L-1的对苯二酚,观察其充放电比容量的变化(为了减小过充分解问题,充电上限电压设定为1.65 V).
2)负极钝化:将打磨后锌片80℃烘2 h,表面形成钝化膜,然后用于组装电池,充电上限1.68 V.
3)锌板枝晶:Zn-PANi电池进行一定的循环次数后(上限电压和下限电压分别为1.65和0.7 V),拆开电池,更换锌片和隔膜,继续测量电池比容量.
4)集流体腐蚀:采用失重法研究集流体循环过程中的腐蚀情况.分别采用石墨、316不锈钢和纯镍作为集流体.实验前集流体先称重,实验后将电池拆开,集流体洗净、烘干后进行称重.
5)电解液干涸:将新装配的电池称重后,用移液管加入一定量电解液(电解液过量30%),充足电后测量电池内阻,放完电后置于硅胶干燥箱中干燥一定时间,记录电池减少的质量(即损失电解液量),然后再将电池进行充电,如此重复4次.
1.5 电化学测试
充放电曲线:将新装配好的电池静置2 h,以约为0.2C进行放电,首先放电至0.7 V;放电结束静置1 h后转充电,充电电流为0.2C,充电电压达到设定值后转恒压充电,直至电流小于0.1C;静置1 h后转放电,0.2C恒流放电直至电压低于0.7 V.电池充放电测量使用电池充放电测试仪(兰电公司);电池内阻测试采用蓄电池内阻测试仪BT-6100(台湾群菱公司).
2 结果与讨论
2.1 正极过充降解
图1(a)为不同充电电压下电池的充放电曲线.图1(b)是由图1(a)获得的放电比容量和库伦效率曲线.当电压上限为1.68 V时,电池比容量为93.7 mAh·g-1,库仑效率为98.2%;电压上限提高至1.70 V,电池比容量为97.1 mAh·g-1,但库仑效率下降为95.1%;电压上限提高到1.72 V时,电池比容量为110 mAh·g-1,此时库仑效率已降至86.3%.当电压上限再次恢复到1.68 V,电池比容量为90.2 mAh·g-1,低于初始比容量,库仑效率为99.1%.这说明过高的充电电压上限有利于提高电池比容量,而过高充电电压又导致正极材料分解,使库仑效率下降.一般维持电池的库仑效率为95%~100%,因此,电池充电电压上限不应超过1.70 V.
图2(a)是在电解液中加入不同质量浓度的对苯二酚,电池的充放电曲线.图2(b)是加入不同量对苯二酚,电池经50个循环的比容量和库仑效率.由图2可知,充放电初期,空白电池比容量为96.1 mAh·g-1,库仑效率为97.4%;电解液中含4 mg·L-1对苯二酚的电池比容量为92.4 mAh· g-1,库仑效率为92.7%;而20 mg·L-1时电池的比容量为90.3 mAh·g-1,库仑效率为85.4%.即随着对苯二酚质量浓度的增大,电池比容量和库仑效率不断降低.已经证明过高充电电压导致聚苯胺分解为对苯二酚,该产物能够在电池正极被氧化成对苯二醌,而对苯二醌在负极被还原成对苯二酚.在浓差作用下,它们在正负极的反复扩散会导致电池的自放电,使电池比容量和库仑效率降低.综上所述,正极材料的分解会导致电池比容量下降,而其分解产物使得电池产生自放电,库仑效率降低,这是导致Zn-PANi电池循环寿命短的重要原因.因此,必需严格控制电池充电电压的上限,不应超过1.65 V.
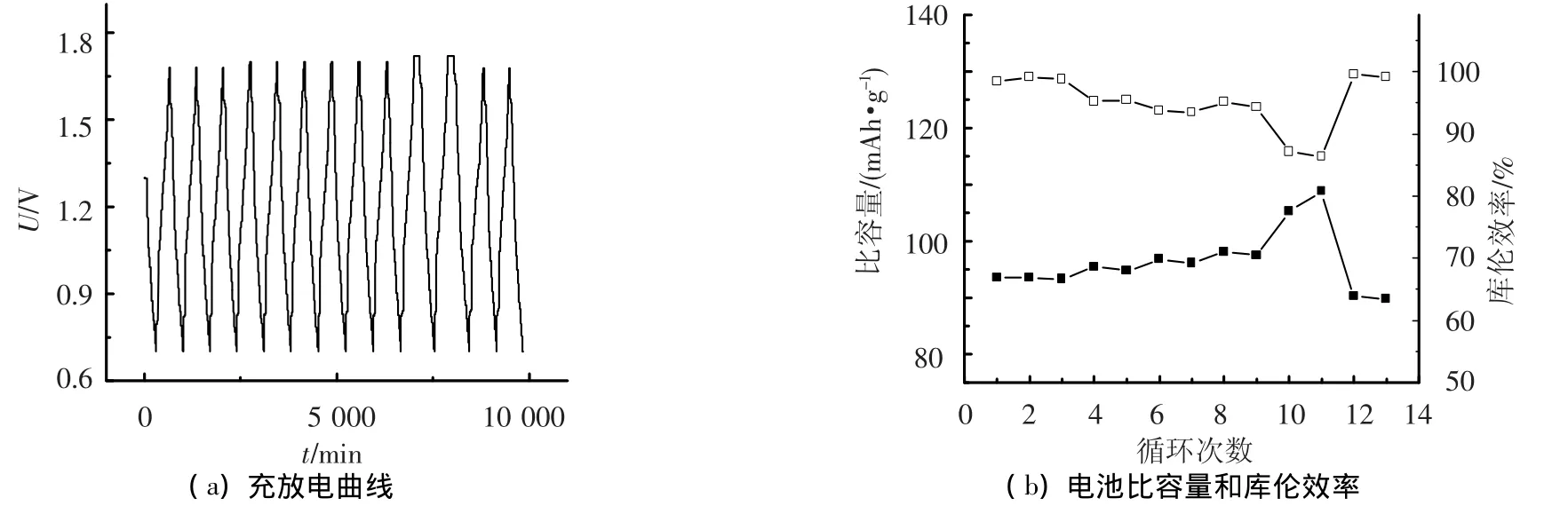
图1 充电电压上限对电池比容量和库仑效率的影响
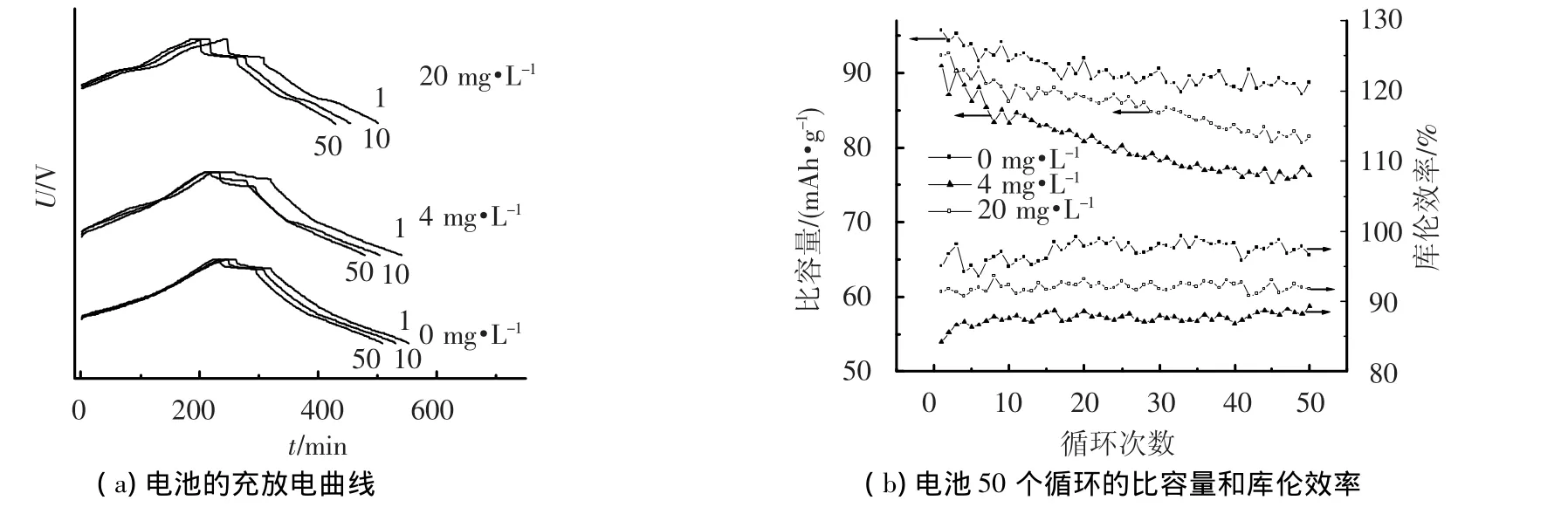
图2 对苯二酚对电池比容量和库仑效率的影响
2.2 负极钝化
图3(a)是未钝化和钝化后锌负极的充放电曲线.图3(b)是由两种锌板10个周期充放电循环的电池比容量和库仑效率.由图3可知,钝化后的负极初次放电比容量仅为78.1 mAh·g-1,大幅度小于正常负极的初次放电比容量100.2 mAh·g-1;但第2个循环,钝化负极的电池比容量增至86 mAh·g-1,第3个循环已达94.5 mAh·g-1,与正常负极的电池比容量97.1 mAh·g-1基本一致;第4个循环后,钝化和未钝化负极比容量基本相同.从库仑效率来看,钝化负极初期库仑效率高达99.1%,4个循环后,两种电池的库仑效率也基本一致.这是因为负极的表面存在钝化膜(主要是氧化锌),导致电池内阻增大,同样的充放电制度下,钝化的电池不能充分放电,所以比容量低.由于负极钝化导致正极不能充分放电,余留的正极比容量在下一个周期释放,所以库仑效率很高.随着充放电循环,钝化膜被破坏并还原成金属锌,电池比容量逐渐恢复.综上所述,由于氧化或者大电流放电导致负极钝化,从而引起电池比容量大幅度下降.但这是一个可逆或者是一个可自我修复的过程,电池经过5个正常充放电循环后,比容量可以得到恢复.
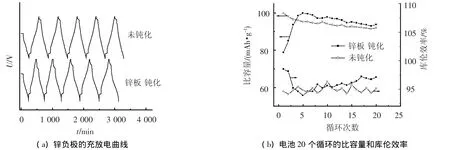
图3 钝化对电池比容量和库仑效率的影响
2.3 枝晶
从图4(a)可以看出,随着循环的进行,Zn-PANi电池的比容量在缓慢下降,但是到第71个循环时,电池比容量下降比较快;而在第74个循环,电池比容量急剧下降至71.54 mAh·g-1,同时,库伦效率也降至26.3%.结合图4(b),电池恒压段充电时间很长,而且充电电流反而越充越大,这是枝晶穿透隔膜导致电池短路的缘故;电池静止1 h后,开路电压降至1.33 V,远远低于正常电池的1.56 V.在第75个循环更换负极和隔膜后,电池比容量恢复至88.9 mAh·g-1,还略高于第71个周期,说明正极并未出现太大问题.综上所述,在第70个循环后,负极枝晶穿透隔膜形成电池内部短路,这是导致Zn-PANi电池寿命终止的主要因素.
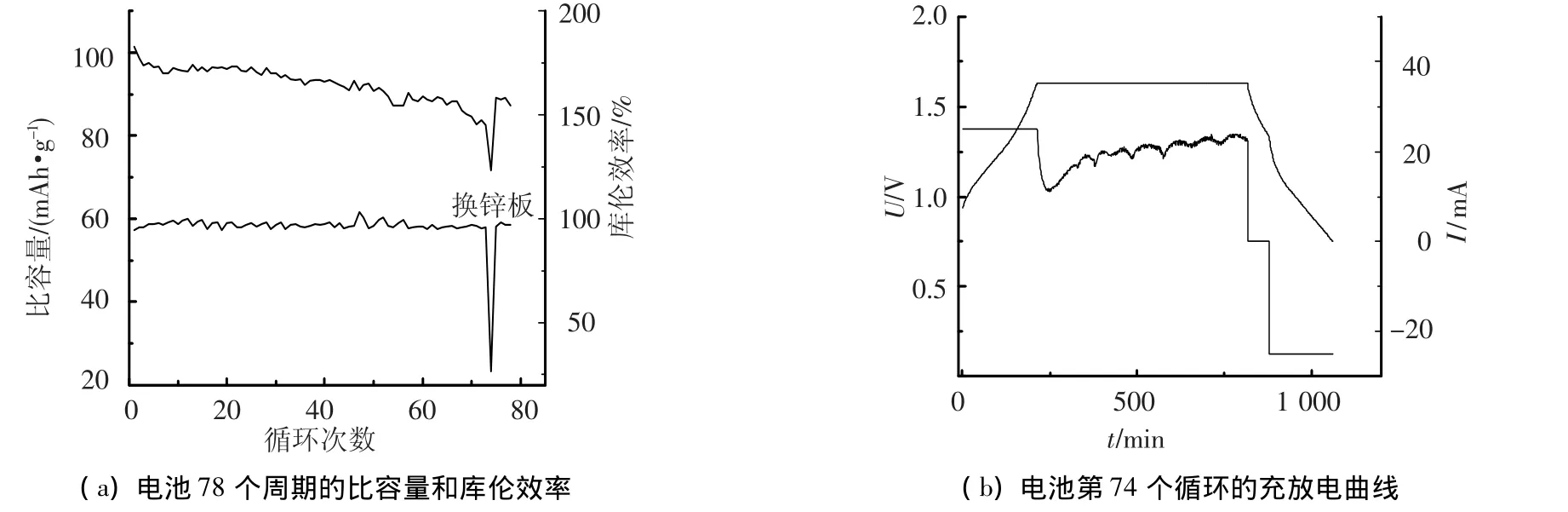
图4 枝晶对电池循环寿命的影响
2.4 集流体腐蚀
由表1可知,石墨和316不锈钢集流体,20个循环,集流体几乎没有失重,50个循环,石墨和不锈钢失重低于3%,电池的比容量和库伦效率都很正常.但是,对于镍集流体,5个循环失重高达13.1%.而14个循环就出现集流体断裂,使电池比容量下降,此时集流体失重达23.1%.而且,每次循环电池的比容量和库伦效率都低于采用石墨和316不锈钢,这是因为镍基集流体在充放电过程中发生电化学腐蚀,同时形成的Ni2+扩散至负极被还原成镍锌合金,导致电池比容量和库伦效率降低.由此可见,正极集流体腐蚀会导致电池比容量和库伦效率大幅度下降,但是通过选择合适的集流体腐蚀问题可以避免.
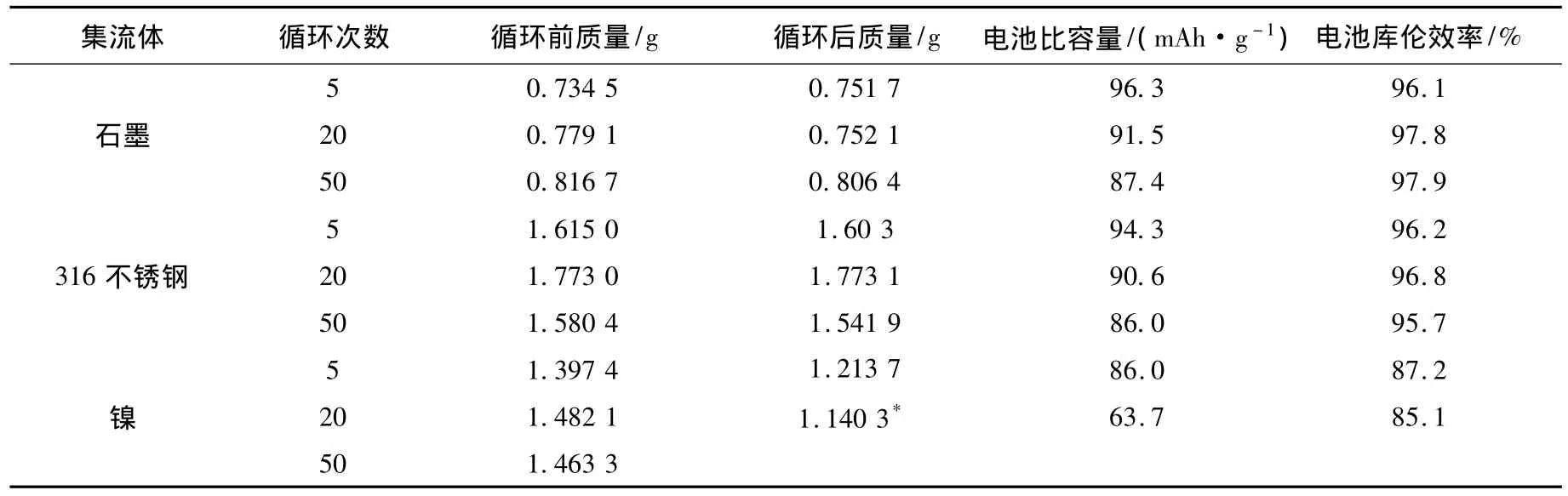
表1 集流体的腐蚀对电池比容量和库伦效率的影响
2.5 电解液干涸
理论上而言,1Ah的Zn-PANi电池需要硫酸根和锌离子约为18.7 mmol,根据电解液中离子浓度可知,理论上需要约9.33 mL电解液.然而为了保证电解液的电导率,减少内阻,一般电解液是过量的.图5(a)是电解液失重不同时,电池的充放电曲线,图5(b)是对应的电池比容量和内阻.由图5可知,电解液失重6.1%时,电池的充放电曲线基本不变,电池比容量差别不大,内阻反而有所降低,这是因为失去少量电解液,不影响电极和电解液的接触面积,反而使电解液浓度增大,电池内阻下降.当电解液失重14.2%时,电池比容量轻微下降,但是电池内阻明显上升;当电解液失重22.1%时,电池比容量明显下降,电池内阻也大幅度增加;当电解液失重34.9%时,电池充足电后开路电压仅为1.41 V,同时比容量急剧下降,内阻急剧增加.这是因为当电解液失重较多时,隔膜电解液少,与电极接触面积小,内阻大,进而导致比容量下降.对于Zn-PANi电池,只有当电解液失重较多时才会发生比容量的大幅度下降,这与传统的铅酸和镍镉电池存在明确区别.理论计算,假设Zn-PANi加入电解液过量30%,电池充放电库伦效率为95%,不考虑正极分解,由于充放电导致电解液失重至22%需要超过800个循环,而枝晶问题仅仅在70个循环后就出现了.综上所述,电解液干涸不是影响电池寿命的重要因素.
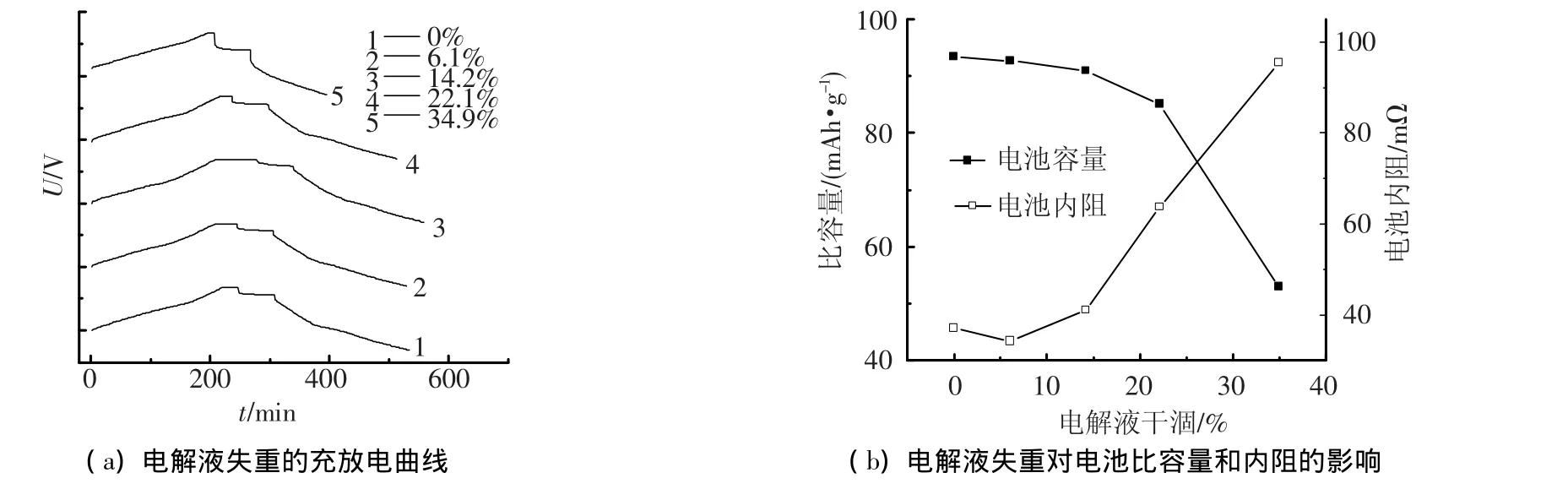
图5 电解液干涸对电池的影响
3 结论
1)电池寿命最主要影响因素是负极枝晶的形成,进而形成电池内部短路而寿命终止,此问题必须通过更换电池隔膜和加入添加剂加以解决.
2)电池过充导致正极材料分解,造成电池的自放电,这对电池寿命影响较大,可通过适当降低电池充电电压上限(不超过1.65 V)来解决该问题,但同时会导致电池比容量下降.
3)电解液干涸也会导致电池的寿命减小,但不是主要因素,可通过电解液过量(多加30%)的方法大幅度延长电池循环寿命.
4)负极钝化对电池寿命影响不大,一旦出现,电池比容量将大幅度下降,但是经过5个循环后,比容量可以得到恢复.
5)正极集流体腐蚀对电池寿命影响不大,通过正极集流体选择合适的材料(如石墨、碳等),腐蚀问题是可以解决的.
[1]LI Shengqi,ZHANG Guolin,JING Guolin,et al.Aqueous zinc—polyaniline secondary battery[J].Synthetic Metals,2008,158:242-245.
[2]JUGOVI'CA B Z,TRIˇSOVI'CA T L,STEVANOVI'C J,et al.Novel electrolyte for zinc-polyaniline batteries[J].Journal of Power Sources,2006,160:1447-1450.
[3]苏光耀,高德淑,林成章,等.聚苯胺-锌二次电池的充放电特性[J].电池,1996,26(6):268-270.
[4]RAHMANIFAR M S,MOUSAVI M F,SHAMSIPUR M,et al.What is the limiting factor of the cycle-life of Zn-polyaniline rechargeable batteries[J].Journal of Power Sources,2004,132:296-301.
[5]KAN Jinqing,XUE Huaiguo,MU Shaolin.Effect of inhibitors on Zn-dendrite formation for zinc-polyaniline secondary battery[J].Journal of Power Sources,1998,74:113-116.
[6]NEVES S,FONSECA C P.Influence of template synthesis on the performance of polyaniline cathodes[J].Journal of Power Sources,2002(107):13-17.
[7]陈永红,魏亦军,徐俊.Zn-纳米TiO2-聚苯胺二次电池的充放电性能[J].应用化学,2004,2(12): 1285-1289.
[8]GHANBARI K,MOUSAVI M F,SHAMSIPUR M,et al.Synthesis of polyaniline/graphite composite as a cathode of Zn-polyaniline rechargeable battery[J].Journal of Power Sources,2007(170):513-519.
[9]郭炳焜,李新海,杨松青.化学电源-电池原理及制造技术[M].长沙:中南工业大学出版社,2000:31-38.
[10]DINH H N,DING J,XIA S J,et al.Multi-technique study of the anodic degradation of polyaniline films[J].J Electroanal Chem,1998,459:45-46.
[11]YANG Xiaohui,XIE Qingji,YAO Shouzhuo.A comparative study on polyaniline degradation by an electrochemical quartz crystal impedance system:electrode and solution effects[J].Synthetic Metals,2004,143:119-128.

