黄芪汤对肝硬化大鼠肝脏卵圆细胞肝向分化的作用*
朱 英 刘 平
1.大连医科大学附属第一医院 (辽宁 大连,116011) 2.上海中医药大学
目前纤维化或早期硬化组织器官的结构重构成为现代生物医学中的重大科学问题,而干细胞已成为组织器官结构重构过程中的研究焦点。干细胞是一类具有自我更新和多向分化增殖潜能的原始细胞,其对细胞的生理性更新、对病理性损伤的反应与修复以及组织重构都具有重要意义。
研究显示肝损伤过程中,干细胞参与了肝细胞再生和肝损伤修复,骨髓、胚胎等多种来源的干细胞也具有向肝细胞分化的潜能,因此从干细胞的角度探讨肝细胞再生机制及再生肝脏功能具有可行性和重要性。
本研究应用二甲基亚硝胺 (DMN)造成类似于人类的大鼠肝硬化模型,应用较为敏感的Thy-1.1作为肝脏卵圆细胞(HOC)标记物,观察HOC在肝硬化形成与消减过程中的动态变化;同时应用双重荧光免疫激光共聚焦检测技术观察HOC的分化取趋向,应用黄芪汤治疗,观察黄芪汤在肝硬化逆转中的作用及其对HOC的影响,探讨中药在肝硬化组织重构过程中的作用与意义。
1 材料与方法
1.1 动物与试剂 wistar大鼠,雄性,体重160g±15g,清洁级,由中国科学院上海实验动物中心提供。于上海中医药大学实验动物中心清洁区动物房饲养、造模和观察,自由饮食。DMN为东京化成工业株式会社产品:lot.MAL05。鼠抗Thy1.1单克隆抗体为SeroTec公司产品;鼠抗CK19和AFP单克隆抗体为北京中杉金桥生物技术有限公司产品;激光共聚焦检测用cy3标记 (红色)羊抗单克隆抗体及FITC标记 (绿色)驴抗单克隆抗体均为Jackson Immuno Research公司产品。
1.2 药物与仪器 黄芪汤(《和剂局方》,由黄芪、炙甘草、大枣组成)、由上海中医药大学附属曙光医院国家中医药管理局中药制剂中心进行水煎浓缩取汁,制成流浸膏,冷冻干燥,闭光保存。激光共聚焦显微镜,为日本OLYMPUS公司产品,共聚焦型号为 FV1000SIMS Scanner,所用谱线为 488nm、543nm两种激光谱线,物镜为 PLSAPO60X(数值孔径为1.4),显微镜型号为IX81。
1.3 实验方法
1.3.1 模型制备 87只雄性,wistar大鼠,重量为160g±15g。除正常组25只外,其余62只均参照Jenkins等人的方法制备DMN肝硬化模型。按DMN 10mg·kg-1剂量 (用生理盐水稀释)处理动物,腹腔注射,每周连续3天,1次/d,共4周。正常组大鼠腹腔注射同等量生理盐水。分别于造模后3天、2周、4周、6周、8周时均随机处死造模大鼠6只,正常组大鼠3只,进行肝脏动态观察。
1.3.2 分组与给药 4周造模完成后,将50只造模大鼠随机分为模型组25只,黄芪汤组25只。黄芪汤组大鼠于第5周第1天起,按60kg成人体重日剂量的公斤体重剂量10倍量灌胃 (10ml·kg-1体重的剂量),1次/d,共两周;正常组(10只)及模型组大鼠以同体积生理盐水给予灌胃。
1.3.3 观察指标 观察大鼠血清肝功能羟脯氨酸 (Hyp)含量变化,观察肝组织HE染色、胶原纤维染色结果并进行肝组织HOC透射电镜检测。肝组织α-SMA(α-平滑肌肌动蛋白)Thy1.1免疫组化观测,用 Envision法;肝组织 α-SMA、Thy1.1蛋白定量分析用免疫印迹法;肝组织AFP、CK19与Thy1.1共定位,采用双重荧光免疫共聚焦激光扫描显微镜技术检测 (Double Immuno Confocal Laser Scan Microscopy,DICLSM)。取冰冻肝组织切片,丙酮固定10分钟,Blocking Buffer室温封闭1小时,加鼠抗Thy1.1抗体4℃过夜,加cy3标记羊抗鼠二抗室温避光2小时,4%PFA固定20分钟,加抗鼠AFP、CK19抗体室温2小时,加FITC标记驴抗鼠二抗室温避光2小时,moviol封片,于激光共聚焦显微镜检测。
1.4 统计学方法 计量资料用计算机统计软件SPSS 10.0中的ANOVA程序进行单因素方差分析,并用LSD程序进行两两比较。
2 结果
2.1 3 组大鼠肝功能检测结果 见表1。
表13 组大鼠肝功能检测结果比较(±s)
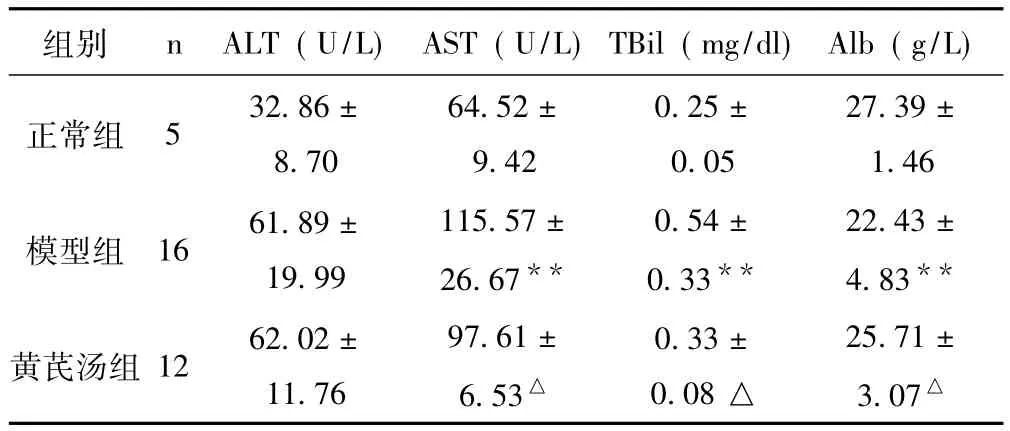
表13 组大鼠肝功能检测结果比较(±s)
与正常组比较,**P<0.01,与模型组比较,△P<0.05
组别 n ALT(U/L) AST(U/L)TBil(mg/dl) Alb(g/L)正常组 5 32.86 ±8.70 64.52 ±9.42 0.25 ±0.05 27.39 ±1.46模型组 16 61.89±19.99 115.57 ±26.67**0.54 ±0.33**22.43 ±4.83**黄芪汤组 12 62.02±11.76 97.61 ±6.53△0.33 ±0.08 △25.71 ±3.07△
2.2 3 组大鼠肝组织羟脯氨酸 (Hyp)检测结果见表2。
表23 组大鼠肝组织Hyp检测结果比较(±s)
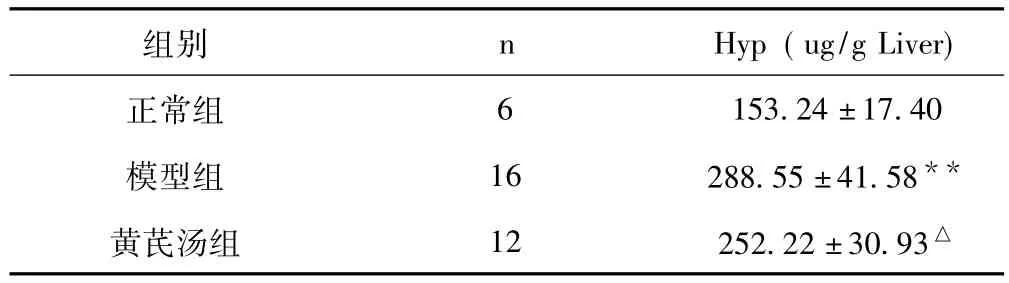
表23 组大鼠肝组织Hyp检测结果比较(±s)
与正常组比较,**P<0.01,与模型组比较,△P<0.05
组别 n Hyp(ug/g Liver)正常组6153.24 ±17.40模型组 16 288.55 ±41.58**黄芪汤组 12 252.22 ±30.93△
2.3 3 组大鼠肝组织HE染色结果 见插页图1。
2.4 3 组大鼠肝组织天狼星红染色结果 见插页图2。
2.5 3 组大鼠肝组织α-SMA蛋白表达 结果显示,实验6周时模型组大鼠肝组织α-SMA表达明显多于正常组,主要表达于星状细胞,位于汇管区、纤维间隔及肝窦部位。与模型组大鼠比较,黄芪汤组大鼠α-SMA表达减少。α-SMA蛋白免疫印迹分析结果显示,6周模型组大鼠α-SMA蛋白表达量显著高于正常组。与模型组比较,黄芪汤组表达量显著减少。
2.6 3 组大鼠肝组织AFP,CK19与Thy1.1共定位 见表3。
表3 3组大鼠肝组织AFP,CK19与Thy1.1共定位 (±s)
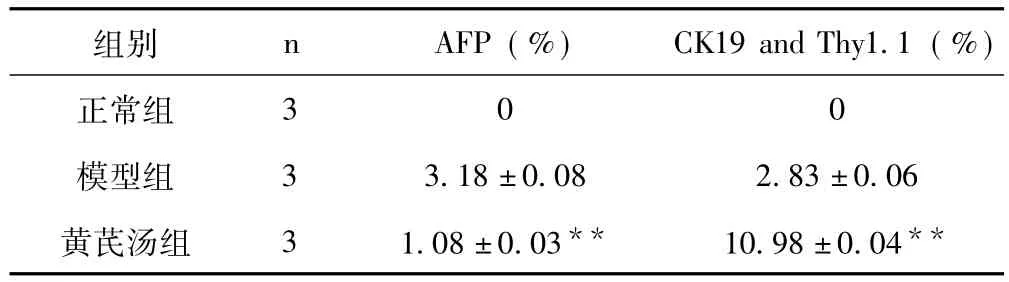
表3 3组大鼠肝组织AFP,CK19与Thy1.1共定位 (±s)
与模型组比较,**P<0.01
组别 n AFP(%) CK19 and Thy1.1(%)正常组300模型组 3 3.18 ±0.08 2.83 ±0.06黄芪汤组 3 1.08±0.03** 10.98±0.04**
2.7 AFP与Thy1.1共定位的变化 正常组大鼠肝组织中未见到AFP与Thy1.1共定位阳性细胞表达,6周时模型组大鼠肝组织有较多表达;与模型组比较,黄芪汤组大鼠肝组织AFP与Thy1.1共定位阳性细胞表达量显著降低 (P<0.01),(见插页图3)。
2.8 CK19与Thy1.1共定位的变化 正常组大鼠肝组织中未见到CK19与Thy1.1共定位阳性细胞,6周时模型组大鼠肝组织有显著表达;与模型组比较,黄芪汤组大鼠肝组织中CK19与Thy1.1共定位阳性细胞表达量显著增加 (P<0.01),(见插页图4)。
3 讨论
近年来,随着干细胞研究的不断深入,越来越多的研究表明,干细胞移植治疗肝病具有重要的临床应用价值。大量体内外研究表明干细胞可以促进损伤肝脏的修复、改善患者症状、提高患者存活率[1,2]。干细胞是一类具有自我更新和多向分化潜能的原始细胞,根据其生存阶段分为胚胎干细胞(embryonic stem cells)和成体干细胞 (adult stem cells),胚胎干细胞因伦理问题应用受到限制,而成体干细胞包括造血干细胞、骨髓干细胞、神经干细胞、肝干细胞等有很好的应用前景。骨髓干细胞主要从自体和异体骨髓中获得,无论是在生理条件还是病理情况下,骨髓干细胞均可以分化为成熟肝细胞[3],而且在肝脏受损伤时,骨髓干细胞更容易定植于肝脏[4],目前研究较多的是自体骨髓干细胞和骨髓间充质干细胞 (Bone mesenchymal stem cells,BMSCs)[5,6],国内外学者在干细胞标记、分离、培养及移植等方面做了大量的研究工作。干细胞移植能够帮助患者度过危险期、等待损伤肝脏的再生,在终末期肝病治疗中具有明显的优势。
DMN大鼠肝硬化形成过程中存在肝脏卵圆细胞的动态变化,即细胞的数量随着肝纤维化程度的不断加重而增加;在停止DMN造模两周后,即于肝纤维化开始消减时,该细胞数量的增加更为显著,随着肝纤维化的消减、停止DMN造模4周后,其数量有所减少。表明肝脏卵圆细胞的此种动态变化与大鼠肝硬化的形成与消减的病理变化有关,尤其对肝纤维化的消减具有重要病理生理意义[7~11]。
黄芪汤能显著降低肝硬化大鼠血清AST、TBil和肝组织Hyp含量;可明显改善肝组织炎症和纤维化程度,减少肝组织α-SMA的表达。在DMN大鼠肝纤维化逆转过程中,黄芪汤可使Thy1.1标记的HOC的数量显著增加,同时使Thy1.1与CK19共定位细胞数量显著增加,使HOC表型和功能发生改变,促使其向生理性成熟细胞 (尤其是胆管细胞)定向分化,从而促进损伤肝脏组织的重构而恢复肝脏功能。
益气的黄芪汤可促进已经成型的DMN大鼠肝硬化的逆转,其主要作用机制可能与其直接促进HOC的表达数量有关,诱导HOC向胆管上皮细胞分化,同时对HOC向肝细胞的分化有一定的抑制作用。进一步深入研究该方剂诱导HOC分化的作用机制不仅有重要的应用价值,对中医药基础研究也将有重要的理论意义。
[1]PAREKKADAN B,VAN POLL D,SUGANUMA K.et al.Mesenchym-al stem cell-derived molecules rever se fulminant hepatic failure[J].PLos one,2007,(2):941-944.
[2]AGNIESZKA B,TAKUMI T,YUSUKE Y,et al.Rapid hepatic fate specification of adipose-derived stem cells and their therapeutic potential for liver failure [J].J Gast ro Hepatol,2009,24:70277-70230.
[3]展玉涛,陈红松,刘宾,等.骨髓干细胞在大鼠肝再生环境中的分化 [J].临床肝胆病杂志,2006,22(2):121-122.
[4]向国安,张刚庆,方驰华,等.同种异体骨髓间质干细胞移植在大鼠肝内定居能力初步研究 [J].第一军医大学学报,2005,25(8):994-997.
[5]林沪,陈黎明,施明,等.干细胞治疗肝脏疾病新进展 [J].肝脏,2010,15(1):49-51.
[6]耿莹,韩明子,洪钰,等.不同移植途径对大鼠骨髓干细胞迁移至肝脏及分化的影响[J].中华器官移植杂志,2008,29(7):402-404.
[7]朱英,刘平.Thy1.1阳性肝脏卵圆细胞在大鼠肝硬化形成与消减过程中的动态表达 [J].中华肝脏病杂志,2005,13(11):823-827.
[8]朱英,刘平.肝脏卵圆细胞在二甲基亚硝胺致大鼠肝硬化形成过程中表达的动态变化及其意义[J].国外医学·消化系疾病分册,2005,25(1):60-63.
[9]朱英,刘平,龙爱华.二甲基亚硝胺所致大鼠肝硬化形成与逆转过程中Thy1.1与OV6阳性染色细胞比较 [J].世界华人消化杂志,2005,13(8):953-957.
[10]朱英,刘平.干细胞在肝脏损伤时的作用机制探讨[J].实用肝脏病杂志,2005,8(2):111-113.
[11]朱英,刘平.肝脏卵圆细胞定向分化在二甲基亚硝胺大鼠肝硬化消减过程中的意义 [J].大连医科大学学报,2007,29(2):106-109.

