肥大细胞与过敏性哮喘
沈士亮
(哈佛大学医学院Brigham Women's 医院 内科,美国波士顿)
组织内的肥大细胞来源于骨髓、脐带血的干细胞。体外培养CD34+造血干细胞,在IL-3 的作用下,可产生肥大细胞;而IL-4 和其他的基质蛋白则影响肥大细胞的成熟。哺乳类动物组织内的肥大细胞主要分布于机体与外界环境相通的地方,如皮肤、气道和消化道,这些部位经常可以接触到病原体、过敏原以及环境中的其他物质。肥大细胞在这些物质的刺激下,脱颗粒、释放胞浆递质。组织内的肥大细胞具有较长的生存期,在适当的刺激条件下,可以再次进入细胞周期并增殖。
哮喘是一种具有不同临床症状的呼吸道慢性炎症性疾病,在世界范围内分布广泛,西方国家大约8% 的成人和14% 的小孩患有哮喘,其表现主要取决于临床特征和呼吸道的炎症类型。肥大细胞在哮喘发生早期起关键性的作用,哮喘病人的肺组织及冲洗液中含有大量的肥大细胞。
1 哮喘和肥大细胞
哮喘病人主要的病理生理的特征:①呼吸道炎症;②支气管分泌增加和堵塞。炎细胞浸润,如T细胞、中性和嗜酸性白细胞,浸润的炎细胞的类型取决于哮喘的临床表现、时间长短和严重程度以及治疗方法。组织内的肥大细胞来源于多功能的骨髓造血干细胞,其血液中的前体细胞呈CD34 阳性。肺、皮肤和小肠都含有丰富的肥大细胞,它们常常围绕血管、淋巴管、神经和毛囊分布。正常情况下,呼吸道的肥大细胞位于支气管黏膜下的血管附近,非常有趣的是哮喘病人,肥大细胞可迁移到其他部位,如黏膜上皮层内、腺体(图1B,箭头所示)和呼吸道平滑肌(图1)。肥大细胞位于引起哮喘的关键性结构周围,以及在体外试验中它们和气管平滑肌之间的直接反应的现象,都提示肥大细胞在哮喘的病理生理学上起一个重要的作用[1]。肥大细胞释放β 胰蛋白酶可以引起平滑肌内表达TGF-β1,增加肌肉细胞收缩性[2]。气管平滑肌细胞能增加肥大细胞成活率,并引起它们脱颗粒,这是一种新的不依赖于抗原的肥大细胞的激活方式[3],但是肥大细胞并不影响平滑肌细胞的增生和成活率[4]。Th1 和Th2 都可以使哮喘病人的呼吸道平滑肌细胞分泌吸引肥大细胞的趋化物质,但对正常的平滑肌则没有这种作用[5]。
过敏性哮喘的病人,吸入的过敏原和肥大细胞的膜上的IgE 结合导致细胞释放过敏的介质,如组织胺、白细胞介素、蛋白酶和前列腺素等,这些物质在病人的肺-支气管冲洗液中含量增高。这些递质可导致血管扩张、平滑肌收缩和黏膜分泌;它们也可以引起过敏性炎症后期的炎细胞浸润。嗜酸性白细胞、CD4+T 细胞、中性白细胞、肥大细胞和嗜碱性白细胞和支气管壁的水肿有关,并增加非特异性的气道过敏反应(air hyperresponsiveness,AHR)。对组织胺和白细胞介素受体的拮抗剂或抗IgE 抗体的研究证明它们能够大大地改善过敏的早期和部分后期的反应,这也进一步说明肥大细胞在过敏性哮喘中的重要作用。
分析哮喘病人的支气管组织活检标本的炎症状况,特别是肥大细胞的酶的表达,可为病理诊断、临床治疗提供一定的参考。目前主要根据它们的胞浆颗粒所含有的酶进行分类,我们发现哮喘病人肺组织内的大多数肥大细胞有的含有胰蛋白酶(图1B),而含有糜蛋白酶(图1C)和含羟基肽酶A(carboxipeptidase A,CPA)(图1D)的数量则相对较少。
2 过敏性哮喘和肥大细胞的动物模型
啮齿类动物有两种肥大细胞:一种是黏膜层内的肥大细胞(MMC),而另一种是位于黏膜下结缔组织内的肥大细胞(CTMC)。在小鼠的过敏性肺炎,气管和肺组织的肥大细胞增加。气管的CTMC 和因炎症诱导而进入上皮层内的肥大细胞(MMC)酶的表达完全一致;支气管的近端CTMCs 和气管CTMCs的酶表达相同(图2 左和右),而MMCs 酶的表达则不同,它们表达mMCP(mouse mast cell protease)1,2,6 和7,但不表达mMCP 4,5 和CPA3(图2 中)。肺部的过敏性炎症所诱导的MMCs 的酶的表达和蠕虫感染的肠道炎症不同。在蠕虫感染小鼠的小肠,黏膜下层的肥大细胞呈mMCP 4,5 阳性(图3C、D);而迁移到黏膜上皮内的肥大细胞mMCP 1 染色呈现阳性(图3B),肠黏膜内肥大细胞CAE(Chloroacetate esterase)染色也呈现阳性(图3A)。因此,局部组织在肥大细胞的酶的表达方面起重要的调节作用[6]。

图1 哮喘病人肺组织内肥大细胞蛋白酶的表达
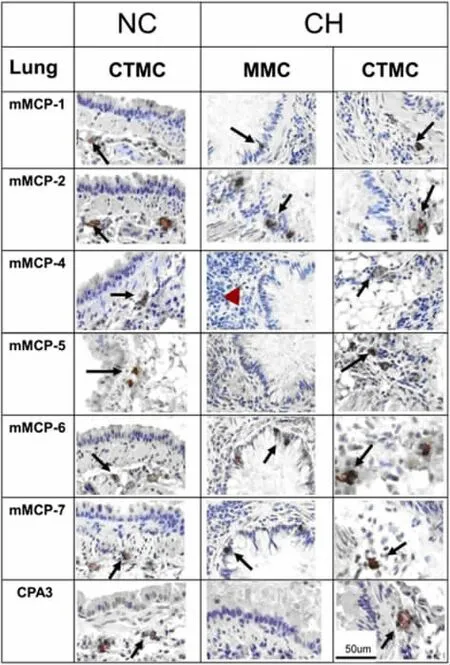
图2 小鼠肺支气管CTMCs 和MMCs 的蛋白酶表达
尽管有了上述的发现阐述了局部组织环境对肥大细胞酶的表达的影响,我们还需要用动物实验来研究哮喘的发生和发展时的分子及细胞的相互反应,进一步阐明肥大细胞在过敏性哮喘发病时的作用和功能。动物模型有助于发现肥大细胞在过敏哮喘发病中的许多病理生理方面的重要作用。小鼠模型使我们能够深入细致地研究肥大细胞在呼吸道过敏疾病发生中的作用。研究人员首先注射抗原和佐剂使动物致敏,再经过呼吸道服用致敏原,然后对比性研究正常的和丧失肥大细胞、B 细胞、IgE 或FcεRI 的小鼠的呼吸道的过敏反应和炎症。某些研究揭示肥大细胞能够增加肺组织的嗜酸性细胞,从而诱导呼吸道过敏反应或纤维化。许多免疫接种方法中都用佐剂诱导炎症,佐剂可引起强烈的辅助性T 细胞(Th2)的浸润[7]。其实,某些佐剂具有直接作用于肥大细胞和巨嗜细胞的作用[8]。然而,不加佐剂的致敏方法亦可证明肥大细胞在诱发过敏性呼吸道疾病时的功用。研究人员已经进一步阐述了FcεRI 在呼吸道的过敏反应和炎症发生中的重要作用[9]。另外,通过骨髓来源的肥大细胞移植到肥大细胞缺失的动物的方法,来分析肥大细胞介质的作用也是一种很好的研究方法。人们通常用小鼠和大鼠的模型来分析过敏性呼吸道疾病的发病机理,虽然这些动物模型具有许多的人体哮喘特征,但我们必须了解由于人和啮齿类动物之间在生理学上的巨大差异,动物模型研究中的发现不能够直接用于人体。

图3 感染小鼠小肠组织内肥大细胞蛋白酶的表达
3 过敏性哮喘时肥大细胞中间介质
3.1 肿瘤坏死因子(TNF) 移植缺失TNF 或正常小鼠的骨髓肥大细胞到无肥大细胞的小鼠体内,比较其结果发现接受前者骨髓的小鼠显示较轻微的炎症和呼吸道过敏反应[10]。许多不同的动物和人体的研究都支持这个结果。和健康人相比,哮喘病人的呼吸道的TNF 表达水平升高,健康人经气道吸入TNF 会诱发炎症和呼吸道的过敏反应。通过小鼠模型的研究也证实了TNF 在诱发呼吸道黏膜基因的表达起了很重要的作用,而且在后期的反应中也是不可缺少的,与正常的动物相比,TNF 缺失的动物失去诱发过敏性呼吸道疾病的能力[11]。
3.2 组织胺 另一个来源于肥大细胞的介质是组织胺,它通过4 个不同的受体作用于不同的细胞。根据受体表达的水平和细胞的类型,组织胺可能有促进和抗炎症的不同效果。激活树突状细胞,细胞膜上的组织胺受体Ⅰ、Ⅲ(H1R、H3R)和组织胺结合后增加抗原的呈递、细胞因子的产生和T1 辅助细胞(Th1)激活而促进炎症反应。而激活的组织胺受体Ⅱ(H2R)能引起IL-10 分泌,调节树突状细胞所产生的效应。根据受体表达的类型,组织胺能够诱导T 细胞产生Th1 型细胞因子如IFN-γ 或Th2 型细胞因子如IL-4 和IL-3。最近,人们已经证明肥大细胞的组织胺促进炎症的作用,可能是通过抑制CD4+、CD25+阳性的调节T 细胞获得的。Bryce 等[12]显示在过敏呼吸道疾病,组织胺通过H1 受体而发挥重要作用。实验亦证明随着致敏和随后的抗原刺激,H1 受体缺失动物不能够产生过敏性呼吸道的疾病。特别是H1 受体缺失动物的肺组织没有T 细胞的迁入。由于H4 受体在组织胺诱导的过敏性呼吸道疾病中似乎也起重要作用,已经发现它的拮抗剂在小鼠过敏性呼吸道疾病发生中显示了有效的抑制作用[13]。
3.3 前列腺素 肥大细胞也具有合成不同的脂质中间体的能力。很有趣的是随着致敏和抗原的刺激,高表达前列腺素D2(PGD2)的动物比正常动物有较为严重的呼吸道炎症,并增加Th2 型细胞因子的产生。进一步在呼吸道抗原刺激前吸入PGD2 引起严重的过敏性呼吸道疾病,而阻止PGD2 的合成则能减轻炎症,PGD2 的这些效果取决于它们的不同受体。两个PGD2 的受体已被描述,PGD2 受体1(DP1)有增强炎症的作用,而Th2 细胞上的PGD2受体2 或化学吸引物的同源受体(DP2 或CRTH2)的功能比较复杂。在呼吸道过敏性疾病的模型,CRTH2 的激活剂加强呼吸道的炎症,而受体的拮抗剂则能减低炎症[14]。然而,在CRTH2 受体缺失的动物,随着致敏和抗原的刺激,与正常的对照组相比,这种动物的呼吸道有更多的嗜酸性细胞和较高水平的IL-5。随着单纯的PDG2 的刺激,人的表达CRTH2 的Th2 细胞增加Th2 型细胞因子的产生。这就提示阻断CRTH2 受体可能是治疗过敏性哮喘的一个很好的方法,且CRTH2 的拮抗剂正在临床试验中。
3.4 白三烯(Leukotrienes) 白三烯也是肥大细胞产生的能够影响过敏性呼吸道疾病的脂质中间体,花生四烯酸是白三烯合成的原始物质。一个多蛋白复合体,包括5-脂质氧化酶(5-Lo)引起游离花生四烯酸转变为具有活性的白三烯A4(LTA4),后者被进一步的代谢为不同的白三烯亚型(LTC4,LTD4 和LTE4)。LTC4 合成酶在诱导cys-白三烯的合成过程中是一个关键性的酶,而LTB4 的转变是LTA4 水解酶所引起的。许多研究发现LTs 吸引T 细胞和树突状细胞的作用是非常重要的[15]。LTC4 和LTD4 通过CysLT2 受体而发挥起生物学功能,在引起肺纤维化和血管损伤中尤显重要[16]。吸入LTE4,引起炎细胞向肺组织迁移。总之,前列腺素和白三烯在调节和吸引免疫细胞方面是非常重要的。因此,这些中间体在肥大细胞诱导的获得性免疫反应中是一个关键成员。
3.5 胸腺基质lymphopoitein(TSLP) TSLP 主要是由角化细胞、上皮细胞和基质细胞所产生的一种细胞因子。哮喘病人的肺组织内的TSLP 的表达升高,缺失TSLP 受体的小鼠不会产生呼吸道过敏性疾病[17]。在人体和小鼠,TSLP 也能激活树突状细胞,从而导致Th2 细胞诱导现象。因此,TSLP 是调节获得性免疫Th2 的一个重要因子。当TSLP 和肥大细胞表达TSLP 受体结合后,能促使Th2 细胞因子的表达。另外,随着IgE 介导激活,肥大细胞能够产生高水平的TSLP,这在由于过敏而引起的TSLP的表达是非常重要的[18]。
4 结论
概括的說,肥大细胞在先天和获得性免疫反应中起一个非常重要的作用,这主要是因为它们能够产生不同的炎症和过敏的介质。一旦介质被激活,就能够促进抗原呈递细胞迁移到局部的淋巴结。随后,肥大细胞在某些情况下,能有力促进特异性T细胞反应的发生。不管是人的还是小鼠实验模型的过敏性哮喘,肥大细胞均能够促进呼吸道的炎症和AHR,也累及到几种肥大细胞介质的分泌。总之,这些发现清楚地显示肥大细胞在过敏反应中不仅仅是效应细胞,而且在诱导和调节获得性免疫反应中起着复杂的作用。至于过敏,肥大细胞的激活似乎是特异性T 细胞对过敏原的反应重要的调节步骤,因此,调节肥大细胞的激活可能是预防和治疗过敏性疾病的潜在治疗方法。
[1]YANG W,KAUR D,OKAYAMA Y,et al.Human lung mast cells adhere to human airway smoothmuscle,in part,via tumor suppressor in lung cancer-1[J].J Immunol,2006,176:1238 -1243.
[2]WOODMAN L,SIDDIQUI S,CRUSE G,et al.Mast cells promote airway smooth muscle cell differentiationvia autocrine up-regulation of TGF-beta 1[J].J Immunol,2008,181:5001 -5007.
[3]HOLLINS F,KAUR D,YANG W,et al.Human airway smooth muscle promotes human lung mast cellsurvival,proliferation,and constitutive activation:cooperativeroles for CADM1,stem cell factor,and IL-6[J].J Immunol,2008,181:2772 -2780.
[4]KAUR D,HOLLINS F,SAUNDERS R,et al.Airway smooth muscle proliferation and survival is notmodulated by mast cells[J].Clin Exp Allergy,2010,40:279 -288.
[5]SUTCLIFFE A,KAUR D,PAGE S,et al.Mast cell migration toTh2 stimulated airway smooth muscle from asthmatics[J].Thorax,2006,61:657 -662.
[6]XING W,AUSTEN KF,GURISH MF,et al.Protease phenotype of constitutive connective tissue and of induced mucosal mast cells in mice isregulated by the tissue[J].PNAS,2011,108(34):14210-14215.
[7]EISENBARTH SC,COLEGIO OR,O'CONNOR W,et al.Crucial role for the Nalp3 inflammasome in theimmunostimulatory properties of aluminium adjuvants[J].Nature,2008,453:1122 -1126.
[8]MCKEE AS,MUNKS MW,MACLEOD MK,et al.Alum induces innate immune responsesthrough macrophage and mast cell sensors,but thesesensors are not required for alum to act as an adjuvant forspecific immunity[J].J Immunol,2009,183:4403 -4414.
[9]YU M,TSAI M,TAM SY,et al.Mastcells can promote the development of multiple features ofchronic asthma in mice[J].J Clin Invest,2006,116:1633 -1641.
[10]NAKAE S,HO LH,YU M,et al.Mast cell-derived TNF contributes to airway hyperreactivity,inflammation,and Th2 cytokine production in an asthma modelin mice[J].J Allergy Clin Immunol,2007,120:48 -55.
[11]NAKAE S,LUNDERIUS C,HO LH,et al.TNF can contribute to multiple features of ovalbumin-induced allergic inflammation of the airways in mice[J].J Allergy ClinImmunol,2007,119:680 -686.
[12]BRYCE PJ,MATHIAS CB,HARRISON KL,et al.The H1 histamine receptor regulates allergic lungresponses[J].J Clin Invest,2006,116:1624 -1632.
[13]COWDEN JM,RILEY JP,MA JY,et al.Histamine H4 receptor antagonism diminishes existing airwayinflammation and dysfunction via modulation of Th2 cytokines[J].Respir Res,2010,11:86.
[14]ULLER L,MATHIESEN JM,ALENMYR L,et al.Antagonism of the prostaglandin D2 receptorCRTH2 attenuates asthma pathology in mouse eosinophilicairway inflammation[J].Respir Res,2007,8:16.
[15]TAUBE C,MIYAHARA N,OTT V,et al.The leukotriene B4 receptor (BLT1)is required foreffector CD8+T cell-mediated,mast cell-dependent airwayhyperresponsiveness[J].J Immunol,2006,176:3157 -3164.
[16]UZONYI B,LÖTZER K,JAHN S,et al.Cysteinyl leukotriene 2 receptor and proteaseactivatedreceptor 1 activate strongly correlated early genes inhuman endothelial cells[J].Proc Natl Acad Sci USA,2006,103:6326 -6331.
[17]LI YL,LI HJ,JI F,et al.Thymicstromal lymphopoietin promotes lung inflammation throughactivation of dendritic cells[J].J Asthma,2010,47:117 -123.
[18]MIYATA M,NAKAMURA Y,SHIMOKAWA N,et al.Thymic stromal lymphopoietin is a criticalmediator of IL-13-driven allergic inflammation[J].Eur J Immunol,2009,39:3078 -3083.

